基于高密度遗传图谱的水稻穗长QTL定位与分析
韦敏益,张月雄,马增凤,黄大辉,刘 驰,秦媛媛,卢颖萍,鄢柳慧,,吴子帅,周小龙,吴旭祥,秦 钢
(1 广西农业科学院 水稻研究所/广西水稻遗传育种重点实验室,广西 南宁 530007;2 广西农业科学院 农业科技信息研究所,广西 南宁 530007;3 广西农业科学院 柳州分院/柳州市农业科学研究中心,广西 柳州 545000;4 广东茂名农林科技职业学院,广东 茂名 525000)
水稻OryzasativaL.是我国最重要的粮食作物之一,提高水稻产量是水稻研究者的主要育种任务之一。水稻的有效穗数、穗粒数和粒质量是决定其产量的重要因素[1]。穗长是与产量相关的性状之一,与水稻产量密切相关,可作为产量育种的选择标准[2]。穗长是典型的数量性状,并由主数量性状座位(Quantitative trait locus,QTL)和次QTL控制[3]。据统计(http://www.gramene.org),到目前为止,已检测到超过250个穗长QTL,分布在12条染色体上。然而,只有少数基因被克隆并应用于水稻育种中。DEP1基因是一个控制我国水稻产量的关键多效基因,其能促进细胞分裂,通过缩短穗节间长度使稻穗变密、枝梗数増加,同时增加穗粒数,从而提高产量[4]。SP1编码一个可能的多肽转运蛋白(Peptide transporter,PTR),通过调节穗分生组织的活性来调节水稻的穗长[5]。DEP2编码一个目前功能未知的植物特有蛋白,通过影响穗指数生长时期的细胞增殖决定穗的生长和伸长[6]。DEP3编码一个含有马铃薯糖蛋白样磷脂酶A2 (Phospholipase A2,PLA2)超家族结构域的蛋白,在高产中发挥着重要作用[7]。大穗基因LP(EP3)编码含有Kelch重复序列的F-box蛋白,LP可能参与调节植物组织中的细胞分裂素水平从而影响穗长、一级枝梗数和籽粒数[8]。同时,许多穗部性状基因也是多效性的,例如MOC1[9]、LAX1[10]和IPA1(OsSPL14、WFP)[11]等基因同时影响着穗长、分枝数和分蘖等多个性状;而OsSPL18的缺陷降低了粒宽、粒厚和穗长,但增加了分蘖[12]。
穗长的遗传因素及其对水稻产量提高的影响尚未得到充分认识[13-14]。深入挖掘与穗长相关的新基因将有助于揭示决定各种类型的品种特异性穗结构的基本机制,对于水稻穗型塑造及提高水稻产量有着重要意义。
本研究以2个优良亲本‘R8605’和‘ZP37’及其杂交衍生的208个高世代重组自交系(Recombinant inbred lines,RILs)为作图群体,利用通过全基因组重测序构建的包含2 193个bin标记高密度连锁图谱,在3种不同环境下定位和分析穗长QTL,寻找新的、可稳定遗传的的位点,同时分析他们的聚合效应,以期为水稻穗长相关基因的精细定位、克隆及分子育种提供依据。
1 材料与方法
1.1 试验材料
‘ZP37’来自广西农业科学院水稻研究所抗性育种研究室收集的一个地方品种,具有茎秆粗壮、穗长短、二次支梗极多和抗病性强等特点;‘R8605’是由广西农业科学院水稻研究所选育的籼粳型恢复系,具有稻穗极长、耐冷和优质高产等特点。以‘R8605’为父本、‘ZP37’为母本杂交获得F1,收获F1代种子后多代自交,使用单粒传法构建了一套包含208个家系的重组自交系群体(F8:9代)。亲本和RILs均于2019年早造和2020年晚造种植于广西南宁市,以及2022年晚造种植于广西桂平市,3种环境分别命名为2019、2020和2022,早造的播种和插秧时间分别为每年的3月1日和4月2日,晚造的则分别为7月18日和8月4日。每个RIL或亲本采用块体设计,每个株系种6行,每行6株,行株距为20 cm×20 cm。单苗栽插,田间管理同当地大田栽培管理。
1.2 表型调查和数据分析
水稻成熟时,每株选取3个较大的穗子,测量穗长,即穗颈节至穗顶(不含芒)的长度,计平均值。每个株系随机选取3株单株,以3株的平均值为最终的表型值。
用WPS office Excel对数据进行记录、分析处理以及绘制RIL群体的不同性状在多个环境下的直方图。以DPS v9.01进行统计分析,采用LSD法检测差异显著性。
1.3 QTL定位
前期我们对‘R8605’和‘ZP37’及其杂交衍生的208个高世代重组自交系群体分别进行全基因组重测序,以‘日本晴’基因组(IRGSP 1.0)作为SNP检测的参考基因组,获得526 957个高质量、双等位基因、纯合的SNP标记。使用滑动窗口方法,构建了一个高密度遗传图谱,共包含2 193个bin标记。12条染色体的总图距1 542.27 cM,每条染色体平均标记数为182.75个;遗传距离为68.68~193.02 cM,平均遗传距离为128.52 cM,相邻2个bin标记间的平均遗传距离和物理距离分别为0.76 cM和201.29 kb[15]。利用QTL IciMapping软件3.4版,采用完备区间作图法(Inclusive composite interval mapping,ICIM)[16-17],设定PIN为0.001,以1 cM为步长,对目的性状进行全基因组扫描,设定似然函数比对数值(Log of odds,LOD)阈值为3.0。以LOD峰值作为该QTL的LOD值,以LOD峰值位置的Bin标记估算QTL的效应,并计算各个QTL的加性效应和对该性状的贡献率,遵循Mccouch等[18]的原则命名QTL。加性效应为正表明增效等位基因来自亲本‘ZP37’,为负则表明来自亲本‘R8605’。
1.4 稳定QTL位点的聚合效应分析
将在2个及2个以上环境下能重复检测到的位点称为稳定QTL位点。分析稳定QTL位点定位区间内的bin标记的基因型,记为ZP37型、R8605型以及少数存在的杂合类型。分析RIL群体中增效等位基因的分布情况,将聚合不同数量有利基因的RIL群体进行分组,通过评价各组别的性状表现以分析聚合不同数量有利基因的聚合效应。
2 结果与分析
2.1 亲本‘ZP37’‘R8605’及RIL群体的穗长表型分析
对亲本‘ZP37’‘R8605’和208个RIL株系在3个不同的环境下的穗长进行考查和统计分析。‘ZP37’的穗长分别为23.10、23.57和23.48 cm,而‘R8605’的穗长分别为37.56、34.63和32.05 cm,3个环境下‘R8605’的穗长均极显著高于‘ZP37’(图1、表1)。
重组自交系群体在3个环境下穗长的平均值分别为29.08、26.50、26.29 cm,变幅分别为23.20~38.67、19.87~37.20、20.86~33.80 cm,呈现出广泛的变异和明显的超亲现象(图1)。对穗长的频率分布及峰值进行分析发现,3个环境下重组自交系群体的穗长峰度和偏度的绝对值都小于1,呈现连续变异的近正态分布,且3个环境下的变化趋势相似,说明为多基因控制的数量性状,符合QTL区间作图的要求(表1、图2)。
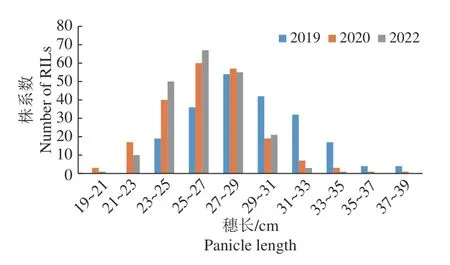
图2 不同环境下RIL群体穗长分布Fig.2 Distribution of panicle length in the RIL population in different environments
2.2 穗长QTL定位
对在3个不同环境下种植的RIL群体的穗长进行QTL分析,共检测到11个QTL(表2)。其中,2019年共检测到 5个 QTL,分别位于第4、8、9和12 染色体上,LOD 为 3.07~5.99,单个贡献率介于2.17%~5.87%。2020 年共检测到5个 QTL,分别位于第3、4、7 和8 染色体,LOD 为 3.11~12.87 ,单个贡献率介于2.28%~10.94%。2022 年共检测到5个QTL,分别位于第4、7、8和9染色体,LOD值为3.12~6.33,单个贡献率介于2.75%~6.39%。其中4个QTL(qPL4-2、qPL7-1、qPL8-1和qPL9)是在2个不同的环境下均被检测到。

表2 不同环境下水稻穗长QTL 分析Table 2 QTL analysis of panicle length under different environments
qPL4-2位于第4染色体的24.26—24.40 Mb处,在2019和2020年2个环境中均被检测到,表现出较强的稳定性。在2019和2020年环境下检测到的LOD分别为3.81和3.94,可分别解释2.17%和2.66%的表型变异。
qPL7-1位于第7染色体的14.36—14.98 Mb处,在2020和2022年2个环境中均被检测到,表现出较强的稳定性。在2020和2022年环境下检测到的LOD分别为5.21和3.14,可分别解释2.45%和2.75%的表型变异。
qPL8-1位于第8染色体的25.11—26.01 Mb处,在2020和2022年2个环境中均被检测到,表现出较强的稳定性。在2020、2022年环境下检测到的LOD分别为12.87和6.33,可分别解释10.94%和6.39%的表型变异。
qPL9位于第9染色体的20.56—20.77 Mb处,在2019和2022年2个环境中均被检测到,表现出较强的稳定性。在2019和2022年环境下检测到的LOD分别为3.22和5.42,可分别解释3.08%和4.88%的表型变异。
第3染色体上共定位到2个穗长相关的QTL,分别位于6.99—7.20 Mb和7.32—7.89 Mb处,均是在2020年环境下检测到的,增效基因均来自于‘R8605’。qPL3-1的LOD约为3.11,贡献率为2.28%。qPL3-2的LOD约为3.43,贡献率为2.89%。
第4染色体上除定位到了在2个环境下检测到的qPL4-2,还在2022年环境下检测到了qPL4-1,定位于20.62—20.70 Mb处,增效基因来自于‘R8605’,LOD约为6.22,贡献率为4.54%。
第7染色体上除定位到了在2个环境下检测到的qPL7-1,还在2022年环境下检测到了qPL7-2,定位于17.32—17.42 Mb处,增效基因来自于‘ZP37’,LOD约为3.12,贡献率为2.77%。
第8染色体上除定位到了在2个环境下检测到的qPL8-1,还在2019年环境下检测到了qPL8-2,定位于27.50—27.68 Mb处,增效基因来自于‘R8605’,LOD约为5.99,贡献率为5.87%。
第12染色体上共定位到2个穗长相关的QTL,分别位于7.17—7.40 Mb和14.72—14.92 Mb处,均是在2019年环境下检测到的,增效基因均来自于‘R8605’。qPL12-1的LOD约为3.31,贡献率为4.02%。qPL12-2的LOD约为3.07,贡献率为2.70%。
以上QTL的增效等位基因大部分来自大穗亲本‘R8605’,说明大穗亲本中的QTL位点对穗长具有明显的增效作用(表2)。
2.3 3个稳定QTL位点的聚合效应分析
在所定位到的11个穗长相关QTL中,有4个QTL即qPL4-2、qPL7-1、qPL8-1和qPL9在2个不同环境下均被检测到,表现出稳定的遗传效应。本研究对其中的3个QTL(qPL4-2、qPL8-1和qPL9)的聚合效应进行分析,根据3个位点的bin标记基因型,先去除杂合类型,然后将RIL群体分为8种组合类型,依次命名为Hap1~Hap 8 (表3)。对不同组合类型的表型值和增效等位位点的数量关系进行分析,结果表明:在3个不同的环境下,随着不同株系中增效等位QTL的增加,穗长表现出了累加效应,穗长增加,且大部分株系之间差异显著(表3)。
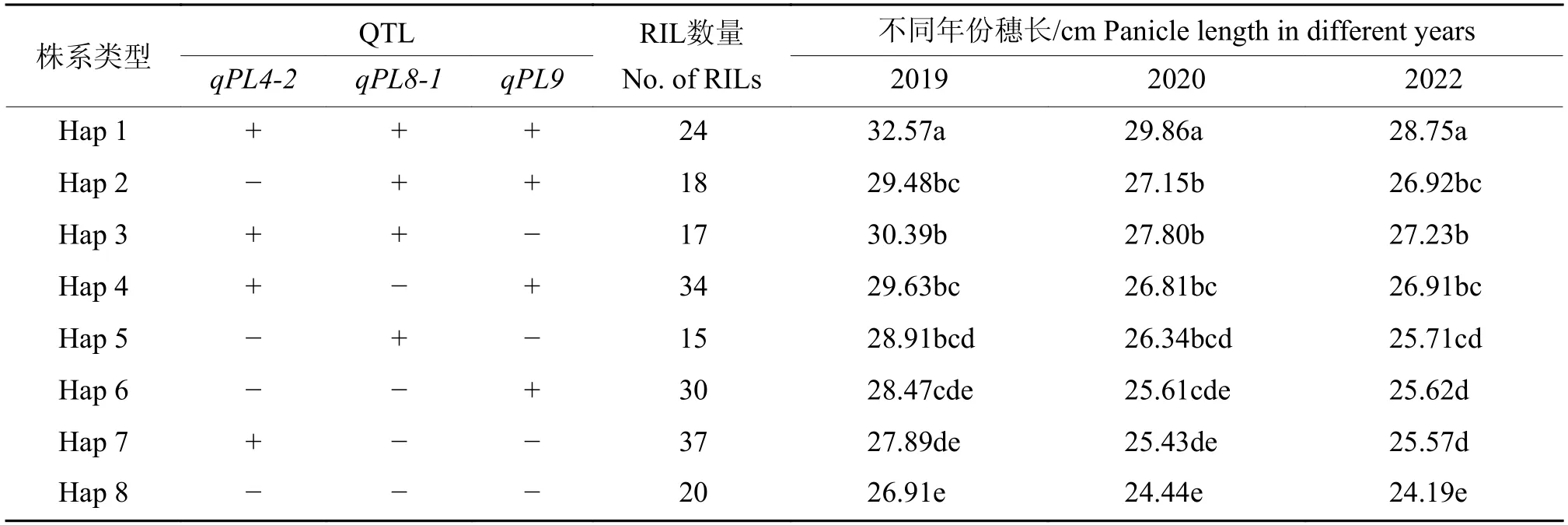
表3 穗长QTL的聚合效应分析1)Table 3 Pyramiding effect of the QTLs for panicle length
3 讨论与结论
水稻复杂性状QTL定位的效率主要取决于标记密度,增加标记密度是提高QTL定位分辨率的有效方法[19-20]。以往采用RFLP、SSR、InDel等传统分子标记构建的遗传图谱,精度约为1~10 Mb[21],受标记数量、覆盖密度的限制,定位区间较大且精确度不高。随着高通量测序技术的快速发展,近年来研究者基于高密度bin图谱成功定位了多个粒型、耐低氧萌发、叶绿素含量等水稻复杂性状QTL,大大提高了水稻数量性状遗传分析的效率[22-27]。水稻穗长主要为多基因控制,是受基因和环境的共同影响的复杂数量性状[28]。本研究使用了一个包含2 193个bin标记的高密度遗传图谱,定位到了11个穗长QTL位点,其中定位到的4个稳定的穗长QTL位点的物理区间平均只有约470 kb。与以往通过RFLP、SSR、InDel等传统分子标记构建的遗传图谱进行的水稻农艺性状QTL定位结果相比,这一距离已经显著缩小[29-30]。
产量长期以来都是水稻育种过程中的重要目标之一,并受到许多在不同生物过程中发挥作用的QTL/基因的控制,这些QTL/基因的鉴定将有助于在水稻育种中应用优良的等位基因。穗型相关性状是影响水稻产量的直接因素。一般而言,穗长过短,会导致一次枝梗多而紧密,二次枝梗发育受阻;穗长过长会使穗分枝稀疏分布,引起枝梗着粒密度降低,穗粒数减少,影响水稻产量。因此,适宜的穗长可以形成穗枝梗排列适中、着粒密度均匀、穗粒数合适的优良穗型,有利于水稻产量的提高[31]。然而,穗长的遗传因素及其对水稻产量的影响尚未得到很好的认识[32]。深入挖掘水稻重要穗长QTL可为水稻高产育种提供遗传资源和理论依据。本研究利用2个优良亲本‘R8605’和‘ZP37’及其RIL群体构建的高密度遗传图谱,对在3个不同环境下种植的穗长进行QTL分析,共检测到11个QTL,其中7个QTL是新的位点,目前还未见报道,其余4个QTL位点与已报道的穗长基因/QTL位置重叠或相近。如QTLqPL8-1,位于第8染色体25.11—26.01 Mb处,该区域克隆了一个与穗长相关的理想株型基因IPA1(OsSPL14、WFP)[11],其正调控水稻直立型密穗基因DEP1,调节水稻株高和穗长,同时还抑制水稻分蘖的发生;qPL4-2与徐华山等[33]以‘9311’为背景、导入‘日本晴’片段的代换系群体定位到穗长QTLpl4、以及魏少博等[34]以‘成恢727’和‘9311’为亲本构建的重组自交系群体定位到的穗长QTLqPL4-1位置重叠;qPL8-2与Zhang等[35]定位到的与RM23466及InDel8-7标记连锁的穗长QTLqPL8位置接近;qPL9与徐华山等[33]定位到的穗长QTLpl9位置接近。共定位的结果也在一定程度上证明了本研究结果的可靠性。
在育种实践中,穗长已被广泛调查,但在阐明潜在基因及其与产量构成因素的关系方面却没有引起太多关注。目前有一些已报道的穗部结构基因如NAL1,已应用于水稻育种[36-37]。通过利用同一作图群体在多种不同环境下进行QTL定位,检测到受环境影响小、能重复定位到的稳定QTL对聚合育种具有重要的意义[38]。本研究定位的QTL中,有4个是多个不同的环境下稳定表达的QTL,可以有效增加水稻穗长。这些都是重要的QTL,具有较高的研究价值,这些位点值得进一步进行精细定位和候选基因分析,以最终应用于标记辅助选择育种。
许多研究[39-41]表明,利用分子标记进行辅助聚合育种对性状的改良是很有效的,尤其是涉及数量性状或复杂性状的改良。本研究鉴定的4个遗传效应稳定的穗长相关位点,对其中3个位点的聚合效应的分析结果与我们预期一致,聚集多个有利等位基因可以有效改善表型性状,且增效等位位点的聚合主要表现为累加效应,证明这些位点可以运用于水稻聚合育种中,为提高水稻产量和理想植株的培育提供机会。

