SIRT2在结肠癌微环境CD4+T细胞向Th17细胞分化中的作用及对HIF-1α的影响①
蒋 斌 谢兴旺 (武汉市第三医院,武汉 430000)
结肠癌是常见的消化道肿瘤,隐蔽性强,预后差[1]。机体免疫是控制癌细胞增长的防线,Th17 细胞是近年来发现的CD4+T 淋巴细胞亚群,Th17 在维持肠道内免疫稳态中发挥关键作用,其分泌的IL-17、IL-22 等细胞因子是结直肠癌的促进因素[2-3]。张静[4]研究显示,老年结肠癌患者外周血中Th17 细胞比例显著高于同期健康者,WANG 等[5]发现人参果浓缩物可通过抑制Th17 细胞分化预防结肠癌。Th17 分泌的IL-17 可通过促进肿瘤血管生成、促肿瘤增殖、转移等途径促进肿瘤进展[6-7]。因此抑制CD4+T 细胞的Th17 分化可能是结肠癌的治疗途径之一。沉默信息调节因子2(silent information regulator 2,SIRT2)是SIRTs家族成员,属于去乙酰化酶,参与新陈代谢、基因表达沉默、DNA 损伤修复等多种过程,SIRTs 家族与肠道相关疾病(肠炎、结肠癌)关系密切,但SIRT2 在结肠癌中的研究较少,XU等[8]认为硫肉豆蔻可通过阻断Th17 分化和抑制SIRT2 诱导的代谢,改善结肠炎,且SIRT2 可能通过调控Th17 的分化发挥作用,SIRT2 能否在结肠癌中参与Th17 细胞分化仍未可知。缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)在 结 肠 癌 患者、结肠癌细胞系中均呈高表达,且生物信息学网站中预测SIRT2 与HIF-1α 存在靶向关系[9-10]。因此,本研究重点探讨SIRT2 在肿瘤微环境中CD4+T细胞向Th17 细胞分化中的作用以及对HIF-1α 的影响。
1 材料与方法
1.1 材料
1.1.1 小鼠、细胞及试剂 小鼠结肠癌细胞CT26(CBP61189)购自南京科佰生物科技有限公司;SIRT2 过表达病毒由吉凯基因构建;SuperScript ⅥVILOTMcDNA 合成试剂盒(11754250)、SYBR Green PCR Mastermix(1309155)购自ThermoFisher;Trizol(R0016)、CCK-8 试剂盒(C0038)、TUNEL 试剂盒(C1091)购自上海碧云天公司;SIRT2(ab211033)、HIF-1α(ab51608)、GAPDH(ab8245)、Ki67(ab9274 2)、CD4-PE(ab252151)、IL-17-FITC(ab279597)抗体、HRP 标记的山羊抗兔IgG 二抗(ab6721)均购自美国Abcam 公 司;IL-17(ml1037866)、IL-6(ml002293-J)试剂盒购自上海酶联公司;24 只C57BL/6 小鼠(雄性,6~8 周),许可证号:SCXK(湘)2019-0004,购自湖南斯莱克景达实验动物有限公司。
1.2 方法
1.2.1 细胞培养及SIRT2 过表达 将CT26 细胞株置于DMEM 完全培养基中培养,置于CO2培养箱中,及时更换培养液(24 h),融合至80%左右传代。取对数生长期CT26 细胞于6 孔板内,细胞量为1×105个/孔,待细胞贴壁后将完全培养基更换为无血清培养基,并加入转染试剂10 µg polybrene,加入SIRT2 过表达病毒(病毒∶细胞=80∶1),每8 h 更换1 次培养基,72 h 后添加1 µg/ml 嘌呤霉素筛选稳定SIRT2过表达细胞,即CT26/SIRT2细胞。
1.2.2 qRT-PCR检测SIRT2 mRNA和HIF-1α mRNA水平 用Trizol 提取细胞总RNA。测定RNA 浓度,用试剂盒将mRNA 逆转录为cDNA。然后以cDNA为模板用SYBR Green PCR Mastermix 进行实时定量PCR检测。反应条件为预热50 ℃ 2 min,94 ℃ 10 min,然后94 ℃ 30 s,60 ℃ 1 min,共40 个循环。引物序列NCBI 的Primer-Blast 软件设计,生物公司合成。采用2-ΔΔCt相对定量的方法对SIRT2 mRNA、HIF-1α mRNA进行定量。
1.2.3 Western blot 法检测SIRT2、HIF-1α 蛋白水平 用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA蛋白裂解液冰上提取细胞蛋白并用BCA 试剂盒测定蛋白浓度,将20 µg 细胞总蛋白上样进行12%聚丙烯酰胺凝胶电泳,然后将蛋白转印至PVDF 膜。PVDF 膜置于5%脱脂奶粉中封闭2 h,用特异性一抗SIRT2、HIF-1α(1∶1 000稀释)在4 ℃孵育过夜,膜经TBST缓冲液漂洗3次后,用HRP标记的二抗室温孵育1 h。膜经TBST缓冲液漂洗3次后,用超级ECL发光试剂盒显影并在成像系统上曝光,扫描结果经图像分析系统处理,测定各条带光密度值进行定量分析。
1.2.4 CCK-8检测细胞增殖抑制率 将对数生长期CT26、CT26/SIRT2细胞接种至96孔板(2×103个/孔),每 组 设 置6 个 复 孔,培 养48 h 后 每 孔 加 入10 µl CCK-8 溶液,37 ℃孵育2 h,利用酶标仪检测450 nm处吸光度(OD),以CT26细胞为对照,CT26/SIRT2细胞增殖抑制率(%)=ODCT26/SIRT2/ODCT26×100%。
1.2.5 结肠癌细胞移植瘤模型构建 取对数生长期CT26、CT26/SIRT2 细胞,调整细胞密度为1×107个/ml,注射10 µl于C57BL/6小鼠右后肢,每组各12 只,28 d 后处死,剥离小鼠肿瘤组织称重,并观测肿瘤体积,肿瘤体积=长径×短径2/2。
1.2.6 Ki67 染色观察肿瘤组织细胞增殖情况 每组选取6只小鼠肿瘤组织,一部分用4%多聚甲醛固定肿瘤组织制备石蜡切片,抗原修复后,血清封闭1 h,加入Ki67 抗体4 ℃反应过夜,PBS 洗涤3 次后,用生物素标记的羊抗兔二抗室温孵育1 h,PBS 洗涤3 次后加入链霉素卵白素工作液、DAB 染色液,苏木素复染、脱水、透明、封片。随机选取5个视野,观察Ki67细胞阳性表达。
1.2.7 TUNEL 染色观察肿瘤组织细胞凋亡情况取1.2.6 中石蜡切片,通过TUNEL 试剂盒进行凋亡检测,统计凋亡细胞数与总细胞数,凋亡指数(%)=(凋亡细胞数/总细胞数)×100%。
1.2.8 肿瘤组织匀浆上清液IL-17、IL-6 表达 将1.2.6 中另一部分肿瘤组织匀浆后离心,吸取上清液,试剂盒检测IL-17、IL-6水平。
1.2.9 肿瘤组织淋巴细胞获取 每组选取剩余6只小鼠肿瘤组织,修剪为1 mm×1 mm×1 mm组织块,以含1 mg/ml胶原酶Ⅳ的RPMI1640培养基消化30 min(37 ℃),消化完成后制备为单个细胞悬液。离心5 min(1 200 r/min),悬浮细胞,加入5 ml淋巴细胞分离液,1 000 r/min 离心20 min 并收集淋巴细胞层,PBS洗涤2次,保存。
1.2.10 流式细胞术检测淋巴细胞中Th17 细胞比例 向淋巴细胞悬液(100 µl,1×106个/ml)内加入PE标记的CD4抗体,4 ℃孵育40 min,PBS洗2遍,加入FITC 标记的IL-17 抗体至终浓度为1 µg/ml,冰上孵 育20 min,PBS 洗 涤2 次,以 预 冷 的1 mmol/L EDTA-PBS 溶液悬浮细胞,调整浓度至1×107个/ml。采用流式细胞分选仪分选出CD4+Th17 细胞,检测Th17 细胞在CD4+T 细胞中的比例。分选得到的Th17 细胞于含5 ml 预冷的RPMI 1640 培养基试管中保存,qRT-PCR 法与Western blot 法检测Th17 细胞SIRT2、HIF-1α mRNA 与蛋白的表达,方法分别参照1.2.2、1.2.3。
2 结果
2.1 CT26/SIRT2 转染细胞株的建立 倒置荧光显微镜下观察细胞呈绿色荧光,荧光表达率90%以上,与CT26 细 胞 相 比,CT26/SIRT2 细 胞SIRT2 mRNA 水平与蛋白水平升高,HIF-1α mRNA 与蛋白水平降低(P<0.05,图1、表1)。
表1 CT26、CT26/SIRT2 细 胞SIRT2、HIF-1α mRNA 与蛋白表达(±s,n=6)Tab.1 mRNA and protein expressions of SIRT2 and HIF-1α in CT26 and CT26/SIRT2 cells (±s,n=6)

表1 CT26、CT26/SIRT2 细 胞SIRT2、HIF-1α mRNA 与蛋白表达(±s,n=6)Tab.1 mRNA and protein expressions of SIRT2 and HIF-1α in CT26 and CT26/SIRT2 cells (±s,n=6)
Groups CT26 CT26/SIRT2 SIRT2 mRNA 1.02±0.12 2.54±0.31 11.201 0.000 tP Protein 0.83±0.10 1.72±0.22 9.021 0.000 HIF-1α mRNA 1.01±0.13 0.26±0.03 13.770 0.000 Protein 0.52±0.06 0.11±0.01 16.510 0.000

图1 CT26/SIRT2细胞转染情况Fig.1 CT26/SIRT2 cells transfection
2.2 CT26、CT26/SIRT2 细胞增殖抑制率情况CT26、CT26/SIRT2组细胞增殖抑制率差异无统计学意义(P>0.05,表2)。
表2 CT26、CT26/SIRT2细胞增殖抑制率(±s,n=6)Tab.2 Proliferation inhibition rate of CT26 and CT26/SIRT2 cells (±s,n=6)

表2 CT26、CT26/SIRT2细胞增殖抑制率(±s,n=6)Tab.2 Proliferation inhibition rate of CT26 and CT26/SIRT2 cells (±s,n=6)
Groups CT26 CT26/SIRT2 tP Proliferation inhibition rate/%100.00±0.00 98.75±12.34 0.248 0.809
2.3 小鼠瘤体体积与重量 与CT26 小鼠相比,CT26/SIRT2 小鼠剥离瘤体体积与重量均降低(P<0.05,图2、表3)。
表3 CT26、CT26/SIRT2小鼠瘤体体积与重量(±s,n=12)Tab.3 Tumor volume and weight of CT26 and CT26/SIRT2 mice (±s,n=12)

表3 CT26、CT26/SIRT2小鼠瘤体体积与重量(±s,n=12)Tab.3 Tumor volume and weight of CT26 and CT26/SIRT2 mice (±s,n=12)
Groups CT26 CT26/SIRT2 tP Volume/mm3 465.82±58.22 174.67±21.54 16.247 0.000 Weight/g 0.54±0.06 0.21±0.02 18.075 0.000
2.4 小鼠肿瘤组织细胞增殖、凋亡检测 与CT26小鼠相比,CT26/SIRT2小鼠肿瘤组织Ki67阳性表达降低,细胞凋亡率升高(P<0.05,图3、图4、表4)。
表4 CT26、CT26/SIRT2 小鼠肿瘤组织细胞凋亡率(±s,n=6)Tab.4 Apoptosis rate of tumor tissues in CT26 and CT26/SIRT2 mice (±s,n=6)

表4 CT26、CT26/SIRT2 小鼠肿瘤组织细胞凋亡率(±s,n=6)Tab.4 Apoptosis rate of tumor tissues in CT26 and CT26/SIRT2 mice (±s,n=6)
Groups CT26 CT26/SIRT2 tP Apoptosis rate/%13.24±1.62 25.64±3.17 8.532 0.000

图4 CT26、CT26/SIRT2 小鼠肿瘤组织细胞凋亡情况(×400)Fig.4 Apoptosis in tumor tissues of CT26 and CT26/SIRT2 mice (×400)
2.5 小鼠肿瘤组织淋巴细胞中Th17细胞比例 与CT26 小鼠相比,CT26/SIRT2 小鼠淋巴细胞中Th17细胞比例降低(P<0.05,图5、表5)。
表5 CT26、CT26/SIRT2 小鼠肿瘤组织淋巴细胞中Th17细胞比例(±s,n=6)Tab.5 Proportion of Th17 cells in tumor tissue lymphocytes of CT26 and CT26/SIRT2 mice (±s,n=6)
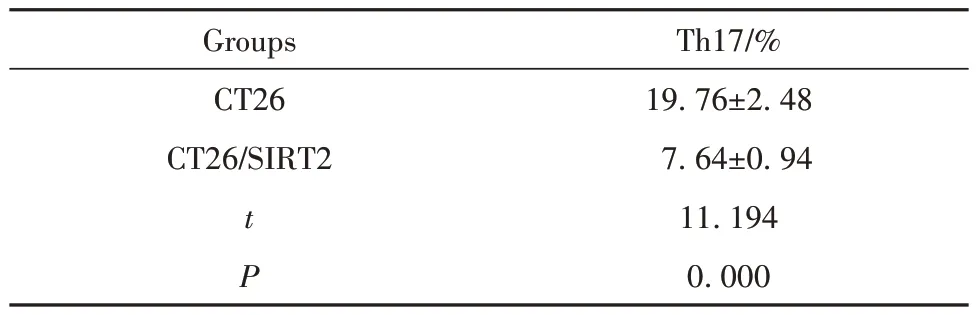
表5 CT26、CT26/SIRT2 小鼠肿瘤组织淋巴细胞中Th17细胞比例(±s,n=6)Tab.5 Proportion of Th17 cells in tumor tissue lymphocytes of CT26 and CT26/SIRT2 mice (±s,n=6)
Groups CT26 CT26/SIRT2 t P Th17/%19.76±2.48 7.64±0.94 11.194 0.000
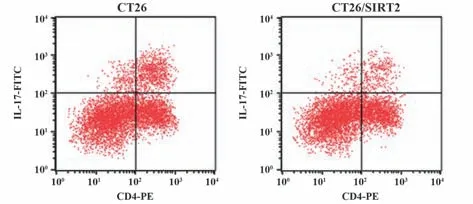
图5 CT26、CT26/SIRT2 小鼠肿瘤组织浸润淋巴细胞中Th17细胞比例Fig.5 Proportion of Th17 cells in tumor infiltrating lymphocytes of CT26 and CT26/SIRT2 mice
2.6 小鼠肿瘤组织匀浆上清液中IL-17、IL-6 水平 与CT26 小鼠比较,CT26/SIRT2 小鼠肿瘤组织匀浆上清液中IL-17、IL-6 水平均降低(P<0.05,表6)。2.7 小鼠肿瘤组织淋巴细胞中Th17 细胞SIRT2、HIF-1α mRNA 与蛋白表达情况 与CT26 小鼠相比,CT26/SIRT2小鼠肿瘤组织淋巴细胞中Th17细胞SIRT2 mRNA 和蛋白水平升高,HIF-1α mRNA 与蛋白水平降低(P<0.05,图6、表7)。
表6 CT26、CT26/SIRT2 小鼠肿瘤组织匀浆上清液中IL-17、IL-6水平(±s,n=6,ng/ml)Tab.6 Levels of IL-17 and IL-6 in tumor tissue homogenate supernatant of CT26 and CT26/SIRT2 mice(±s,n=6,ng/ml)

表6 CT26、CT26/SIRT2 小鼠肿瘤组织匀浆上清液中IL-17、IL-6水平(±s,n=6,ng/ml)Tab.6 Levels of IL-17 and IL-6 in tumor tissue homogenate supernatant of CT26 and CT26/SIRT2 mice(±s,n=6,ng/ml)
Groups CT26 CT26/SIRT2 t P IL-17 88.62±11.08 35.61±4.45 10.875 0.000 IL-6 137.62±17.21 51.08±6.38 11.549 0.000
表7 小鼠肿瘤组织淋巴细胞中Th17 细胞SIRT2、HIF-1α mRNA与蛋白表达情况(±s,n=6)Tab.7 Th17 cells SIRT2 and HIF-1α in lymphocytes of mouse tumor tissue mRNA and protein expressions (±s,n=6)

表7 小鼠肿瘤组织淋巴细胞中Th17 细胞SIRT2、HIF-1α mRNA与蛋白表达情况(±s,n=6)Tab.7 Th17 cells SIRT2 and HIF-1α in lymphocytes of mouse tumor tissue mRNA and protein expressions (±s,n=6)
Groups CT26 CT26/SIRT2 SIRT2 mRNA 1.01±0.13 2.54±0.32 10.850 0.000 t P Protein 0.66±0.08 1.59±0.19 11.050 0.000 HIF-1α mRNA 1.02±0.12 0.25±0.03 15.248 0.000 Protein 1.16±0.14 0.32±0.04 14.131 0.000
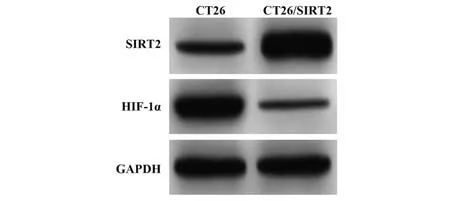
图6 Western blot 检测小鼠肿瘤组织淋巴细胞中Th17细胞SIRT2、HIF-1α蛋白Fig.6 SIRT2 and HIF-1α proteins of Th17 cells were detected by Western blot analysis
3 讨论
结肠癌是消化道恶性肿瘤之一,多与饮食习惯、遗传因素有关,前期症状不明显,不易引起重视,晚期扩展迅速、预后差,因此结肠癌重在防治。机体免疫系统在识别、杀伤癌细胞过程中发挥作用,正常情况下,机体免疫系统发挥对异常细胞清除作用,但当癌细胞数目过多或免疫能力受损时,癌细胞无须扩张,即可加重疾病进展。CD4+T 细胞是肿瘤免疫应答的关键,其可分化为Th1、Th2、Th17、Treg 等细胞,其中Th17 细胞在维持肠内免疫稳态、抵御细胞外病原体、肿瘤血管生成方面发挥作用,Th17 细胞异常分化、分泌IL-17、IL-22 等细胞因子是结肠癌发生的重要因素[6-7]。SPS等[11]研究显示,Ⅳ期结肠癌患者Th17相关细胞因子IL-17、IL-23、IL-25水平显著高于Ⅲ期结直肠癌患者;SUN 等[12]研究显示,结肠癌中肿瘤外泌体通过传递LncRNA crnde-h 促进Th17 细胞分化并加速癌症进程;转移性结直肠癌患者Th17细胞积聚,且贝伐单抗耐药性增强[13]。基于Th17 的过度分化在结肠癌中发挥的不良作用,降低Th17细胞分化是治疗结肠癌的可行方向之一。
SIRT2 是SIRTs 家族成员,主要定位于细胞质。SIRTs 家族参与多系统疾病发生发展,在肠道疾病中,参与肠道炎症、屏障修复等过程。LEE等[14]研究显示,姜黄素通过共价修饰SIRT1 的半胱氨酸67 残基抑制人结肠癌细胞的致癌性。SIRT2 在结肠癌中研究较少,其可调控黏连蛋白SMC1 磷酸化抑制结肠癌增殖[15]。本研究构建稳定SIRT2过表达的结肠癌CT26 细胞株,记为CT26/SIRT2,并经倒置显微镜、qRT-PCR 与Western blot 验证转染成功。CT26/SIRT2 细胞与CT26 细胞增殖抑制率相比并无显著性差异,说明慢病毒转染不影响CT26 的增殖能力,将CT26、CT26/SIRT2种植于小鼠皮下成瘤后,CT26/SIRT2 所形成的肿瘤体积及重量小于CT26 细胞所形成的,提示SIRT2 过表达可抑制瘤体的生长。CT26/SIRT2 小鼠分离瘤体淋巴细胞Th17 细胞比例以及所分泌的细胞因子水平均低于CT26 小鼠分离瘤体,提示肿瘤细胞SIRT2 过表达可能抑制Th17 分化,缓解炎症损伤,但其调控Th17 的分化机理仍需继续分析。检测可知淋巴细胞Th17 细胞SIRT2 水平升高,其升高原因可能为肿瘤细胞内SIRT2 激活增加IL-17、IL-6 分泌,进一步激活肿瘤微环境中的SIRT2,进而影响免疫,至于影响Th17 细胞分化的SIRT2 来自肿瘤细胞还是Th17 本身,尚需进一步探讨。
HIF-1α 经miR-448 过表达后下调,伴随着结肠癌细胞SW480 侵袭、迁移速度减缓[10];HIF-1α 下调可减缓结肠癌细胞生长代谢速度,降低结肠癌细胞侵袭性[16]。以上研究均显示HIF-1α 过表达在结肠癌中发挥不良作用。CHOU 等[17]研究显示HIF-1α经肿瘤抑制死亡相关蛋白激酶抑制后,降低Th17细胞的分化能力。此外,SIRT2 具有调控HIF-1α 的能力。HIF-1α 在调控Th17 分化中发挥重要作用,HIF-1α 可能被SIRT2调控参与Th17分化,最终影响结肠癌的免疫应答与炎症反应[18]。本研究中,CT26/SIRT2 细胞的HIF-1α 水平低于CT26 细胞,即SIRT2过表达可降低HIF-1α水平,CT26/SIRT2小鼠分离瘤淋巴细胞中Th17细胞HIF-1α水平也显著低于CT26小鼠。为此猜测SIRT2过表达可能通过调控HIF-1α参与对Th17 的调控,抑制瘤体增长,但SIRT2 是否通过降低HIF-1α表达发挥上述作用,仍需后续深入研究。
综上所述,SIRT2 可抑制结肠癌微环境CD4+T细胞向Th17 细胞分化,并下调HIF-1α 表达。但受限于资金、时间等,本研究尚未对SIRT2调控HIF-1α的作用机制进行深度探索,有待后续开展。

