HIF-1α/BNIP3 信号通路在IL-4 减轻小鼠脑缺血再灌注损伤中的作用及其与自噬的关系
雷爱弟 张健莉 周 衡 (厦门市第五医院神经内科,厦门 361101)
脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)指因大脑缺血后恢复血液灌注导致的组织及功能损伤进一步加重的现象,是多种脑血管疾病的病理生理基础[1]。CIRI 机制复杂,研究发现氧化应激、炎症反应、细胞凋亡、自噬等在其中具有重要作用[2]。其中自噬不仅可以通过清除受损或多余的细胞器修复神经元损伤,且可以通过影响细胞凋亡和坏死调控神经元死亡[3]。IL-4 是一种重要的抗炎因子,能够使抗炎因子如IL-10、TGF-β 等分泌增加,同时抑制炎症因子如IL-1、TNF-α 的释放,发挥抗炎作用。研究表明,IL-4 能够促进自噬产生,减轻小鼠CIRI,并改善远期认知功能,具有脑保护作用[4]。低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是细胞在低氧条件下的重要调节转录因子,在常氧条件下受到抑制。Bcl-2/腺病毒E1B-19kDa 相 互 作 用 蛋 白3(Bcl-2/adenovirus E1B 19-kDa interacting protein 3,BNIP3)是HIF-1α 的下游靶基因。自噬与缺氧关系密切,缺氧诱导的自噬对细胞主要起保护作用。研究表明,HIF-1α/BNIP3信号通路激活可引发自噬增加,减轻心肌CIRI 损伤[5]。而HIF-1α/BNIP3、IL-4、自噬三者之间的关系尚不明确。
本研究拟探讨HIF-1α/BNIP3 信号通路在IL-4减轻大鼠CIRI中的作用及其与自噬的关系,为进一步明确其机制提供参考。
1 材料与方法
1.1 材料
1.1.1 实 验 动 物 SPF 级2 月 龄BALB/c 小 鼠60 只,雌雄各半,体质量20~25 g,购自豪威生物科技有限公司[SYXK(津)2019-0006]。饲养环境为室温23~25 ℃、标准湿度55%~60%、12 h/12 h 昼夜交替、进食饮水正常、分笼饲养。于1 周后进行实验。本研究经厦门市第五医院伦理委员会批准(20180723)。
1.1.2 主要试剂与仪器 重组小鼠IL-4(美国PeproTech 公司);大鼠抗小鼠IL-4 中和抗体(美国Verax 公司);2ME2(美国Selleck 公司);HIF-1α、BNIP3、LC3-Ⅱ、Beclin-1 抗体(美国CST 公司);辣根过氧化物酶标记的二抗(北京博尔西科技有限公司);TTC 染色试剂盒(美国Sigma 公司);TUNEL 染色试剂盒(美国Roche 公司);BCA 蛋白浓度测定试剂盒(北京中杉金桥生物技术有限公司);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)检测试剂盒(南京建成生物工程有限公司)。Thermo 酶标仪[赛默飞世尔科技(中国)有限公司];冷冻离心机(美国Beckman公司);蛋白电泳仪(美国Bio-Rad公司);H7500透射电镜(日本Hitachi公司)。
1.2 方法
1.2.1 动物模型制作与分组 将60只小鼠按照随机数字表法分为5 组:假手术组、缺血再灌注组(CIRI 组)、IL-4 组、HIF-1α 抑制剂2ME2 组(2ME2组)和IL-4+HIF-1α抑制剂2ME2组(IL-4+2ME2组)。采用线栓法构建CIRI 组、IL-4 组、2ME2 组和IL-4+2ME2 组 大 脑 中 动 脉 栓 塞(middle cerebral artery embolism,MACO)模型,主要方法如下:腹腔内注射3%戊巴比妥钠麻醉小鼠,并将其仰卧固定于手术台上。剃毛和消毒后小心暴露左颈内动脉,将尼龙线插入其中,当远端稍遇阻力时停止插入并固定栓线,闭塞缺血60 min 后取出尼龙线,允许缺血区域再灌注 24 h,建立MACO 小鼠模型。术后肌内注射200 000 U 青霉素,连续3 d。假手术组除不阻断大鼠大脑中动脉外,其余操作同上。IL-4组、2ME2组、IL-4+2ME2 组建模前30 min 分别腹腔注射相应的0.2 ml IL-4C复合体溶液(IL-4C复合体溶液配制:将10 µg 重组小鼠IL-4 抗体和50 µg 重组大鼠抗小鼠IL-4抗体混合,用含1%小鼠血清的生理盐水稀释到50 µg/ml),尾静脉注射15 mg/kg 2ME2 溶液。再灌注24 h 时进行神经行为学评分,然后处死小鼠取脑组织。
1.2.2 各组小鼠神经行为学评分 参考Longa 神经功能缺损评分方法,在动物建模14 d 后进行评分,并记录神经功能缺失症状,评分标准如下:无神经损伤症状计0 分;左侧前肢不能完全伸展计1 分;行走时身体向左侧转圈计2 分;行走时身体向左侧倾倒计3分;瘫痪,不能站立计4分。
1.2.3 TTC染色检测脑梗死体积 采用3%戊巴比妥钠麻醉小鼠后断头取脑,将各组脑组织于-80 ℃冰箱冷冻5 min,制成2 mm 厚的冠状切片。将切片置于2%TTC 溶液中室温孵育30 min(正常组织染成红色,梗死组织染成白色),4%多聚甲醛溶液中固定过夜,用数码相机等距拍照并将图像导入电脑,用Image-pro plus 6.0软件计算大鼠脑梗死体积。
1.2.4 干湿重法测定大鼠脑组织含水量 取部分脑组织置于锡纸(重量为A)中称重为B,湿重=B-A;用锡纸包裹脑组织放入烤箱烘干后反复称量至恒重C,干重=C-A;计算公式:脑组织含水量(%)=(脑组织湿重-脑组织干重)/湿重×100%,即(B-C)/(BA)×100%。
1.2.5 TUNEL 染色检测细胞凋亡 取部分脑组织制作石蜡切片,常规脱蜡、梯度乙醇脱水后,加入3%H2O2室温孵育10 min 后用蛋白酶K 于37 ℃消化10 min,加入TUNEL 反应混合液37 ℃避光孵育1 h,分别进行梯度乙醇脱水、二甲苯浸泡。最后中性树胶封片,光学显微镜(×400)下随机选取5个视野,观察染色结果并拍照。
1.2.6 透射电镜下计数自噬小体 取部分脑组织剪成小块,迅速置于2.5%戊二醛中固定4 h,然后依次进行1%锇酸固定、梯度丙酮脱水、环氧树脂包埋。超薄切片机切片(50~70 µm)后,经醋酸铀、柠檬酸铅双重染色后,于透射电镜(×10 000)下随机选取5个视野,观察自噬小体情况。
1.2.7 比色法测定SOD、MDA 和ROS 水平 取部分脑组织用生理盐水冲洗,并制成组织含量为10%的匀浆液,离心取上清,按照SOD、MDA 和ROS试剂盒说明书检测SOD、MDA和ROS水平。
1.2.8 Western blot 检测HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1表达 取1份脑组织,加入细胞裂解液匀浆进行总蛋白提取,BCA 蛋白检测试剂盒测定各组蛋白浓度,蛋白定量变性后进行SDS-PAGE 电泳分离蛋白,电泳后迅速转至PVDF 膜,置于含5%脱脂牛奶TBST 溶液中室温封闭2 h,分别加入对应一抗HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1(1∶2 000) 4 ℃过夜。TBST 洗涤3 次后,加入二抗(1∶10 000)室温孵育2 h,最后避光加入DAB 显色剂显色,Bio-Rad 凝胶成像仪记录蛋白灰度并拍照,以GAPDH 作为对照,对各组蛋白进行相对定量分析。
1.3 统计学分析 数据分析应用SPSS22.0 软件,计量资料以±s表示,采用独立t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 各组小鼠神经行为学评分、脑梗死体积和脑含水量比较 与假手术组相比,CIRI 组小鼠神经行为学评分、脑梗死体积和脑含水量明显升高(P<0.05);与CIRI 组相比,IL-4 组神经行为学评分、脑梗死体积和脑含水量降低(P<0.05);与IL-4 组相比,2ME2组、IL-4+2ME2组小鼠神经行为学评分、脑梗死体积和脑含水量升高(P<0.05),见图1、表1。
表1 各组小鼠神经行为学评分、脑梗死体积和脑含水量比较(±s,n=5)Tab.1 Comparison of neurobehavioral scores, cerebral infarction volume and cerebral water content of mice in each group (±s,n=5)
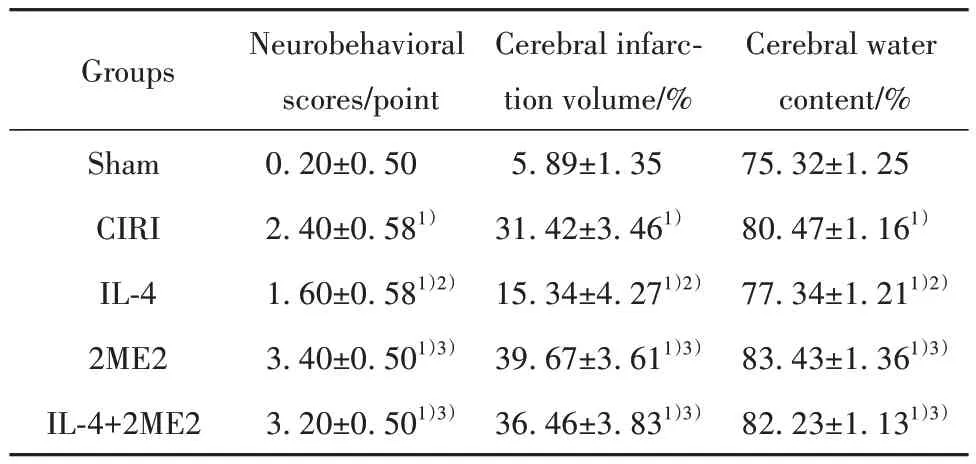
表1 各组小鼠神经行为学评分、脑梗死体积和脑含水量比较(±s,n=5)Tab.1 Comparison of neurobehavioral scores, cerebral infarction volume and cerebral water content of mice in each group (±s,n=5)
Note:Compared with sham group,1)P<0.05;compared with CIRI group, 2)P<0.05; compared with IL-4 group, 3)P<0.05.
Cerebral water content/%75.32±1.25 80.47±1.161)77.34±1.211)2)83.43±1.361)3)82.23±1.131)3)Groups Sham CIRI IL-4 2ME2 IL-4+2ME2 Neurobehavioral scores/point 0.20±0.50 2.40±0.581)1.60±0.581)2)3.40±0.501)3)3.20±0.501)3)Cerebral infarction volume/%5.89±1.35 31.42±3.461)15.34±4.271)2)39.67±3.611)3)36.46±3.831)3)
2.2 各组小鼠细胞凋亡、SOD、MDA 和ROS 水平比较 与假手术组相比,CIRI 组小鼠细胞凋亡、MDA和ROS 水平明显升高,SOD 水平明显降低(P<0.05);与CIRI 组相比,IL-4 组细胞凋亡、MDA 和ROS 水平降低,SOD 水平升高(P<0.05);与IL-4 组相 比,2ME2 组、IL-4+2ME2 组 细 胞 凋 亡、MDA 和ROS水平升高,SOD水平降低(P<0.05),见图2、表2。2.3 各组小鼠自噬小体形成情况比较 假手术组小鼠偶见单个自噬小体;CIRI 组细胞内有较多自噬小体;IL-4 组可见明显增多的双层磷脂双分子层包裹的自噬小体;2ME2 组、IL-4+2ME2 组细胞存在少量自噬小体,见图3。
表2 各组小鼠细胞凋亡、SOD、MDA和ROS水平比较(±s,n=5)Tab.2 Comparison of cell apoptosis, SOD, MDA and ROS levels of mice in each group (±s,n=5)

表2 各组小鼠细胞凋亡、SOD、MDA和ROS水平比较(±s,n=5)Tab.2 Comparison of cell apoptosis, SOD, MDA and ROS levels of mice in each group (±s,n=5)
Note:Compared with sham group, 1)P<0.05; compared with CIRI group, 2)P<0.05; compared with IL-4 group, 3)P<0.05.
ROS/(U·mg-1)34.65±8.96 93.47±13.871)58.36±11.471)2)118.14±13.461)3)111.29±10.131)3)Groups Sham CIRI IL-4 2ME2 IL-4+2ME2 Apoptosis/%4.24±1.53 23.34±3.461)13.42±3.581)2)32.36±3.521)3)30.19±3.921)3)SOD/(U·mg-1)269.35±15.11 124.14±10.461)215.39±17.371)2)101.76±12.311)3)106.24±10.181)3)MDA/(nmol·mg-1)5.32±0.95 12.37±1.161)7.14±0.911)2)15.83±1.261)3)14.32±1.611)3)

图2 各组小鼠细胞凋亡观察(TUNEL染色,×400)Fig.2 Observation of apoptosis of mice in each group(TUNEL staining, ×400)
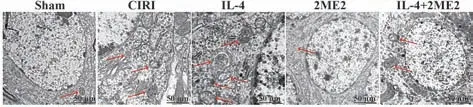
图3 各组小鼠自噬小体形成情况比较(透射电镜,×10 000)Fig.3 Comparison of formation of autophagosomes in each group of mice(Transmission electron microscope,×10 000)
2.4 各组小鼠HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1水平比较 与假手术组相比,CIRI 组小鼠HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1 水平明显升高(P<0.05);与CIRI组相比,IL-4组HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1 水 平 明 显 升 高(P<0.05);与IL-4 组 相 比,2ME2 组、IL-4+2ME2 组HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1水平明显降低(P<0.05),见图4、表3。
表3 各组小鼠HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1水平比较(±s,n=5)Tab.3 Comparison of levels of HIF-1α, BNIP3, LC3-Ⅱ and Beclin-1 of mice in each group (±s,n=5)

表3 各组小鼠HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1水平比较(±s,n=5)Tab.3 Comparison of levels of HIF-1α, BNIP3, LC3-Ⅱ and Beclin-1 of mice in each group (±s,n=5)
Note:Compared with sham group, 1)P<0.05; compared with CIRI group, 2)P<0.05; compared with IL-4 group, 3)P<0.05.
Beclin-1 0.11±0.04 0.46±0.111)0.98±0.161)2)0.28±0.061)3)0.20±0.061)3)Groups Sham CIRI IL-4 2ME2 IL-4+2ME2 HIF-1α 0.15±0.08 0.45±0.051)0.84±0.181)2)0.29±0.071)3)0.19±0.043)BNIP3 0.11±0.06 0.38±0.061)0.96±0.171)2)0.24±0.111)3)0.14±0.123)LC3-Ⅱ0.13±0.05 0.44±0.071)0.77±0.211)2)0.23±0.061)3)0.21±0.073)

图4 各组小鼠HIF-1α、BNIP3、LC3-Ⅱ和Beclin-1水平比较Fig.4 Comparison of levels of HIF-1α, BNIP3, LC3-Ⅱand Beclin-1 of mice in each group
3 讨论
在缺血性脑血管疾病中,缺血性脑卒中具有高发病率和高病死率特点,临床一般通过恢复缺血区的血流灌注进行治疗,但恢复血流灌注会使组织损伤及功能障碍更加严重,即为CIRI。近年研究发现,CIRI 与自噬调节密切相关,在体内、外模型中,再灌注期间抑制自噬均不利于神经细胞存活。如ZHANG 等[6]发现黄芪甲苷可降低MCAO 大鼠神经功能评分,减小脑梗死体积,降低氧-葡萄糖剥夺/再灌注损伤(OGD/R)后HT22 细胞凋亡率,增加LC3-Ⅱ/LC3-Ⅰ表达,通过促进自噬下调细胞凋亡发挥神经保护作用。SUN 等[7]发现缺血再灌注处理能够减少线粒体细胞色素C 释放,而自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)抑制了缺血再灌注处理的这种保护作用,表明缺血再灌注通过激活自噬加速了受损线粒体的清除,有利于神经元存活。IL-4是一种具有广泛生物学活性的细胞因子,对各种损伤、感染性及自身免疫性疾病均具有治疗作用。研究发现IL-4缺乏会导致神经过度兴奋,并加重IR 损伤,激活IL-4 信号有助于脑卒中后缺血性损伤的恢复[8]。LIU 等[9]发现IL-4 通过激活自噬减轻小鼠CIRI,并改善远期认知功能。LI 等[10]发现IL-4 能够显著减轻IR 小鼠神经功能缺损、脑梗死体积、氧化应激、细胞凋亡,通过激活自噬发挥脑保护作用。本研究通过构建小鼠MCAO 模型,发现CIRI 组小鼠神经行为学评分、脑梗死体积、脑含水量、细胞凋亡、氧化应激及自噬水平升高;IL-4 处理后,IL-4 组神经行为学评分、脑梗死体积、脑含水量、细胞凋亡、氧化应激水平降低,自噬水平升高,说明IL-4 能够减轻CIRI。
脑组织缺血、缺氧造成脑内能量代谢障碍,引起大量ROS、兴奋性氨基酸的堆积和释放,从而导致自噬潮发生。Beclin-1、LC3 蛋白与自噬的发生关系密切。Beclin-1 基因是酵母ATG6 的同系物,可诱导其他自噬相关蛋白定位于自噬泡,是自噬体形成过程中的重要分子。LC3 是自噬体膜蛋白,参与自噬形成的各个阶段,可作为检测自噬活性的标志物,当发生自噬后,LC3-Ⅰ经泛素化修饰形成LC3-Ⅱ,从而启动自噬。HE 等[11]发现在大鼠脑缺血再灌注阶段,白藜芦醇能够提高LC3-Ⅱ/LC3-Ⅰ值、降低p62 及炎症小体NLRP3 表达,通过增强自噬活性减轻CIRI 所致的炎症损伤,并且3-MA 预处理时增强了NLRP3 表达。SUN 等[12]发现MCAO 诱导了细胞自噬,丁香酚给药后进一步促进了自噬产生,从而防止体外OGD/R 及CIRI。ZHANG 等[13]发现氯通道-3(ClC-3)诱导能够提高Beclin-1 表达,激活自噬,对CIRI 具有保护作用,敲低ClC-3 通过抑制体内自噬,显著加重脑IR 损伤,本研究中与CIRI 组相比,IL-4组小鼠LC3-Ⅱ和Beclin-1 水平升高,自噬小体数量增多,说明IL-4通过激活自噬发挥脑保护作用。
HIF-1α 是缺氧细胞反应的关键因子,参与调节线粒体自噬,使得ROS 和促凋亡因子释放减少,防止细胞进一步损伤,增加细胞存活。HIF-1α 是BNIP3 的上游基因,活化的HIF-1α 通过上调BNIP3增强线粒体自噬,从而产生细胞保护作用。研究表明HIF-1α/BNIP3 信号通路通过增强自噬,保护心肌缺血再灌注损伤(MIRI)。如LIU等[14]发现在大鼠心肌损伤模型中,三七总皂苷通过激活HIF-1α/BNIP3信号通路增强线粒体自噬,对MIRI具有显著保护作用。YANG 等[15]发现去铁胺联合七氟醚可通过恢复和促进HIF-1/BNIP3 介导的线粒体自噬减轻糖尿病大鼠MIRI。ZHU 等[16]发现小檗碱通过诱导心肌细胞增殖、抑制心肌细胞凋亡及诱导线粒体自噬介导HIF-1α/BNIP3 通路防止MIRI 损伤。本研究中,与CIRI 组相比,IL-4 组小鼠HIF-1α、BNIP3 水平升高;HIF-1α/BNIP3 信号通路抑制剂2ME2 处理后,2ME2组、IL-4+2ME2组HIF-1α、BNIP3水平降低,说明IL-4通过激活HIF-1α/BNIP3 信号通路发挥脑保护作用。见图5。

图5 IL-4减轻小鼠CIRI的作用机制Fig.5 Mechanism of IL-4 attenuating CIRI in mice
综上所述,IL-4 可通过激活HIF-1α/BNIP3 信号通路,增强细胞自噬,减少细胞凋亡和氧化应激,从而减轻小鼠CIRI。

