MK2基因在高血压小鼠左心室重塑中的作用及机制研究①
孙丽爽 冯艳红 (锦州医科大学附属第三医院超声科,锦州 121000)
心脏是高血压损伤的主要靶器官之一,左心室重塑是高血压造成心脏损伤的重要特征,表现为心肌细胞肥大、胶原异常堆积等,最终造成心力衰竭[1-2]。左心室重塑的分子机制复杂且未完全阐明,目前尚缺乏能够在高血压发病过程中逆转左心室重塑的治疗手段。丝裂原活化蛋白激酶(mitogen activated-protein kinase,MAPK)家族中的p38MAPK在心血管系统中发挥重要生物学作用,在缺血缺氧、病毒感染、负荷增加等病理因素刺激下,p38MAPK 的激活通过调控炎症反应、氧化应激、细胞凋亡等引起心肌细胞损伤或肥大、刺激胶原增生及堆积[3-5]。丝裂原活化蛋白激酶激活的蛋白激酶2(mitogen-activated protein kinase activated protein kinase 2,MK2)是p38MAPK 下游的关键信号分子,抑制MK2 能够阻断p38MAPK 通路激活,在心肌肌球蛋白结合蛋白C过表达诱导心肌纤维化的模型小鼠中,抑制MK2 显著改善了心肌纤维化过程中胶原的堆积,提示MK2 可能在心肌纤维化及胶原异常堆积中起关键作用[6]。为阐明MK2基因在高血压引起的左心室重塑中的作用,本文以MK2 野生型小鼠及MK2 基因敲除小鼠为研究对象,通过腹主动脉缩窄术(constriction of abdominal aorta,AAC)建立高血压模型,具体观察MK2 基因在高血压小鼠左心室重塑中的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 野生型C57BL/6J 小鼠、MK2 基因敲除C57BL/6J 小鼠购自上海南方模式生物科技公司。
1.1.2 主要试剂与仪器 MK2、核因子-κB(nuclear factor-κB,NF-κB)、裂解型含半胱氨酸的天冬氨酸蛋白水解酶-3(Cleaved caspase-3)一抗(Abcam 公司);HE 染色试剂盒、Masson 染色试剂盒、活性氧簇(reactive oxygen species,ROS)检测试剂盒(上海碧云天公司);TNF-α、IL-6 检测试剂盒(上海西唐公司);脑型脑钠肽(brain natriuretic peptide,BNP)、血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)、醛固酮(aldosterone,ALD)、总抗氧化力(total antioxidant capacity,T-AOC)检测试剂盒(南京建成研究所);RNA 分离试剂盒、cDNA 第一链合成试剂盒、荧光定量检测试剂盒(北京天根公司)。S-Sharp Prospect 型小动物超声仪(SSharp 公司);正置显微镜(Nikon 公司);荧光定量PCR 仪(ABI公司);凝胶电泳仪及成像仪(上海天能公司)。
1.2 方法
1.2.1 动物分组及造模 野生型小鼠随机分为MK2+/+组、MK2+/+AAC 组,MK2 基因敲除小鼠随机分为MK2-/-组、MK2-/-AAC 组,每 组10 只 小 鼠。MK2+/+AAC 组和MK2-/-AAC 组进行AAC 处理,方法如下:腹腔注射戊巴比妥钠麻醉后,做0.5 cm 的腹正中切口,分离腹主动脉,在右肾动脉分支上0.5 cm处平行放置7 号针头(直径0.7 mm),用4 号手术线将腹主动脉与7号针头一并结扎,而后抽去针头,完成腹主动脉缩窄,逐层缝合切口,术后连续3 d 肌肉注射青霉素抗感染。MK2+/+组和MK2-/-组进行假手术操作,包括做0.5 cm 的腹正中切口,分离腹主动脉并进行挂线,但不结扎。
1.2.2 收缩压(systolic blood pressure,SBP)检测造模前及造模后7 d、14 d、21 d、28 d时,分别采用无创鼠尾血压监测系统检测SBP。
1.2.3 心功能的超声检测 造模后28 d 进行心功能超声检测,采用小动物彩色多普勒超声仪进行检测,探头频率为40 MHz,取乳头肌切面,获得超声心动图后测定舒张末期左室前壁厚度(left ventricular anterior wall thickness at end-diastole,LVAWd)、收缩末 期 左 室 前 壁 厚 度(left ventricular anterior wall thickness at end-systole,LVAWs)、舒张末期左室后壁厚度(left ventricular posterior wall thickness at enddiastole,LVPWd)、收缩末期左室后壁厚度(left ventricular posterior wall thickness at end-systole,LVPWs)。
1.2.4 心肌厚度及心脏/体质量(HW/BW)的测定 完成心功能的超声检测后称量体重,处死小鼠并解剖心脏。生理盐水冲洗各心腔内残留血液,并用滤纸吸干水分,称量心脏重量并计算HW/BW;沿冠状面在心房和心室的最大面剖开心脏,游标卡尺测量心尖位心肌组织厚度。
1.2.5 心肌HE 染色及Masson 染色 剪取适量左心室心肌组织,4%多聚甲醛固定后制作石蜡切片,分别采用HE 染色试剂盒和Masson 染色试剂盒进行染色,显微镜下观察染色情况。Masson 染色下胶原呈蓝色,计算视野内心肌胶原面积及心肌总面积,计算心肌胶原容积分数(collagen volume fraction,CVF)。CVF=心肌胶原面积/所测视野心肌总面积。
1.2.6 血清心室重塑标志物的检测 处死小鼠前经心尖取血约0.5 ml,静置后自然凝血,3 000 r/min离心10 min 分离血清,试剂盒检测BNP、AngⅡ、ALD含量。
1.2.7 心肌中MK2、NF-κB、Cleaved caspase-3 的Western blot 检测 剪取适量左心室心肌组织,加入裂解液并匀浆,BCA 法检测匀浆液的蛋白浓度,将含有20 µg 蛋白的匀浆液加入聚丙烯酰胺凝胶内,电泳分离不同分子量的蛋白后电转移至硝酸纤维素膜。5%脱脂牛奶室温封闭硝酸纤维素膜1 h,用MK2(1∶1 000)、NF-κB(1∶1 000)、Cleaved caspase-3(1∶1 000)、β-actin(1∶5 000)一抗4 ℃孵育过夜。次日,用辣根过氧化物酶标记的二抗(1∶2 000)室温孵育1 h,最后在凝胶成像系统内显影得到蛋白条带,并以β-actin 为内参,对MK2、NF-κB、Cleaved caspase-3的蛋白表达水平进行定量分析。
1.2.8 心肌中心室重塑标志物mRNA 表达水平的PCR 检测 剪取适量左心室心肌组织,采用RNA 分离试剂盒提取组织中的RNA,采用cDNA 第一链合成试剂盒将RNA 反转录为cDNA,采用荧光定量检测试剂盒配制PCR 反应体系:cDNA 1 µl、试剂盒内反应混合液10 µl、正反向引物溶液各0.6 µl,去离子水补足至20 µl。在荧光定量PCR 仪上进行PCR反应,得到反应的循环曲线及循环阈值(Ct),以β-actin 为内参,按照2-ΔΔCt法计算Ⅰ型胶原(Col-Ⅰ)、Col-Ⅲ、α-平滑肌肌动蛋白(α-SMA)的mRNA 表达水平。
1.2.9 心肌中炎症及氧化应激指标的检测 剪取适量左心室心肌组织,加入裂解液并匀浆,匀浆液以4 ℃、12 000 r/min 离心10 min,分离上清后采用BCA 法检测蛋白浓度,试剂盒检测TNF-α、IL-6、ROS、T-AOC 浓度,计算每毫克蛋白中TNF-α、IL-6、ROS、T-AOC含量。
1.3 统计学方法 采用SPSS21.0 软件录入数据,实验数据均为计量资料,以xˉ±s表示,四组间比较采用单因素方差分析、两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 四组小鼠心肌中MK2 表达水平比较 与MK2+/+组比较,MK2+/+AAC 组小鼠心肌中MK2 表达明显增加(P<0.05)。MK2-/-组、MK2-/-AAC 组小鼠心肌中不表达MK2。见图1。

图1 四组小鼠心肌中MK2表达水平比较Fig.1 Comparison of MK2 expression level in myocardium among four groups of mice
2.2 四组小鼠SBP水平比较 造模前,四组小鼠的SBP水平差异无统计学意义(P>0.05)。造模后7 d、14 d、21 d、28 d,与MK2+/+组比较,MK2+/+AAC 组小鼠SBP 水平明显升高(P<0.05),MK2-/-组小鼠SBP 水平差异无统计学意义(P>0.05);与MK2+/+AAC 组比较,MK2-/-AAC 组小鼠SBP 水平差异无统计学意义(P>0.05)。见图2。
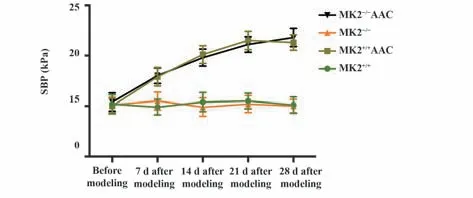
图2 四组小鼠SBP水平比较Fig.2 Comparison of SBP level in among four groups of mice
2.3 四组小鼠心脏超声指标比较 与MK2+/+组比较,MK2+/+AAC 组 小 鼠LVAWd、LVAWs、LVPWd、LVPWs 水 平 明 显 升 高(P<0.05),MK2-/-组 小 鼠LVAWd、LVAWs、LVPWd、LVPWs 水平差异无统计学意义(P>0.05);与MK2+/+AAC 组比较,MK2-/-AAC组小鼠LVAWd、LVAWs、LVPWd、LVPWs 水平明显降低(P<0.05)。见表1。
表1 四组小鼠心脏超声指标比较(±s,n=10)Tab.1 Comparison of cardiac ultrasound indexes among four groups of mice (±s,n=10)
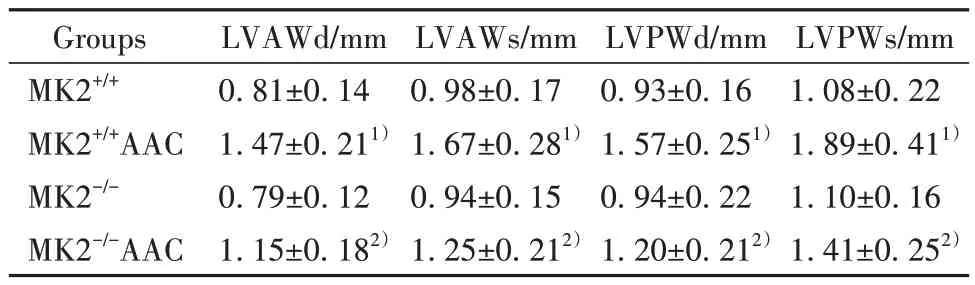
表1 四组小鼠心脏超声指标比较(±s,n=10)Tab.1 Comparison of cardiac ultrasound indexes among four groups of mice (±s,n=10)
Note:Compared with MK2+/+ group,1)P<0.05;compared with MK2+/+AAC group, 2)P<0.05.
LVPWs/mm 1.08±0.22 1.89±0.411)1.10±0.16 1.41±0.252)Groups MK2+/+MK2+/+AAC MK2-/-MK2-/-AAC LVAWd/mm 0.81±0.14 1.47±0.211)0.79±0.12 1.15±0.182)LVAWs/mm 0.98±0.17 1.67±0.281)0.94±0.15 1.25±0.212)LVPWd/mm 0.93±0.16 1.57±0.251)0.94±0.22 1.20±0.212)
2.4 四组小鼠心肌厚度及HW/BW 比较 与MK2+/+组比较,MK2+/+AAC组小鼠心肌厚度及HW/BW 均明显升高(P<0.05),MK2-/-组小鼠心肌厚度及HW/BW差异无统计学意义(P>0.05);与MK2+/+AAC 组比较,MK2-/-AAC组小鼠心肌厚度及HW/BW 均明显降低(P<0.05)。见表2。
表2 四组小鼠心肌厚度及HW/BW 水平比较(±s,n=10)Tab.2 Comparison of myocardial thickness and HW/BW level of mice among four groups (±s,n=10)

表2 四组小鼠心肌厚度及HW/BW 水平比较(±s,n=10)Tab.2 Comparison of myocardial thickness and HW/BW level of mice among four groups (±s,n=10)
Note:Compared with MK2+/+ group, 1)P<0.05; compared with MK2+/+AAC group, 2)P<0.05.
HW/BW/(mg·g-1)11.38±1.17 13.77±2.241)11.50±1.31 12.04±1.752)Groups MK2+/+MK2+/+AAC MK2-/-MK2-/-AAC Myocardial thickness/mm 1.04±0.29 1.94±0.341)1.08±0.31 1.37±0.302)
2.5 四组小鼠心脏HE 染色、Masson 染色比较MK2+/+组及MK2-/-组心肌细胞排列规则、大小正常,未见明显胶原堆积;MK2+/+AAC 组心肌细胞体积增大、排列混乱,可见大量胶原呈蓝色,CVF 水平明显高 于MK2+/+组(P<0.05);与MK2+/+AAC 组 比 较,MK2-/-AAC 组心肌细胞体积缩小、排列较规则,胶原堆积减少且CVF 水平明显降低(P<0.05)。见图3、图4。

图3 四组小鼠心脏HE染色比较Fig.3 Comparison of hearts HE staining among four groups of mice

图4 四组小鼠心脏Masson染色及CVF比较Fig.4 Comparison of Masson staining and CVF of hearts among four groups of mice
2.6 四组小鼠血清中心室重塑标志物比较 与MK2+/+组比较,MK2+/+AAC 组小鼠血清BNP、AngⅡ、ALD 水平均明显升高(P<0.05),MK2-/-组小鼠血清BNP、AngⅡ、ALD水平差异无统计学意义(P>0.05);与MK2+/+AAC 组比较,MK2-/-AAC 组小鼠血清BNP、AngⅡ、ALD水平均明显降低(P<0.05)。见表3。
表3 四组小鼠血清BNP、AngⅡ、ALD水平比较(±s,n=10,pg/ml)Tab.3 Comparison of serum BNP, AngⅡ and ALD levels among four groups of mice (±s,n=10,pg/ml)

表3 四组小鼠血清BNP、AngⅡ、ALD水平比较(±s,n=10,pg/ml)Tab.3 Comparison of serum BNP, AngⅡ and ALD levels among four groups of mice (±s,n=10,pg/ml)
Note:Compared with MK2+/+ group, 1)P<0.05; compared with MK2+/+AAC group, 2)P<0.05.
ALD 257.61±34.58 328.67±53.451)260.15±36.51 291.22±46.582)Groups MK2+/+MK2+/+AAC MK2-/-MK2-/-AAC BNP 64.12±9.93 277.64±55.691)59.69±8.58 136.36±21.242)AngⅡ209.58±35.83 653.12±75.591)215.42±41.75 401.85±55.472)
2.7 四组小鼠心脏中心室重塑标志物mRNA 表达水平比较 与MK2+/+组比较,MK2+/+AAC 组小鼠心肌中Col-Ⅰ、Col-Ⅲ、α-SMA mRNA 表达水平均明显升高(P<0.05),MK2-/-组小鼠心肌中Col-Ⅰ、Col-Ⅲ、α-SMA mRNA 表达水平差异无统计学意义(P>0.05);与MK2+/+AAC 组比较,MK2-/-AAC 组小鼠心肌中Col-Ⅰ、Col-Ⅲ、α-SMA mRNA 表达水平均明显降低(P<0.05)。见表4。
表4 四组小鼠心脏中Col-Ⅰ、Col-Ⅲ、α-SMA mRNA 表达水平比较(±s,n=10)Tab.4 Comparison of Col-Ⅰ, Col-Ⅲ, α-SMA mRNA expression levels in heart among four groups of mice (±s,n=10)
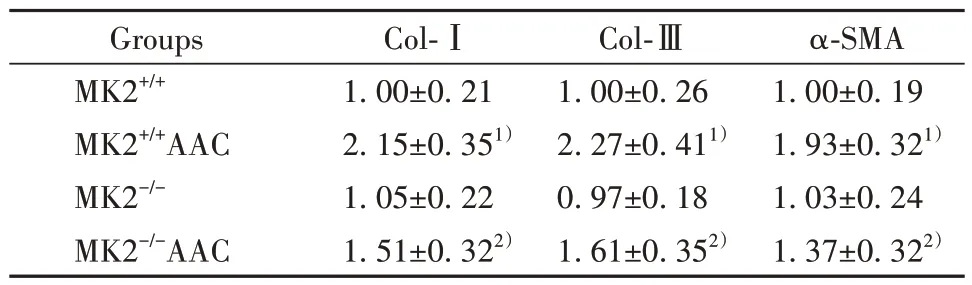
表4 四组小鼠心脏中Col-Ⅰ、Col-Ⅲ、α-SMA mRNA 表达水平比较(±s,n=10)Tab.4 Comparison of Col-Ⅰ, Col-Ⅲ, α-SMA mRNA expression levels in heart among four groups of mice (±s,n=10)
Note:Compared with MK2+/+ group, 1)P<0.05; compared with MK2+/+AAC group, 2)P<0.05.
α-SMA 1.00±0.19 1.93±0.321)1.03±0.24 1.37±0.322)Groups MK2+/+MK2+/+AAC MK2-/-MK2-/-AAC Col-Ⅰ1.00±0.21 2.15±0.351)1.05±0.22 1.51±0.322)Col-Ⅲ1.00±0.26 2.27±0.411)0.97±0.18 1.61±0.352)
2.8 四组小鼠心脏中MK2 下游炎症、氧化应激及凋亡标志物比较 如图5、表5 所示,与MK2+/+组比较,MK2+/+AAC 组小鼠心肌中NF-κB、Cleaved cas-pase-3 表达水平及TNF-α、IL-6、ROS 含量均明显增加,T-AOC 含量明显降低(P<0.05),MK2-/-组小鼠心肌中NF-κB、Cleaved caspase-3 表达水平及TNF-α、IL-6、ROS、T-AOC 含量差异均无统计学意义(P>0.05);与MK2+/+AAC组比较,MK2-/-AAC组小鼠心肌中NF-κB、Cleaved caspase-3 表 达 水 平 及TNF-α、IL-6、ROS 含量均明显降低,T-AOC 含量明显增加(P<0.05)。
表5 四组小鼠心脏中TNF-α、IL-6、ROS、T-AOC 含量比较(±s,n=10)Tab.5 Comparison of TNF-α,IL-6,ROS,T-AOC contents in heart among four groups of mice (±s,n=10)

表5 四组小鼠心脏中TNF-α、IL-6、ROS、T-AOC 含量比较(±s,n=10)Tab.5 Comparison of TNF-α,IL-6,ROS,T-AOC contents in heart among four groups of mice (±s,n=10)
Note:Compared with MK2+/+ group, 1)P<0.05; compared with MK2+/+AAC group, 2)P<0.05.
T-AOC/(U·mg-1)24.59±6.52 15.31±2.771)25.11±7.09 20.44±4.262)Groups MK2+/+MK2+/+AAC MK2-/-MK2-/-AAC TNF-α/(ng·mg-1)1.51±0.25 4.09±0.721)1.44±0.27 2.62±0.462)IL-6/(pg·mg-1)93.41±14.29 207.68±42.141)96.15±15.14 146.55±29.392)ROS/(U·mg-1)0.84±0.15 2.72±0.521)0.89±0.17 1.51±0.342)
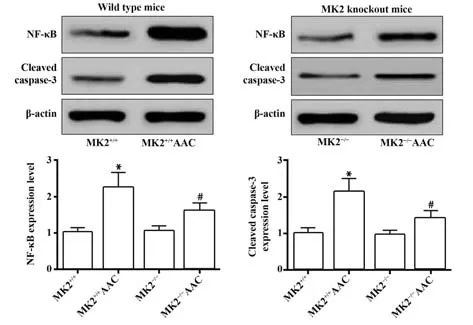
图5 四组小鼠心脏中NF-κB、Cleaved caspase-3 表达水平比较Fig.5 Comparison of NF-κB, Cleaved caspase-3 expression levels in heart among four groups of mice
3 讨论
高血压引起的心力衰竭及心脏猝死严重危害生命安全,长期血压升高引起的左心室重塑是造成高血压患者心力衰竭的核心环节,左心室重塑的组织学特征包括心肌细胞肥大、胶原异常堆积,目前在左心室重塑过程中发挥关键调控作用的分子尚不清楚。有研究报道,TGF-β1 刺激p38MAPK 通路激活在胶原异常堆积中发挥关键作用,p38MAPK 通路也成为近年研究心力衰竭及左心室重塑发病机制的重要靶点[3,7-8]。MK2 是p38MAPK 下游的重要底物之一,MK2 识别并结合p38MPAK 后形成复合物,复合物转位进入细胞质并参与下游信号级联放大调控[9-10]。由此可见,MK2 是p38MAPK 发挥生物学作用的关键靶点。也有研究在心肌肌球蛋白结合蛋白C过表达诱导心肌纤维化的模型小鼠中证实MK2 高表达与心肌纤维化及胶原异常堆积有关[6]。因此本研究以MK2 为切入点,研究高血压诱发左心室重塑的分子机制,旨在为深入认识高血压发病过程中左心室重塑的发病机制及防治的分子靶点提供实验依据。
AAC 是研究高血压及左心室重塑常用的造模方法[11-13]。本研究通过AAC诱导野生型小鼠发生高血压及左心室重塑,经对血压、心功能及心肌厚度、心脏重量的测定可知:SBP、LVAWd、LVAWs、LVPWd、LVPWs、心肌厚度、HW/BW 等多项指标水平均明显升高,表明AAC 后小鼠出现血压升高、心室肥厚表现,符合高血压及左心室重塑特征,也与既往关于AAC 造模后动物表型研究的结果一致[11-13]。AAC 造模后,左心室心肌组织中MK2表达水平明显升高,与MENG 等[6]报道的心肌纤维化模型小鼠心肌中MK2表达增加的结果一致,提示MK2高表达可能与高血压引起的左心室肥厚有关。进一步通过敲除MK2的方式进行验证,与接受AAC的野生型小鼠比较,接受AAC的MK2敲除小鼠SBP水平仍显著升高,但LVAWd、LVAWs、LVPWd、LVPWs、心肌厚度、HW/BW 几项指标的水平均明显降低,表明MK2不直接参与血压水平的调控,但参与血压升高后左心室肥厚的调控。
在高血压发病过程中,左心室肥厚是压力负荷增高引起心肌细胞肥大、胶原异常堆积等左心室重塑组织学特征的大体表现,为获得MK2 参与高血压引起左心室重塑的直接证据,本研究进行了组织染色及左心室重塑标志物检测。HE 染色和Masson 染色结果表明,野生型小鼠AAC 造模后出现心肌细胞肥大、胶原面积增加表现;敲除MK2 后进行AAC 造模,心肌细胞肥大、胶原面积增加均得到改善。在左心室发生重塑的过程中,相应标志物会发生改变,BNP、AngⅡ、ALD 是广泛使用的血清标志物,反映左心室重塑的程度[14];Col-Ⅰ、Col-Ⅲ、α-SMA是广泛使用的标志基因,前两者直接对胶原堆积进行量化,后者反映分泌胶原的成纤维细胞数目[15]。上述标志物的检测结果与组织染色结果吻合,即在野生型小鼠进行AAC 造模后,几项标志物的含量或表达量均明显增加,敲除MK2可使AAC造模后几项标志物的含量或表达量均明显降低。以上组织染色、标志物检测结果首先证实AAC 造模后高血压小鼠出现了左心室重塑,而后通过MK2敲除实验证实MK2参与高血压小鼠左心室重塑过程。
MK2是p38MAPK下游的重要底物,在p38MAPK通路促进炎症反应、氧化应激及细胞凋亡中均有关键作用[16-17]。在心力衰竭造成左心室重塑过程中,NF-κB 介导促炎因子TNF-α、IL-6 的释放显著激活炎症反应,进而刺激心肌细胞肥大、成纤维细胞增殖,并分泌大量胶原[18-19]。在糖尿病心肌病、心肌梗死等造成左心室重塑的过程中,氧化应激和细胞凋亡的激活一方面直接促进成纤维细胞增殖并分泌大量胶原,另一方面引起心肌细胞损伤,进而启动胶原修复,两方面均会造成胶原异常堆积;ROS 具有强氧化性,直接介导氧化应激,同时造成抗氧化物消耗及T-AOC 降低,Cleaved caspase-3 是凋亡标志基因,直接执行凋亡过程[20-21]。为进一步验证MK2 在高血压小鼠左心室重塑中的作用,本研究对MK2 下游的生物学效应进行检测,结果显示:野生型小鼠AAC 造模后,炎症反应、氧化应激反应及细胞凋亡均明显激活,敲除MK2使AAC造模后的炎症反应、氧化应激反应及细胞凋亡的激活程度受到抑制,与AAC造模及MK2敲除后左心室重塑的变化一致。由此进一步明确MK2 参与高血压小鼠左心室重塑的过程。
本研究结果表明,AAC 建立的高血压小鼠模型发生左心室重塑,且MK2 表达增加;敲除MK2 后进行AAC 造模,小鼠仍出现高血压,但左心室重塑明显改善,且炎症反应、氧化应激及细胞凋亡均明显减轻。基于此总结如下:MK2 基因高表达与高血压小鼠左心室重塑有关,激活MK2 下游炎症反应、氧化应激、细胞凋亡是相关的分子机制。未来MK2 有望成为研究高血压发病过程中左心室重塑发病机制及防治手段的分子靶点。

