超声造影、DWI及血清TPO-Ab、TSH、TGA对甲状腺乳头状癌的诊断价值分析*
赵亚影 禹海贺 张圳锋 张东显 柴青芬,*
1.中国人民解放军联勤保障部队988医院超声医学科 (河南 郑州 450007)
2.中国人民解放军联勤保障部队988医院影像医学科 (河南 郑州 450007)
甲状腺乳头状癌(PTC)也称为乳头状癌,是临床较为常见的一种恶性肿瘤,其恶性程度较低,起病隐匿,早期无特异性症状,临床诊断率较低,难以有效区分肿瘤良恶性,易使患者贻误最佳治疗时机[1]。因此,早发现、早治疗对PTC患者至关重要。目前彩超、CT、活检穿刺作为判断甲状腺结节良恶性的重要检查方式,其中超声造影(CEUS)是通过注射造影剂加强肿瘤内微小血流的反射回声,可以精准判别肿瘤的良恶性,但CEUS无法在同一次造影中对不同切面显示的多发病灶进行观察,并且超声造影引导下活检穿刺为有创操作[2]。磁共振扩散加权成像(DWI)是通过检查患者细胞内外水分子的运动情况,进而充分显示肿瘤病灶内的影像学信息,并且可以探查常规超声不能到达的咽旁、纵膈等部位,对鉴别肿瘤良性、恶性和分期意义重大,但患者体内的胃肠蠕动、呼吸、心跳等运动可影响DWI的图像质量,使得DWI在检查过程都具有相对局限性[3]。近年来随着检验技术的不断发展,血清标志物逐渐被用于辅助诊断甲状腺疾病。血清抗甲状腺过氧化物酶抗体(TPO-Ab)、促甲状腺激素(TSH)、抗甲状腺球蛋白抗体(TGA)属于甲状腺的自身抗体,可作用于肿瘤的侵袭、转移、血管生成等过程,对评估PTC具有较高的参考意义[4]。本研究旨在探讨CEUS、DWI及血清TPO-Ab、TSH、TGA在PTC诊断和联合诊断中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料本研究经患者或家属同意及我院伦理委员会批准,收集我院2019年1月至2022年1月92例经病理证实为PTC患者作为PTC组,92例为甲状腺良性肿瘤患者作为良性组。其中PTC组男性33例,女性59例;年龄21~74岁,平均年龄(43.58±7.94)岁;良性组男性35例,女性57例;年龄22~76岁,平均年龄(45.81±8.26)岁。两组临床资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:符合《甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版)》[5]PTC诊断标准者;沟通能力、理解能力正常者;配合度较高者;临床资料齐全者等。排除标准:合并精神类疾病,意识不清者;合并其他部位肿瘤疾病者;合并有甲亢或者甲减病史者;合并心、肝、肾、肺等重要脏器功能不全者;临床资料不全等。
1.2 方法(1)CEUS:患者在CEUS检查前需要禁食8h,采用超声诊断仪(深圳中科乐普医疗技术有限公司,粤械注准20222060697,型号规格:LP3 Pius),探头型号:2P2F-A,探头频率3.5~5.5MHz。先用二维超声扫描观察肿瘤的基本情况,将造影剂(声诺维)与5.0mL生理盐水混合并摇匀呈悬浊液,2.5mL悬浊液注射于肘静脉。CEUS检查模式代替二维超声模式,观察肿瘤病灶内结节的动态灌注情况,在检查过程根据结节的大小调节适合的造影模式。患者在检查过程需要平稳呼吸或者屏气,不能出现吞咽动作,并且图像采集时间保持在2min以上。
(2)DWI:采用超导型磁共振成像系统(辽宁开普医疗系统有限公司,国械注准20173063048,型号规格:Supernova OS5),其中包括0.5 T磁体子系统(型号:MROS5-M420,含磁体监视单元)、接收线圈、患者床(MR0S5-COUCH)、系统机柜(MROS5-System Cabinet)、计算机子系统及系统软件(版本:R3)、心电门控、呼吸门控。取仰卧位,颈部使用海绵进行支撑,甲状腺裸露在外面,DWI扫描过程不能做吞咽动作。常规扫描序列:使用单次激发SE-EPI序列,敏感梯度脉冲做在X、Y、Z轴上,扩散加权敏感系数:800s/mm2,矩阵:128×128,间隔:1mm,层厚:6mm,视野:38cm×34.2cm,回波时间:56.6ms,重复时间:4000ms,采集两次影像学图像。动态增强成像:DWI扫描的对比剂是二乙烯五胺乙酸钆,其注射剂量是0.2mmoL/kg。采集的影像学图像运用配套图像系统分析。
1.3 观察指标和评价标准比较两组的血清TPO-Ab、TSH、TGA水平、超声征象与表观扩散系数(ADC)值,评估CEUS、DWI及血清TPO-Ab、TSH、TGA单项以及联合诊断与病理诊断结果,同时分析CEUS、DWI及血清TPO-Ab、TSH、TGA对PTC的诊断价值。
(1)血清TPO-Ab、TSH、TGA水平:采集静脉血5mL,3 000r/min离心15min分离血清,血清TPO-Ab、TSH、TGA水平由化学发光法(南京诺尔曼生物技术股份有限公司,苏械注准20172400140,型号规格:2×50人份/盒)测定。严格按照试剂盒操作说明书进行。
(2)超声征象与ADC值:包括淋巴肿大、钙化、回声不均匀、边界不清、形态不规则、血流分级等方面,统计其发生例数。DWI扫描后根据扩散加权敏感系数自动计算生成ADC图,以此测量两次取均值,并记录。
(3)CEUS、DWI及血清TPO-Ab、TSH、TGA单项以及联合诊断与病理诊断结果:阳性标准:以结节增强强度、增强模式作为判定标准,结节分为4级,根据结节增强强度、增强模式进行判断,CEUS检查患者结节在4级以上则是甲状腺癌;运用HE染色处理,光镜观察,出现以下病理学表现之一则为PTC阳性:区域转移、远处转移;肿瘤甲状腺内血管和(或)包膜侵犯;高细胞变异,坏死;血清TPO-Ab水平>9 IU/mL;血清TSH水平>2.5 μIU/mL;血清TGA水平>4 IU/mL;联合检测的结果以双阳为阳作为联合诊断标准。
(4)CEUS、DWI及血清TPO-Ab、TSH、TGA对PTC的诊断价值:通过分析灵敏度、特异性、阳性预测值、阴性预测值评估PTC的诊断价值。灵敏度=真阳性人数/(真阳性人数+假阴性人数)×100%,特异性=真阴性人数/(真阴性人数+假阳性人数)×100%,阳性预测值=真阳性人数/(真阳性人数+假阳性人数)×100%,阴性预测值=真阴性人数/(假阴性人数+真阴性人数)×100%。
1.4 统计学方法数据录入SPSS 22.0软件中分析,计数资料用例表示,采用χ2检验,等级资料采用秩和检验,计量资料用()表示,采用t检验,检验水准a=0.05。血清TPO-Ab、TSH、TGA、CEUS、DWI单项以及联合诊断与病理诊断运用Kappa系数检测结果的一致性,0≤Kappa系数≤1,一致性极低处于0.00~0.20之间,一致性一般处于0.21~0.40之间,一致性中等处于0.41~0.60之间,高度一致性处于0.61~0.80之间,一致性完全相同处于0.81~1之间。
2 结果
2.1 血清TPO-Ab、TSH、TGA水平比较PTC组的血清TPOAb、TSH、TGA水平均高于良性组(P<0.05)。见表1。
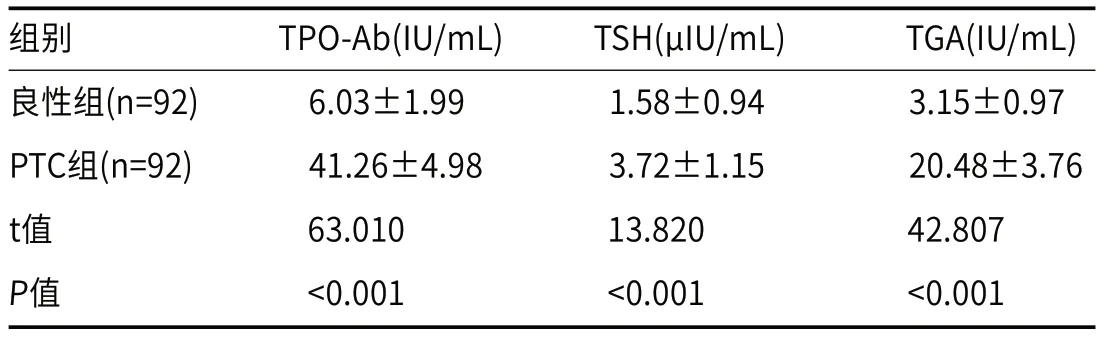
表1 两组血清TPO-Ab、TSH、TGA水平比较
2.2 超声征象与ADC值比较PTC组的淋巴肿大、钙化、回声不均匀、边界不清、形态不规则比例高于良性组(P<0.05);PTC组血流分级以Ⅱ-Ⅲ级为主,良性组以Ⅰ-Ⅱ级为主,两组血流分级比较,差异有统计学意义(P<0.05);PTC组的ADC值低于良性组(P<0.05)。见表2、图1。
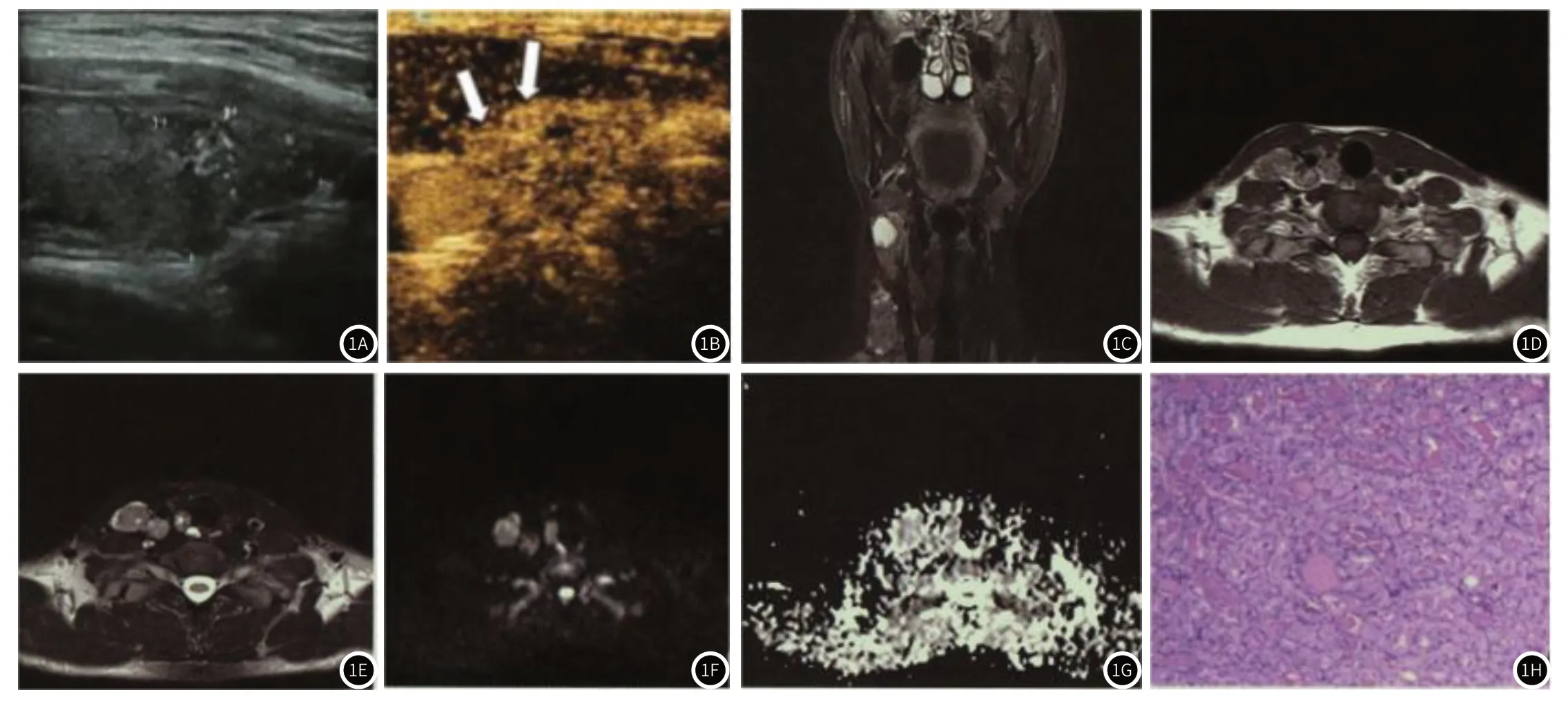
图1 男性患者,年龄为31岁,甲状腺右叶下极PTC,病灶大小约为25mm×11mm×16mm。图1A:甲状腺右叶下极低回声结节,边缘不规则,内见微小钙化;图1B:CEUS示结节在动脉期呈不均匀高增强,增强范围超过前被膜;图1C:DWI冠状位STIR像示甲状腺右叶下极低、等信号结节、信号均匀,右侧Ⅱ-V区示高等混杂信号的淋巴结转移灶;图1D:DWI轴位T1WI像示病灶内见斑片状高信号及低信号改变;图1E:DWI轴位FS-T2WI像示T1WI像所示低信号区呈高信号改变;图1F:b=500s/mm2时的DWI图像,病灶呈高信号改变;图1G:b=500s/mm2时的ADC图像,病灶呈不均匀低信号改变,根据T1WI、T2WI、DWI、ADC,放置测量中心时避开病变内肉眼可见的微小囊变区;图1H:病理示滤泡亚型甲状腺腺瘤,癌细胞核大、异型、排列拥挤,部分细胞核呈毛玻璃状改变(HE×100)。

表2 两组超声征象与ADC值比较
2.3 CEUS、DWI及血清TPO-Ab、TSH、TGA单项以及联合诊断与病理诊断结果比较本研究经Kappa一致性检测结果显示,血清TPO-Ab(Kappa=0.579,P<0.05)诊断结果和病理诊断结果为一致性中等;血清TSH(Kappa=0.641,P<0.05)、TGA(Kappa=0.703,P<0.05)、CEUS(Kappa=0.625,P<0.05)、DWI(Kappa=0.661,P<0.05)诊断结果和病理诊断结果为高度一致性;联合检测(Kappa=0.819,P<0.05)诊断结果和病理诊断结果为一致性完全相同,并且联合检测的一致性最高。见表3。
2.4 CEUS、DWI及血清TPO-Ab、TSH、TGA对PTC的诊断价值联合诊断的灵敏度(86.96%)、阴性预测值(86.36%)分别高于血清TPO-Ab、TSH、TGA、CEUS以及DWI的单一指标诊断。见表4。
3 讨论
由于癌基因、生长因子、电离辐射、遗传等因素影响,使得PTC的发生率呈上升趋势,PTC的发病机制较为复杂,其生长较为缓慢,肿瘤分化程度较高,预后较好,但部分患者会出现局部浸润、向远处转移等恶性行为,经治疗并无显著效果[6]。因此,早期及时、有效的诊断可避免肿瘤的进一步恶化。近年来超声、活检穿刺、血清指标是目前推荐鉴别PTC的辅助方法,其中CEUS将造影剂注入机体,以便清晰呈现实质组织中的微血管结构,进而准确判断肿瘤的良恶性[7]。DWI可以检测组织内水分子的扩散情况,从而还可以对细胞功能和代谢状况进一步检测,以便了解肿瘤内的实质病变情况[8],但CEUS与DWI并不适用于对造影剂过敏的患者,并且诊断结果也受检查医师的技术和经验的影响。血清TPOAb、TSH、TGA作为一种特异性指标,其水平变化与PTC的发生关系密切,可以在CEUS与DWI检查的基础上提供辅助作用[9-10]。
本研究结果显示,PTC组的血清TPO-Ab、TSH、TGA水平均高于良性组,PTC组的淋巴肿大、钙化、回声不均匀、边界不清、形态不规则比例高于良性组,PTC组血流分级以Ⅱ-Ⅲ级为主,良性组以Ⅰ-Ⅱ级为主,PTC组的ADC值低于良性组,这提示CEUS、DWI及血清TPO-Ab、TSH、TGA是诊断PTC重要影像学检查方式,分析其原因可能为PTC的发病机制是机体内血液循环中含有分泌的大量的甲状腺激素,可促使患者的代谢紊乱以及提高精神神经兴奋性[11]。而且甲状腺癌多表现为甲状腺外侵犯、多灶性以及颈部淋巴结转移等特点,由于PTC体积较小,血管床发育不成熟,生长较为缓慢,经常规二维超声检查典型征象较不突出,并且受操作者人为因素影响,易出现漏诊[12]。CEUS通过注入造影剂增加肿瘤内病灶对比度,提高血流信号的扩散强度,可以精准发现微小病灶,有助于评定组织与病变的血供情况[13]。黄元发[14]等人在研究中显示,DWI定量检测组织内的情况,可发现侵袭性较高的肿瘤具有更高的细胞密度,并且由于更大的细胞核和更多阻碍结构的影响,能够使组织内的水分子扩散受限,从而该检查方式对判断侵袭性和非侵袭性肿瘤及其邻近结构的受累有很大的优势。另外,明确PTC的性质可以经测量病变ADC值获取数据,并且TPOAb、TGA作为甲状腺的自身抗体,其中TPO-Ab的水平与机体内淋巴细胞的浸润相关,TSH在甲状腺激素生理作用中起到调节作用,能够用于检测PTC,在患者发生恶性病变时血清TPO-Ab、TSH、TGA水平以及超声征象会出现明显差异性,可在早期及时发现该疾病,避免疾病进一步发展,出现转移的情况[15]。
本研究经Kappa一致性检测结果显示,联合检测诊断结果和病理诊断结果为一致性完全相同,并且联合检测的一致性最高,联合诊断的灵敏度、阴性预测值分别高于血清TPO-Ab、TSH、TGA、CEUS以及DWI的单一指标诊断,这提示CEUS、DWI联合血清TPO-Ab、TSH、TGA在PTC诊断中具有较高的临床应用价值,可以提高诊断准确率,可能是因为甲状腺良性结节和恶性结节中血管和微血管分布具有差异性,并且良性结节的通过造影显示结节周围出现环形增强,甲状腺癌通过造影显示不均匀增强。常规超声可以对PTC的浸润性进行判断,还可以判定良性结节的造影范围,但无法根据肿瘤病灶内边界回声和甲状腺被膜中断征象的关系来分析肿瘤是否存在侵袭性以及确定甲状腺癌的造影范围[16]。CEUS可以清晰呈现肿瘤内血管分布与走形,在患者体内注射造影剂可以明显显示正常组织和PTC表现强度的差异性,有助于肉眼区分PTC的良恶性。DWI具有较高的分辨率和软组织对比度,可以用于诊断PTC的侵袭性与良恶性[17]。因此,CEUS、DWI联合血清TPO-Ab、TSH、TGA在鉴别、诊断PTC中应用价值较高,可以了解患者肿瘤内血清学指标的动态变化情况,获取客观数据,并且CEUS与DWI可以实时监测肿瘤内新生血管生成情况,以及利用高分辨率和高对比度影像学成像分析病理与肿瘤内病灶的关联性,从而快速提高疾病诊断率[18-19]。但在诊断中易出现假阳性和假阴性的情况,可能与PTC结节出现粗大钙化、后方回声失落或者难以将结节和正常甲状腺组织进行区分,故发生误诊、漏诊情况。
综上,CEUS、DWI联合血清TPO-Ab、TSH、TGA在PTC诊断中具有较高的临床应用价值,可以提高诊断准确率。

