磁共振DWI评估脑胶质瘤预后及其与肿瘤细胞Ki-67表达及IDH1基因型的相关性
徐彤彤 王贝茹 赵海珊 胡春峰 马 红
徐州医科大学附属医院放射科 (江苏 徐州 221000)
胶质瘤是起源于神经上皮组织的一类肿瘤,是目前最常见的原发性中枢神经系统肿瘤[1]。WHO中枢神经系统肿瘤分类将胶质瘤分为4级,不同患者的临床结局有相当大的变化性,生存时间的范围很广[2]。由于其不同的生物组织类型,导致其预后不同。在众多报道的生物标志物中,Ki-67表达是重要的生物行为标志物[3]。在增殖生物标志物方面,Ki-67核抗原仅存在于增殖细胞中,这使其成为快速评估正常和异常细胞生长分数的可靠途径[4]。异柠檬酸脱氢酶(IDH1)是人体内重要的生物酶,参与能量代谢、维生素及氨基酸合成等过程,是胶质瘤的重要的分子学特征之一[5]。弥散加权成像(DWI)已被提出作为胶质瘤患者生存预测的候选指标[6]。该技术反映了细胞内和细胞外间隙的含水量程度,可以用来测量肿瘤细胞的数量。表观扩散系数(ADC)由扩散加权图像计算[7]。大多数神经胶质瘤在ADC图上呈高信号,比正常脑组织有更多的水扩散[8]。本研究拟分析DWI对胶质瘤预后预测的意义及其与Ki-67表达及IDH1基因型的关系。
1 资料与方法
1.1 研究对象收集我院自2016年2月至2020年8月患者手术后经病理证实为胶质瘤的58例患者,随后进行回顾性分析,所有患者术后均在我院进行同步放化疗、定期随访、且具备完整的影像学资料。
纳入标准:常规MRI平扫、增强前未做任何放化疗及手术治疗;MRI检查后一周内于我院进行肿瘤切除术,术后病理证实为胶质瘤,且均采用免疫组化方法检测Ki-67表达;术后于我院行放疗、替莫唑胺同步及辅助化疗;术后于我院定期随访。排除标准:失访;术前扫描序列不全、图像伪影等;患者死于其他不相关的原因(车祸、其他疾病等)。本研究经我院伦理委员会审核批准。
58例患者中,男性32例,女性26例;年龄8-76岁;低级别胶质瘤21例,包括WHOⅠ级 2 例,WHOⅡ级 19 例 ;高级别胶质瘤 37 例,包括WHOⅢ级 9 例,WHOⅣ级28例。既往研究指出Ki-67=10%为高低表达分界点,根据不同患者肿瘤的Ki-67表达不同将其分为高、低表达组。患者一般资料见表1。

表1 58例胶质瘤患者资料
1.2 MRI检查使用Discovery 750W,GE Healthcare,Wisconsin 3.0T 磁共振成像系统,所有患者均行横轴位T1WI、T2WI、FLAIR、矢状位T1WI平扫及冠状位、矢状位及横轴位T1增强,对比剂使用钆喷替酸葡甲胺(GD-DPTA)。增强扫描包括T1WI轴位、冠状位和矢状位,TR/TE=2952.6ms/24ms,matrix=320×224,NEX=2,slice thickness/slice gap=6mm/1.5mm。
1.3 图像后处理扫描完成后将所获得的原始图像传至GE Advantage Workstation 4.6后处理工作站,采用Functool软件对原始数据进行后处理,获得表观扩散系数(ADC)伪彩图。所有图像均由2名经验丰富的放射科医生勾画感兴趣区(ROI),在肿瘤实质区采用手绘法放置感兴趣区(ROI)进行定量分析,测量相应区域的 ADC值,测量3次后取平均值,注意ROI选取时应尽量避开坏死、囊变、出血、钙化等区域。如图1所示。

图1A-图1C 一例胶质瘤患者ROI选取与ADC值测定;男,57岁,左侧顶颞枕叶高级别胶质瘤(IV级)。分别为磁共振DWI序列,eADC图,ADC图。
1.4 统计学方法采用SPSS 25.0软件。计量资料的结果用()表示,比较两组数据时,先判断是否符合正态分布,如则采用独立样本t检验判断两样本之间是否存在统计学差异。以ADC值中位数为分界进行分组,单因素生存分析采用Kaplan-Meier法绘制生存曲线,并采用Log-rank检验进行生存比较;多因素分析则采用Cox比例风险模型。采用Pearson相关分析胶质瘤肿瘤实性部分ADC值与Ki-67表达及IDH1基因型的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 Kaplan-Meier生存曲线分析以58例胶质瘤患者肿瘤实质区域平均ADC值的中位数分组,通过Kaplan-Meier法绘制生存曲线,并采用Log-rank检验对患者生存情况进行比较,P<0.05认为差异有统计学意义。结果及典型病例见表2及图2。
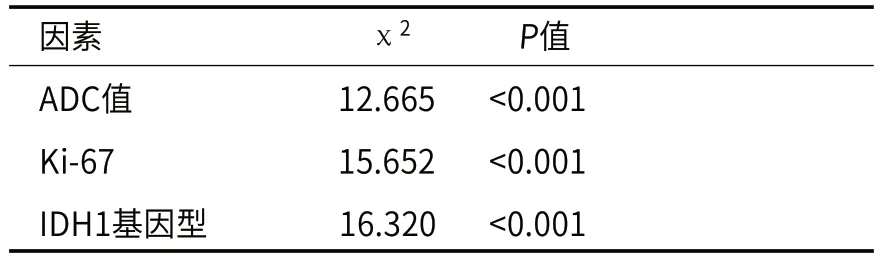
表2 胶质瘤患者预后的单因素生存分析(Log-rank法)

图2 Kaplan-Meier生存曲线分析;Kaplan-Meier生存曲线显示ADC值≤1.020的患者比ADC值>1.020的患者生存期短,差异有统计学意义。(P<0.001)。图3 Kaplan-Meier生存曲线分析;Kaplan-Meier生存曲线显示Ki-67>0.1的患者比Ki-67≤0.1的患者生存期短,差异有统计学意义。(P<0.001)。图4 Kaplan-Meier生存曲线分析;Kaplan-Meier生存曲线显示IDH1野生型的患者比IDH1突变型的患者生存期短,差异有统计学意义。(P<0.001)。
以58例胶质瘤患者肿瘤IDH1基因突变状态为野生型、突变型分组。结果见表2及图4。
2.2 胶质瘤患者的Ki-67表达及IDH1基因突变状态临床资料分析采用卡方检验对不同肿瘤直径、不同病理级别的胶质瘤患者的Ki-67表达及IDH1基因突变状态进行差异分析。卡方检验表明Ki-67表达及IDH1基因突变状态在肿瘤直径间的差异无统计学意义(P>0.05),也表明Ki-67表达及IDH1基因突变状态在LGG、HGG级别间的差异有统计学意义(P<0.05)。结果见表3。
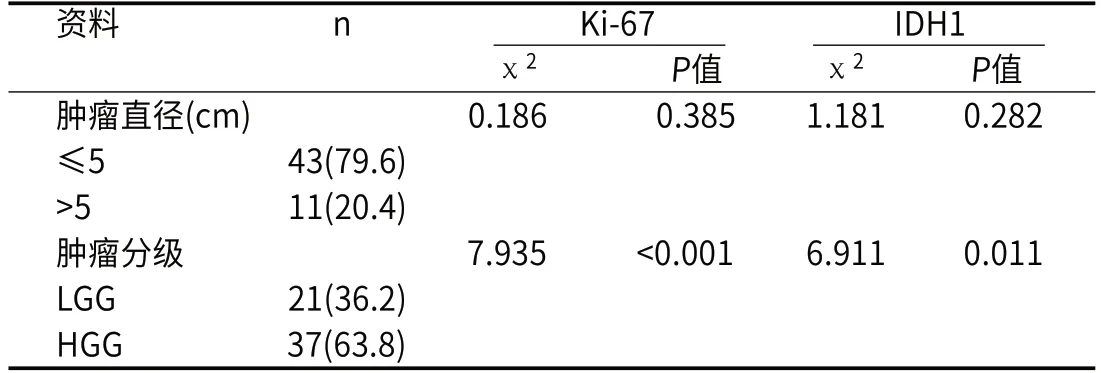
表3 不同肿瘤直径、不同病理级别胶质瘤患者Ki-67表达及IDH1基因突变型差异分析
2.3 以58例胶质瘤患者肿瘤实质区域Ki-67表达>10%分组结果及典型病例见表2及图3。
2.4 COX回归模型将ADC值、Ki-67表达、IDH1突变状态、患者性别、年龄、肿瘤平均体积一起纳入多因素COX等比例回归模型,采用进入法(Enter法),结果显示ADC值、Ki-67表达、IDH1基因型是胶质瘤患者的独立预后因素,ADC值越小、Ki-67表达越高、IDH1基因型为野生型,死亡风险越大,结果见表4。
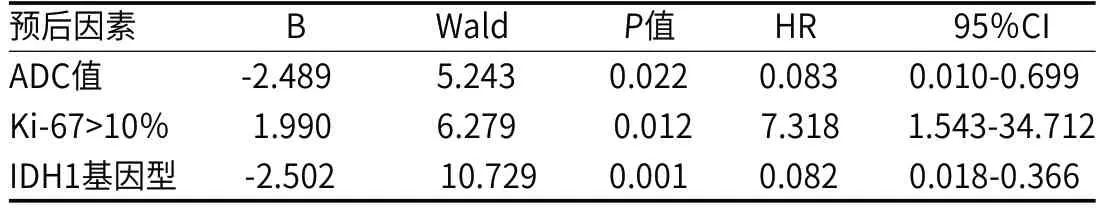
表4 胶质瘤预后的多因素生存分析
2.5 Pearson 相关分析结果分析Ki-67表达、IDH1突变状态与ADC值之间的相关性,肿瘤实质区的ADC 值与Ki-67呈负相关(P<0.05),与IDH1突变状态相关性无统计学差异。结果见表5。

表5 ADC值与Ki-67表达之间的相关性分析
3 讨论
胶质瘤恶性程度高,具有明显的侵袭性,即使经过手术加放化疗联合的全面综合治疗方案,患者的预后仍较差[9]。本研究共纳入的58例胶质瘤患者中至随访截止日期共有28例死亡。
年龄、肿瘤的病理学分级、肿瘤分子标志物及手术的切除程度,普遍认为是影响胶质瘤患者预后的重要因素[10]。本研究中年龄并没有成为胶质瘤患者预后的独立危险因素,与既往研究结论并不相符[11],可能是由于本研究属于回顾性研究,对于病例的选择存在一定的偏倚以及研究的样本量有限,因此对于年龄是否与胶质瘤患者的生存期之间存在关系尚需要通过大样本量的研究区验证。同时,本研究发现肿瘤的病理学分级也不是影响胶质瘤患者预后的独立危险因素[12]。我们分析原因可能是由于肿瘤本身的异质性或者病理学专家操作不同使得进行病理检测的部分并不是肿瘤最活跃的部分,最终导致肿瘤分级的误判。也可能是由于组织分型的不一致导致患者生存期之间的差异。
近年来,MRI作为医学影像学的重要组成部分得到了迅速发展,已成为脑胶质瘤首选的影像诊断方法[13]。DWI是通过测量病理和生理条件下水分子的交换状态来实现的[14]。由于胶质瘤的最佳ADC测量方案有望在手术前提供生存或组织病理学信息,ADC值与胶质瘤患者生存期之间的相关性越来越受到关注。HGG细胞密度大,生长活跃,核浆比高,细胞内含水量明显要高于细胞外的空间,所以DWI信号高,ADC值相对较低[15]。LGG细胞则相反[16]。修订后的WHO分类是基于特定的组织学特征,如细胞性、核异型性、有丝分裂、多形性、血管增生和坏死,这一标准表明LGG比HGG有更多的正常脑细胞。因此,较低的肿瘤比例与较多的正常脑细胞相关,这就导致了较低的ADC值。在本研究中,我们对不同胶质瘤患者肿瘤的ADC值进行生存分析,找出了胶质瘤患者预后的独立危险因素。Kaplan-Meier生存曲线显示,当ADC值≤1.020时,患者总生存期会下降,预后也较差。
Ki-67是由2条多肽链构成的非组蛋白性核内蛋白,分布于增殖细胞核内,可以有效表达细胞核增殖能力[17]。在有丝分裂过程中,细胞呈近球形,染色体浓缩并附着在纺锤状纤维上,纺锤状纤维将每个染色体的一个副本拉到细胞的对侧[18]。在肿瘤组织中,出现了较高的细胞数量、较密集的肿瘤、较窄的细胞间隙、增大的细胞核、较高的核质比率和新的血管生成[19]。目前,Ki-67已成为观测细胞增殖指数的重要指标,这被认为是评估细胞增殖、肿瘤行为、治疗反应和预后信息的最可靠方法之一[20]。既往研究[21]表明Ki-67表达高于10%预后比低于10%的患者更差,这与我们研究结果相符。Stadlbauer[22]等报道,7例WHOII级胶质瘤患者的平均ki-67表达显著低于13例WHOIII级胶质瘤患者的值。然而,Lee等[23]、Kinoshita等[24]和Server等[25]显示高级别胶质瘤的平均Ki-67值低于低级别胶质瘤,但差异不显著。我们分析可能是由于ROI位置的变化,位于胶质瘤中心的ROI可能容易发生肿瘤坏死。
IDH是人体内重要的生物酶,主要通过催化异柠檬酸氧化脱羧生成代谢产物α-酮戊二酸和烟酰胺腺嘌呤二核苷酸[26]。目前已知的人类基因组包含5中IDH,编码3种不同的酶产物,包括IDH1、IDH2、IDH3,主要以IDH1与人类脑胶质瘤发生、发展最为密切[27]。IDH1基因突变在胶质瘤中的作用机制很多、也很复杂,目前比较认可的是IDH1-2-羟戊二酸致癌学说[28]。既往研究[29]表明WHO分级相同胶质瘤患者IDH1突变型预后比IDH1野生型更好,这与我们研究结果相符。我们分析原因可能是由于IDH1突变后导致HIF-1α降解,抑制了肿瘤的侵袭性行为,如肿瘤血管的生成等。Beiko等对335例胶质瘤患者研究发现相较于IDH1野生型,对IDH1突变型胶质瘤行最大范围安全切除术后患者的总生存期显著延长。
综上所示,磁共振DWI评估胶质瘤患者预后及与肿瘤Ki-67表达的相关性,有助于合理制定治疗方案。然而,本研究尚存在不足之处:本研究要求入组病例需满足MRI平扫、增强、免疫组化检测及定期随访,所选样本样本量较小。且本研究采用回顾性的研究,对病例的选择存在一定的偏倚,结果可能存在一定的偏差。因此,将来有待扩大样本量、完善及预后相关的临床资料等措施,以期更有利的说明问题。

