多层螺旋CT鉴别孤立型肺黏液腺癌与非黏液浸润性腺癌的应用价值*
赵利芳 钱伟军,* 李 立 赵 文 杨 洁
1.河南省开封市中心医院影像科 (河南 开封 475000)
2.河南大学第一附属医院影像科 (河南 开封 475000)
原发性肺黏液腺癌属肺腺癌的一种特殊类型[1],临床上比较少见,约占肺腺癌的0.25%[2]。根据影像学特点分为孤立型和肺炎型,孤立型比较常见[3],孤立型肺黏液腺癌(solitary pulmonary mucionous adenocar-cinoma,SPMA)与非黏液侵润性腺癌(nonmucionous invasive pulmonary ade-nocarcinoma,NMIPA)CT表现比较相似。肺黏液腺癌可能来源于杯状细胞和柱状细胞,它的分化程度高,恶性程度低[4],两者的预防、治疗及预后有所不同。正确认识肺黏液腺癌的CT征象,对临床的预防和治疗、预后具有重要意义。目前肺黏液腺癌的影像报道较少,本研究通过SPMA与NMIPA的CT征象鉴别,提高SPMA诊断及鉴别诊断。
1 资料与方法
1.1 一般资料搜集本院2017年8月至2022年8月经手术或穿刺活检病理证实的40例SPMA和50例NMIPA的临床及CT资料。SPMA组,男13例,女27例,年龄(62.10±12.16)岁;NMIPA组,男22例,女28例,年龄(63.86±11.09)岁。两组孤立型病变直径均≤30mm。SPMA组12例患者以咳嗽、咳痰、发热、胸闷入院,28例无症状体检发现,所有患者均未出现转移;NMIPA组21例患者以咳嗽、咳痰、胸痛、憋喘、体重减轻入院,29例无症状体检发现,7例患者出现转移。
入选标准:图像无伪影符合诊断要求;手术或穿刺活检病理结果无异议。排除标准:转移性或肺炎型肺黏液腺癌;接受放疗、化疗者。本研究通过医院伦理委员会审批。
1.2 检查方法所有患者均采用联影16排螺旋CT或Aquilion64排螺旋CT,患者采取仰卧位,扫描范围包括双肺尖至肋膈角以下(包括双侧肾上腺),扫描层厚5mm、层间隔5mm,100KV,电流Autom自动调节,矩阵512×512,行1mm薄层后处理重建。病变行增强扫描:肘静脉3mL/s流率,高压注射器团注非离子造影剂碘克沙醇80mL,继续注射生理盐水20mL,注射对比剂后30s、90s后行双期增强扫描。观察图像:肺窗窗宽1600-2000HU窗位-600--800HU;纵隔窗250-350HU,窗位30-50HU。
1.3 图像分析所有图像由两名心胸学组的主治医师采用双盲法对平扫CT征象包括病灶部位、大小(肺窗最大直径、同层纵隔窗最大直径、Δ病灶直径差值=肺窗最大直径-同层纵隔窗最大直径)、密度 (实性、混合磨玻璃、纯磨玻璃)、边缘(清晰、模糊)、有无分叶、毛刺、空泡征、钙化、空气支气管征、胸膜牵拉征、卫星灶、转移;增强CT征象包括病灶内部有无血管造影征、无强化液化坏死区、净强化CT值(HU):Δ动脉期=动脉期强化CT-平扫CT值,ΔCT 静脉期=静脉期强化CT值-平扫CT值,等进行评价。评价有异议,由副主任医师经讨论后确定。
1.4 统计学分析采用SPSS 20.0统计学软件对两组数据进行统计学分析。对患者年龄、病变大小、Δ病灶直径差值、净强化CT值采用两个独立样本t检验;对患者的性别、各CT征象构成比采用χ2检验,以P<0.05时,差异有统计学意义。
2 结果
2.1 一般资料两组患者年龄及性别比较差异无统计学意义(P>0.05)(表1)

表1 SPMA组和NMIPA组一般临床资料比较
2.2 两组CT征象比较SPMA及NMIPA 分叶征、毛刺、纯磨玻璃密度、空泡征、平扫肺窗最大直径差异无统计学意义(P>0.05)。SPMA组发生在双肺下叶、边缘模糊、混合磨玻璃密度、钙化、空气支气管征、瘤周卫星灶、血管造影征、无强化坏死区、Δ病灶直径差值(mm)均高于NMIPA组,差异有统计学意义(P<0.05)。
SPMA发生在双肺上中叶、边缘清晰、实性密度、胸膜牵拉征、转移、平扫纵隔窗最大直径(mm)、Δ动、静脉期低于NMIPA组,差异有统计学意义(P<0.05),见表2。
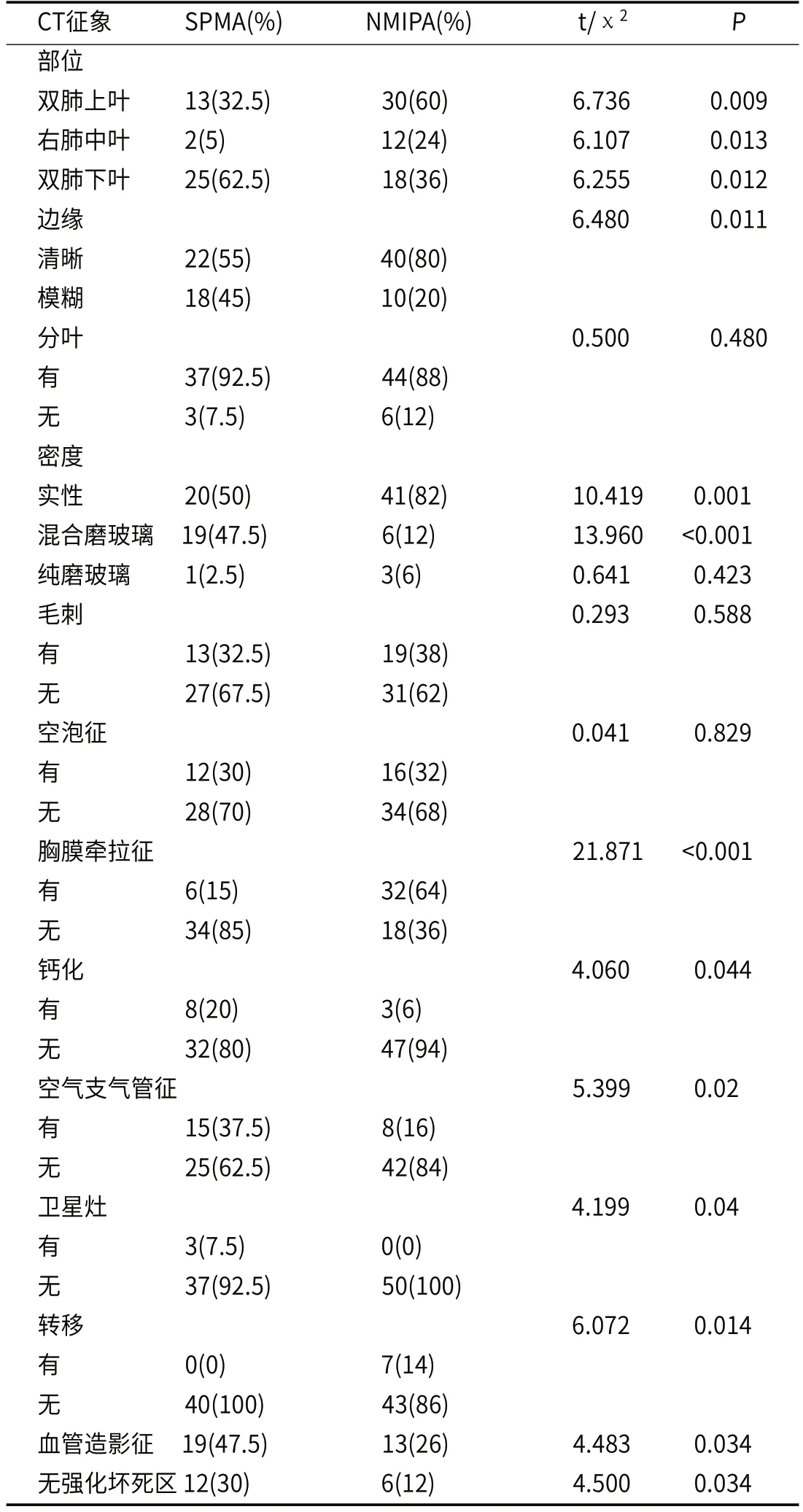
表2 SPMA组和NMIPA组的CT征象比较(例,%)
2.3 两组病灶的参数比较(见表3)
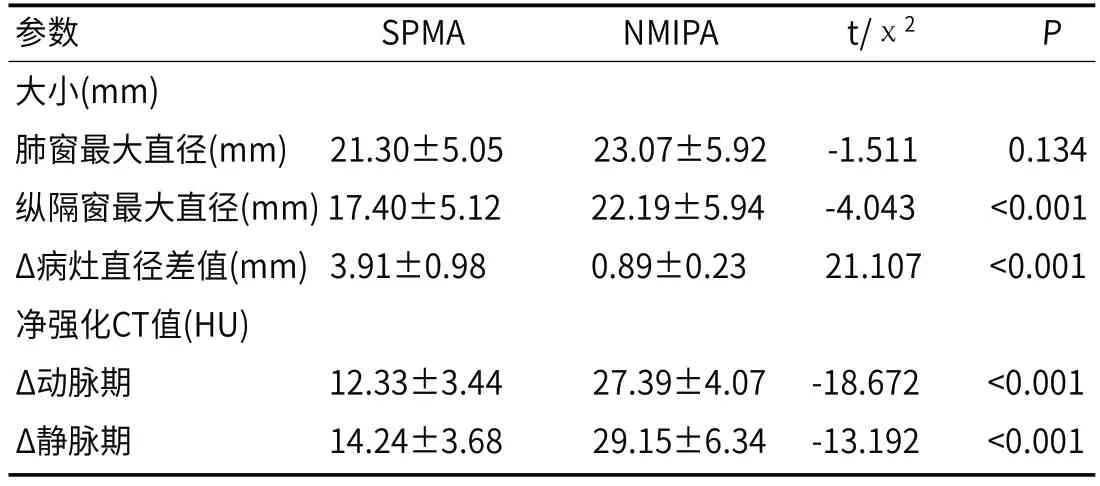
表3 SPMA组和NMIPA组的参数比较
2.4 典型病例(见图1-2)
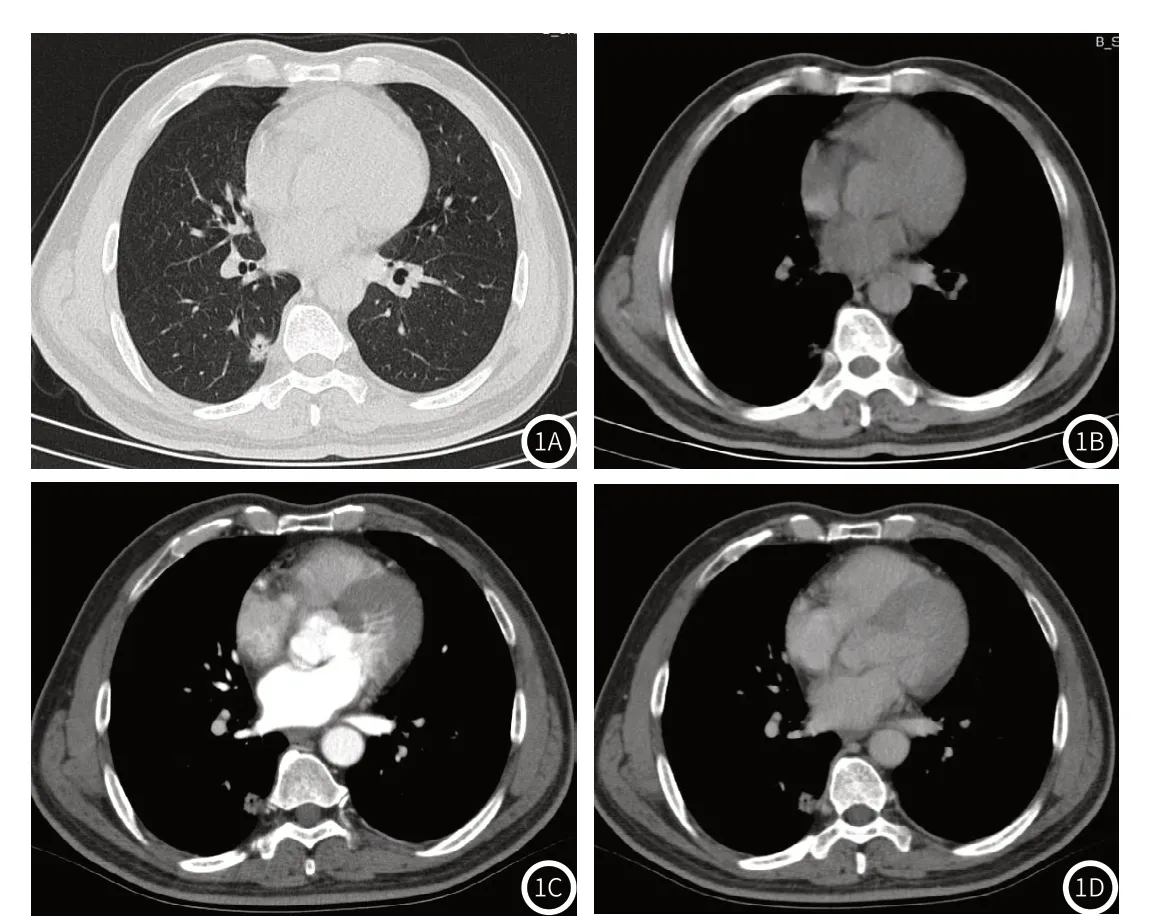
图1 男性,65岁,图1A-图1B 右肺下叶胸膜下结节影,肺窗最大直径12mm,纵隔窗最大直径8mm,差值为4mm,边缘模糊,其内小泡征,图1C-图1D 增强CT病灶呈轻度强化。病理证实肺黏液性腺癌。
3 讨论
3.1 临床特点肺黏液腺癌是腺癌一种少见病理类型,较肺腺癌恶性程度低,生存率更长[2]。临床上少见,易误诊为肺炎、结核,非黏液腺癌等。已有较多研究者将SPMA与肺内良性病变的CT征象鉴别[4-5],对SPMA与NMIPA的CT征象鉴别研究较少,且样本量不足。本研究通过SPMA与NMIPA的CT征象鉴别,对SPMA诊断、防治有重要意义。SPMA组男女性别之比约为1:2,女性明显 多于男性,与文献报道接近[4],SPMA与NMIPA组性别及年龄比较发病率无差异,与文献报道一致[5]。
3.2 CT征象本研究通过SPMA与NMIPA部位、大小、密度、边缘、内部特征、瘤周卫星灶、转移、增强表现分析发现SPMA好发于两肺下叶,NMIPA常见于肺上中叶,与梁拥辉等[6-7]研究一致。形成原因及机制不明确,需进一步研究。(2)SPMA平扫肺窗最大直径(mm)与NMIPA无差异,但SPMA平扫纵隔窗最大直径(mm)明显小于NMIPA,而SPMAΔ病灶直径差值(mm)大于NMIPA,差异有统计学意义。说明SPMA病灶周围有黏液分泌或者癌细胞呈贴壁生长,肺泡腔未被填充,平扫纵隔窗最大直径明显缩小[8],而NMIPA周围无黏液分泌,癌细胞以乳头、微乳头、实体型为主表现为实体型[9],平扫纵膈纵隔窗最大直径缩小不明显。NMIPA以实性多见,SPMA以混合磨玻璃多见,两者比较差异有统计学意义,纯磨玻璃两者比较少见,差异无统计学意义,与国内外文献报道一致[10-12]。可能与SPMA病理类型有关,SPMA以贴壁生长伴腺泡型为主,加上癌细胞分泌黏液成分表现为混合磨玻璃影;而NMIPA以乳头、微乳头、实体型为主表现为实体型。SPMA边缘模糊多见,NMIPA边缘清晰为主,两组比较有统计学意义,与吴顺等[13]报道不一致,分析原因SPMA分泌大量黏液,向周围间隙溢出,致边缘模糊[14],NMIPA周围无分泌黏液,边缘清晰。SPMA与NMIPA分叶、毛刺、空泡征发生率比较差异无统计学意义,与国内报道一致[11,13],分叶、毛刺、空泡是大多数肺部恶性肿瘤常见的征象,与肿瘤生长速度、向周围侵犯有关。SPMA钙化、空气支气管征、卫星灶发生率明显高于NMIPA,与国内报道基本一致[11,13]。钙化是肿瘤生长过程中血供不足,缺血缺氧、液化坏死形成有关,本研究认为SPMA细胞不断变化,出现坏死机会较大。SPMA恶性程度较NMIPA低,对支气管破坏力较弱有关,也有学者认为是黏液腺癌的特征性表现[15]。SPMA分泌大量黏液时,黏液经过肺泡孔向周围播散形成卫星灶[16],NMIPA不能分泌黏液,周围未见卫星灶。NMIPA胸膜牵拉征、转移明显高于SPMA,分析原因SPMA收缩力较NMIPA弱,主要是SPMA边界不是肿瘤的真正边界,含有肿瘤黏液外渗的边界[17]。NMIPA恶性程度高于SPMA,易发生转移[18]。增强CT示:SPMA血管造影征及无强化坏死区发生率明显高于NMIPA,SPMAΔ动静、脉期CT值明显低于NMIPA。本组SPMA以贴壁生长伴腺泡型为主,对周围血管破坏较弱有关,易形成血管造影征,而NMIPA而NMIPA以乳头、微乳头、实体型为主表现为实体型对血管破坏强,不易形成血管造影征。也有学者认为血管造影征是黏液腺癌的特征性表现,也有学者提出质疑,可能与缺少明确的诊断标准有关,如血管长度、实变的密度等[15]。同时SPMA分泌黏液致增强示Δ动静、脉期CT值降低,甚至无强化,当黏液湖形成时,瘤内出现无强化坏死区[19]。
本研究的不足: 样本量不足,未对肿瘤密度分类比较,有待以后继续收集病例进一步研究。综上述,SPMA及NMIPA的CT征象存在一定的差异,双肺下叶、混合磨玻璃密度为主、边缘模糊、钙化、空气支气管征、瘤周卫星灶、Δ病灶直径差值(mm)大、增强呈轻度强化、血管造影征、无强化坏死区有助于SPMA诊断及鉴别诊断,对临床的预防和治疗、预后具有重要意义。

