人lncRNA-GACAT2 过表达载体的构建及其对肺癌细胞增殖和干性的影响
倪 娜, 董洪亮, 高海洋, 陈微微, 孟新宇, 崔冰洁, 杜 静
(1.滨州医学院附属医院医学研究中心,山东 滨州 256603;2.滨州医学院附属医院急诊重症监护室,山东 滨州 256603)
全世界每年有140 万人死于肺癌,近80%的肺癌为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1-2]。目前手术切除是早期NSCLC 的唯一治疗方法。然而,约50%手术患者出现复发[3]。NSCLC 患者的预后较差,5 年生存率仅为15%[4]。因此,寻找更准确的预测NSCLC 的生物标志物对进一步了解NSCLC 细胞生物学和开发新的治疗策略有重要的临床价值。长链非编码RNA (long non-coding RNA,lncRNA)是一类长度>200 个核苷酸的非编码蛋白RNA 分子的总称[5]。近年来,多项研究[6-8]显示:lncRNA 参与基因表达和蛋白修 饰, 并 与 多 种 疾 病 有 关。 研 究[9-10]显 示:lncRNA 部分与肿瘤转移、细胞侵袭和不良预后有关。研 究[11]显 示:NSCLC 组 织 和 血 液 循 环 中lncRNA 失调与癌症的发生发展有关。本课题组前期研究[12]显示:lncRNA SOX2 重叠转录(SOX2 over lapping transcript,SOX2-OT) 可以通过人下游转录因子Gli1 介导的上皮间质转化调控人肺癌H520 细胞迁移。因此,探讨lncRNA 参与NSCLC发生发展的潜在机制可为NSCLC 患者早期诊断、靶向治疗和改善预后提供依据。
lncRNA HNlincRNA717 被人类基因命名委员会 (HUGO Gene Nomenclature Committee,HGNC) 命名为胃癌相关转录本2(gastric cancer related transcript 2,GACAT2)基因,该基因定位于人类18 号染色体p11.22,长度为818 bp[13]。该基因的表达与胃癌的发生发展相关,其在胃癌组织和胃癌相关细胞中呈低表达,且该基因表达下调与肿瘤远处转移、静脉侵犯和神经周围侵犯有关。关于GACAT2 基因在肺癌中表达和作用的报道较少,XIE 等[14]发 现: NSCLC 组 织 和 细 胞 中GACAT2基因表达水平降低,且其表达水平下调与患者不良预后相关。目前,尚无采用基因修饰对GACAT2基因进行细胞层面的功能和机制研究,本研究采用基因工程克隆技术,构建了GACAT2 基因的真核表达载体pc3.1-GACAT2,并将其转染至肺癌A549 及肺癌H1299 细胞中,建立了稳定表达GACAT2 基因的A549 和H1299 细胞,并采用细胞增殖、克隆形成及干细胞成球实验评价GACAT2基因对细胞增殖和肿瘤细胞干性的调节作用,旨在为研究GACAT2 基因在肺癌发生发展中的作用机制提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人肺癌A549 和H1299 细胞由滨州医学院附属医院医学研究中心平台保存。DMEM (高糖) 培养基(以色列 BI 公司),LONSA 胎牛血清(山东增峰生物技术有限公司),细胞因子50×B27(美国Gibco 公司),表皮细胞生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国PeproTech 公司),大肠埃希菌DH5α[天根生化(北京) 科技有限公司]、限制性内切酶HindⅢ和XhoⅠ(大连宝生物工 程 有 限 公 司)、 ClonExpress®Ⅱ One Step Cloning Kit 一步法克隆试剂盒(诺维赞生物科技股份有限公司),总RNA 提取试剂盒(普洛麦格生物技术有限公司),逆转录试剂盒[赛默飞世尔科技(中国)有限公司],Q5 超保真DNA 聚合酶[美国New England Biolabs (NEB) 公 司], 2×Taq Master Mix 和SYBR qPCR 试剂盒(近岸蛋白科技有限公司), Axygen 中量质粒提取试剂盒[康宁生命科学(吴江) 有限公司],凝胶回收试剂盒(美国 Omega 公司),表达载体pc3.1(+) 质粒( 美 国 Invitrogen Life Technologies 公 司),Lipofectamine 3000 (上海Invitrogen 生命技术公司),CCK-8 试剂盒(美国Med Chem Express 公司)。基因扩增仪(德国Eppendorf 公司),倒置光学显微镜(日本Olympus 公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RTqPCR) 仪和凝胶成像系统(美国Bio-Rad 公司),引物DNA 合成和载体DNA 测序均由生工生物工程(上海)股份有限公司完成。
1.2 RNA 提取和逆转录采用总RNA 提取试剂盒收集细胞中总RNA。按照逆转录试剂盒说明书合成cDNA,置于-20 ℃保存备用。
1.3 引物设计根据GenBank 已发表的GACAT2基因保守序列,采用南京喏维赞生物科技公司官网提供的引物设计网页进行引物设计,酶切位点分别为XhoⅠ和HindⅢ,引物序列:GACAT2 基因上游引物5'-CTAGCGTTTAAACTTAAGCTTACAATAAATAAAACAGTTGGTGTCAATACA-3',GACAT2 基因下游引物5'-AACGGGCCCTCTAGACTCGAGAATATTTAAAATGTTTATTTCATAAGCACTG-3' (下划线部分为酶切位点)。
1.4 pc3.1-GACAT2 真核表达载体的构建以制备 的cDNA 为 模 板, 采 用RT-qPCR 法 扩 增GACAT2 基因,在微量离心管中加入下列试剂(50 μL 体系):5×Q5 Reation Buffer 10 μL,dNTP(10 mol·L-1) 1.0 μ L, cDNA (200 ng) 5 μL,Q5 DNA polymerase (2 000 U·L-1) 0.5 μL,ddH2O 37.0 μL。PCR 反 应 程 序: 94 ℃、5 min;94 ℃、30 s,57 ℃、30 s,72 ℃、30 s,35 个循环;72 ℃、10 min,4 ℃保存。通过电泳验证片段大小,琼脂糖凝胶回收试剂盒将扩增产物回收后,空质粒pc3.1(+)及扩增出来的GACAT2 基因片段同时采用HindⅢ和XhoⅠ进行双酶切,然后将酶切产物采用一步法克隆试剂盒进行连接。将连接后的反应产物转化至DH5α 感受态细胞,转化菌液均匀涂布于LB 固体培养基(含50 mg·L-1氨苄青霉素)上,37 ℃倒置过夜培养。次日挑取生长的单个菌落置入LB 培养液(含50 mg·L-1氨苄青霉素)中进行培养,菌液PCR 法进行阳性克隆鉴定,并提取质粒送生工生物工程(上海)股份有限公司测序后进行DNA 序列比对分析。
1.5 细胞培养和转染采用含10% 胎牛血清的DMEM(高糖)培养基培养肺癌A549 和H1299 细胞,于37 ℃、5%CO2的环境中培养。收集处于对数生长期细胞,使细胞密度达到1.0×105mL-1,按2 mL/孔的密度将细胞铺于6 孔细胞培养板中,待次日细胞密度达80%~90%时进行转染。细胞分为空载体组(转染pc3.1 空载体) 和pc3.1-GACAT2 组(转染pc3.1-GACAT2 重组质粒),并按照脂质体转染试剂盒说明书进行转染。
1.6 GACAT2 过表达稳定株的筛选G418 最佳作用浓度筛选:将A549 和H1299 细胞传代接种至24 孔细胞培养板,使每孔细胞的覆盖率达约60%,分为未转染组、转染pc3.1 空载体组和转染pc3.1-GACAT2 组, 48 h 后每组分别加入G418,使其终浓度分别为0、200、400、600、800和1 000 mg·L-1,连续观察4~7 d 后,选取能导致未转染组细胞完全死亡的G418 浓度作为后续筛选重组质粒细胞克隆的最佳工作浓度,其中A549 细胞最佳工作浓度为200 mg·L-1,H1299 细 胞 最 佳 工 作 浓 度 为400 mg·L-1。
稳定株的筛选:根据筛选出的最佳G418 作用浓度转染pc3.1 空载体和pc3.1-GACAT2 重组质粒的A549 和H1299 细胞直至获得稳定存活的细胞,并将细胞分别命名为空载体组(转染pc3.1 空载体) 和pc3.1-GACAT2 组(转染pc3.1-GACAT2重组质粒)。
1.7 RT-qPCR 法检测2 组A549 和H1299 细胞中GACAT2 mRNA 表达水平 分别收集“1.6”中空载体组和pc3.1-GACAT2 组细胞,按照“1.2”中步骤提取细胞中总RNA,然后按照逆转录试剂盒说明书将总RNA 逆转录成cDNA,采用RT-qPCR法检测A549 和H1299 细胞中GACAT2 mRNA 表达水平,以GAPDH 作为内参基因。PCR 法反应条件:95 ℃、10 s; 95 ℃、5 s,57 ℃、 30 s,38 个循环。引 物 序 列: GACAT2 上 游 引 物5'-TTATCCTGAACCGCCACGC-3', GACAT2下游引物5'-TCCAGACAGCAGGAGGAAATG-3';GAPDH 上 游 引 物5'-CTCCTCCTGTTCGACAGTCAGC-3', GAPDH 下 游 引 物5'-CCCAATACGACCAAATCCGTT-3'。根据标准曲线和荧光曲线的Ct 值,采用2-ΔΔCt法计算A549 和H1299 细胞中GACAT2 mRNA 表达水平。
1.8 CCK-8 法检测2 组细胞增殖活性将空载体组 和pc3.1-GACAT2 组 细 胞(A549 和H1299 细胞)采用胰酶消化后进行细胞计数, 按照每孔3 000 个细胞的密度接种于96 孔细胞培养板中,每组设6 个平行复孔。采用CCK-8 法分别检测细胞在12、24、36 和48 h 时的增殖活性。采用酶标仪在450 nm 处测定各孔的吸光度(A)值,以仅加入培养液的空白孔为对照孔调零。以A 值代表各组细胞的增殖活性。
1.9 细胞克隆形成实验检测各组细胞克隆形成数将空载体组和pc3.1-GACAT2 组A549 或H1299 细胞经胰酶消化后重悬,按照每孔700 个细胞接种于6 孔细胞培养板,每组设3 个复孔,培养10 d 后取出弃掉培养基,采用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后,以多聚甲醛固定15 min,PBS 缓冲液洗涤2 次然后采用结晶紫染色20 min,吸掉结晶紫溶液,最后采用流动的清水洗掉结晶紫后晾干,采用凝胶成像系统Coomassie Blue 应用程序对培养板进行拍照。采用Image J 软件统计细胞克隆形成数。
1.10 干细胞成球实验观察2 组细胞成球数配制干细胞成球培养基,不含血清的DMEM (高糖)培养基中添加2% 50× B27、EGF 和bFGF,其中EGF 和bFGF 的终浓度均为20 μg·L-1,将空载体组和pc3.1-GACAT2 组A549 及H1299 细胞经胰酶消化后悬浮在干细胞成球培养基中,并接种于低黏附性的12 孔细胞培养板中,每孔接种1 000 个细胞,每隔3 d 按照半量换液法更换新鲜培养基,培养10 d 后观察细胞成球情况并拍照,统计直径>75 μm 的细胞球数。
1.11 统计学分析采用Graphpad Prism 6.0 统计软件进行统计学分析。2 组细胞中GACAT2 RNA表达水平、克隆形成数和细胞成球数以±s表示,2 组间样本均数比较采用两独立样本t检验;不同时间点细胞中GACAT2 RNA 表达水平、细胞克隆形成数和细胞成球数比较采用双因素方差分析,组间两两比较采用Turkey 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 GACAT2 基因扩增和真核表达载体酶切鉴定琼脂糖凝胶电泳结果显示:扩增得到长度为835 bp 的GACAT2 特异基因片段。真核表达载体pc3.1 经双酶切后产生1 个长度为5 400 bp 片段。将GACAT2 目的基因与pc3.1 酶切产物进行切胶回收后,进行连接转化,涂布Amp 平板,挑取单菌落进行扩增后,行PCR 法鉴定,选择GACAT2 扩增阳性的单克隆菌液送至生工生物工程(上海)股份有限公司进行测序分析,通过测序并与GenBank 中序列进行比对,确定重组质粒pc3.1 中插入了GACAT2 完整开放阅读框(open reading frame,ORF)基因片段。见图1。
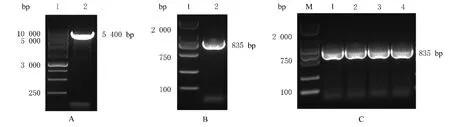
图1 pc3.1 酶切产物、GACAT2 基因PCR 产物和菌落PCR 法鉴定电泳图Fig.1 Electrophoregrams of enzyme digested products of pc3.1, PCR products of GACAT2 gene,and colony PCR identification
2.2 2 组A549 和H1299 细 胞中GACAT2 mRNA表达水平pc3.1-GACAT2 组 A549 细 胞 中GACAT2 mRNA 表达水平(8.12±0.23)明显高于空载体组(1.00±0.04)(t=30.98,P<0.01)。pc3.1-GACAT2 组H1299 细胞中GACAT2 mRNA表达水平(4.60±0.06) 明显高于空载体组(1.00±0.06)(t=44.57,P<0.01)。
2.3 2 组A549 和H1299 细胞增殖活性与空载体组比较,72 和96 h 时pc3.1-GACAT2 组A549 细胞增殖活性明显低于空载体组(P<0.01)。与空载体 组 比 较, 48、72 和96h 时pc3.1-GACAT2 组H1299 细胞增殖活性降低(P<0.01)。见图2 。

图2 CCK-8 法检测不同时间点2 组A549 细胞(A)和H1299 细 胞(B)增 殖 活 性Fig.2 Proliferation activities of A549 and H1299 cells in two groups detected by CCK-8 assay at different time points
2.4 2 组A549 和H1299 细胞克隆形成数与空载体组(40.00 个±1.00 个)比较,pc3.1-GACAT2组A549 细胞克隆较小,克隆形成数(21.00 个±3.22 个)减少(t=5.644,P<0.01);与空载体组(91.00 个±7.55 个) 比 较,pc3.1-GACAT2 组H1299 细胞克隆较小,克隆形成数(57.67 个±5.67 个)减少(t=3.024,P<0.05)。2 组细胞克隆形成情况见图3。
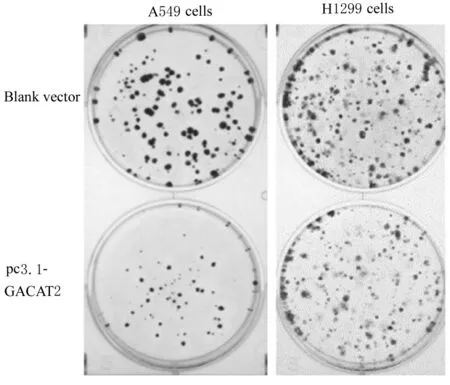
图3 2 组A549 和H1299 细胞克隆形成情况Fig.3 Clone formation numbers of A549 and H1299 cells in two groups
2.5 各组A549 和H1299 细胞成球数与空载体组(9.67 个±1.20 个) 比 较, pc3.1-GACAT2 组A549 细胞成球能力降低,球体偏小,成球数(20.67 个±1.33 个)减少(t=6.128,P<0.01);与空载体组(5.00 个±0.58 个) 比较,pc3.1-GACAT2 组H1299 细胞成球能力降低,球体偏小,成球数(7.67 个±0.67 个)减少(t=3.024,P<0.05)。2 组细胞成球情况见图4。

图4 显微镜观察2 组A549 和H1299 细胞成球情况(×100)Fig.4 Sphere formations of A549 and H1299 cells in two groups observed under microscope(×100)
3 讨 论
目前有关lncRNA-GACAT2 基因相关研究较少,其在肿瘤中的具体作用机制目前尚不清楚。相关研究[15-16]显示:GACAT2 基因在胃癌组织和胃癌相关细胞系中呈低表达,该基因表达下调与肿瘤远处转移、静脉侵犯和神经周围侵犯有关。有研究[17]显示:胃癌患者血清中GACAT2 基因呈高表达,手术后患者血清中GACAT2 mRNA 表达水平与淋巴转移、远端转移和神经周围侵犯呈正相关关系。最新的研究[18]显示:GACAT2 是线粒体功能的关键调节因子,可以在炎症环境中调节牙周膜干细胞的线粒体功能和牙骨质形成。
本研究首先构建了lncRNA-GACAT2 真核过表达载体,建立了GACAT2 稳定过表达的肺癌A549 和H1299 细胞,CCK-8 实验检测结果显示:GACAT2 过表达抑制A549 和H1299 细胞的增殖能力;克隆形成实验是评价肿瘤细胞独立生存能力的一种实验方法,形成克隆的细胞是贴壁且有增殖活性的细胞,克隆形成数和大小可以反映肿瘤细胞群体依赖性和增殖能力,因拍照仪器不支持彩色成像,本实验获取的克隆形成图片为黑白色。本研究结果显示:过表达GACAT2 基因可以增强细胞在增殖过程中的群体依赖性,抑制肿瘤细胞的增殖。
肿瘤干细胞(cancer stem cells,CSCs) 又称肿瘤起始细胞(tumor initiating cells,TICs),具有维持肿瘤生长的作用,是类似于胚胎干细胞特性的细胞亚群。目前研究对CSCs 的生物学特性有如下共识:①具有自我更新、无限增殖和多向分化能力;②表达某些表面标志性蛋白或具有特异的酶活性;③具有高度致瘤性;④具有高转移潜能;⑤对多种药物高度耐受。因此,CSCs 被认为是临床肿瘤转移、复发和放化疗失败的主要原因[19]。靶向清除CSCs 已成为当今癌症治疗的重要策略和最前沿方向[20]。研究[21-23]显示:lncRNAs 在调节CSCs的生物学行为中起重要作用。有研究[24]显示:lncRNA-DGCR5 在NSCLC CSCs 中呈高表达,敲低DGCR5 后抑制干细胞转录因子Sox2、Nanog 和Oct4 表达,DGCR5 可以吸附微小RNA-330-5p(microRNA-330-5p,miR-330-5p),上调其靶基因CD44 的 表 达,从 而 调 节CSCs 的 干 性[24]。肿 瘤 细胞的成球实验是衡量肿瘤细胞干性的金标准。本研究结果显示:GACAT2 基因过表达后,A549 和H1299 细胞成球能力明显降低,表明GACAT2 可以显著抑制肿瘤细胞的干性,但其具体作用机制还需深入研究。
综上所述,GACAT2 基因作为一种抑癌基因,在肺癌中发挥重要作用,但其具体作用机制尚不清楚,本研究结果为进一步探讨lncRNA-GACAT2调控肺癌发生发展机制和靶向治疗提供了依据。

