Sirtuins 蛋白在双酚A 诱导的雄性生殖系统损伤模型小鼠睾丸组织和GC-2 细胞中的表达及其意义
符 璐, 叶严珏, 李江英, 汤子怡, 尹 俐
(重庆理工大学药学与生物工程学院生物制药系,重庆 400054)
双酚A(bisphenol A,BPA)在工业上被用来合成聚碳酸酯(polycarbonate,PC)和环氧树脂等材料,被广泛用于制造食品饮料包装及医疗器械等日常用品。作为人类接触范围最广的化学品之一,约90%以上人群的尿液中有BPA 存在[1]。流行病学研究和实验研究结果[2-3]显示:BPA 暴露对雄性生物生殖系统有不良影响,如精子形态异常、精子数量减少、精子活力降低和生精异常等。因此,探讨BPA 致雄性生殖毒性的相关机制对防治BPA 致雄性生殖系统损伤有重要意义。Sirtuins(Sirt)蛋白家族包含Sirt1~Sirt7 共7 个成员,是一组烟酰胺腺 嘌 呤 二 核 苷 酸 (nicotinamide adenine dinucleotide,NAD )依赖性的组蛋白去乙酰化酶。Sirt 家族成员通过作用于各种蛋白质的翻译后修饰而直接或间接参与糖脂代谢、氧化应激、DNA 修复和炎性反应等病理生理过程[4-6]。其中,Sirt1 参与雄性生殖器官发育、精子形成和精子质量的调控过程[7]。Sirt3 与异常的精子形态和精子运动能力有关[8-9]。然而,有关Sirt1~Sirt7 对BPA 致雄性生殖毒性中的研究目前国内外尚未见相关报道。本研究旨在探讨 Sirt1~Sirt7 在BPA 诱导的雄性生殖损伤中的作用,为BPA 致雄性生殖毒性的防治提供依据。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器40 只SPF级雄性昆明种小鼠,8 周龄,体质量 28~32 g,购自北京华阜康生物科技股份有限公司,动物使用许可证号:SYXK (渝)-2017-0010。动物饲养在22 ℃恒温动物室中,光照与黑暗间隔周期为12 h,食物和水均可自由获得。小鼠精母细胞(GC-2 细胞)购自美国ATCC 细胞库。Sirt1 抗体(产品批号:sc-74465)、Sirt2 抗体(产品批号:sc-28298)、Sirt3 抗体(产品批号:sc-365175)、Sirt4 抗体(产品批号:sc-135797)、Sirt5 抗体(产品批号:sc-271635)、Sirt6 抗体(产品批号:sc-517196) 和Sirt7 抗体(产品批号:sc-365344)购自美国Santa Cruz 公司,β-actin 抗体(货号66009-1-Ig) 购自美国Proteintech 公司,辣根过氧化物酶(horseradish peroxidase, HRP) 标记的山羊抗小鼠(货号A0216)二抗购自上海碧云天生物技术有限公司,BPA 和玉米油均购自美国Sigma 公司,EdU 试剂盒购自广州锐博生物科技有限公司。计算机辅助精液分析(computer assisted sperm analysis,CASA)系统购自西班牙Microptic 公司,Fusion FX 化学发光凝胶成像系统购自法国Vilber 公司,C6 流式细胞仪购自美国BD 公司。
1.2 实验动物分组和给药40 只SPF 级雄性昆明种小鼠随机分为对照组、低剂量BPA 组(给予3 mg·kg-1·d-1BPA)、中 剂 量BPA 组 (给 予30 mg·kg-1·d-1BPA) 和 高 剂 量BPA 组(给 予300 mg·kg-1·d-1BPA),每组10 只。低、中和高剂量BPA 组小鼠采用玉米油(0.01 mL·g-1)配成相应浓度BPA 灌胃,对照组小鼠给予0.01 mL·g-1玉米油。
1.3 检测各组小鼠体质量并计算睾丸指数和附睾指数给药35 d 后称各组小鼠体质量,处死小鼠,收集睾丸和附睾并分别称质量。睾丸指数=睾丸质量/体质量×100%,附睾指数=附睾质量/体质量×100%。
1.4 CASA 系统分析各组小鼠精子质量小鼠处死后,迅速分离双侧附睾,并用眼科剪剪开附睾尾部后放入37 ℃预热的输卵管液中,并采用镊子晃动促使附睾中的精子游离到输卵管液中形成精子悬液。采用移液枪吸取10 μL 精子悬液,通过CASA系统分析小鼠精子活力(包括快速前向运动精子百分率、中速前向运动精子百分率、慢速前向运动精子百分率和不动精子百分率)及精子畸形率。
1.5 HE 染色观察各组小鼠睾丸组织病理形态表现将各组小鼠睾丸组织置于4% 多聚甲醛固定1 周后,经过不同浓度乙醇溶液梯度脱水再置入二甲苯中透明后再置入55 ℃石蜡包埋。将包埋好的组织块用切片机进行切片,60 ℃烘干后保存。根据HE 染色试剂盒操作流程进行HE 染色,染色结束后加入树胶采用盖玻片封片,采用显微镜观察各组小鼠睾丸组织形态表现。
1.6 各组小鼠GC-2 细胞培养和分组小鼠GC-2细胞采用含10%胎牛血清的DMEM 高糖培养基培养,置于37 ℃、5% CO2培养箱中培养,细胞生长至对数生长期进行传代。传代后本研究分别采用0、20、40 和80 μmol·L-1BPA 处 理 细 胞,作 用48 h 后收集细胞进行下一步操作。
1.7 EdU 荧光染色法检测小鼠GC-2 细胞增殖率
取对数生长期GC-2 细胞,以每孔2.0×105个细胞的密度接种至12 孔细胞培养板中,分为0、20、40 和80 μmol·L-1BPA 组,每组3 个复孔,置于培养箱中培养48 h。取出12 孔细胞培养板,去除细胞培养液,加入500 μL 提 前 配 制 好 的 含50 μmol·L-1EdU 的培养基共孵育2 h。4%多聚甲醛固定30 min,0.5% Triton X-100 通透10 min,避光加入100 μL Apollo 染色反应液,最后采用Hoechst 进行细胞核染色。染色完成后,立即在荧光显微镜下分析并拍照。其中蓝色荧光为Hoechst标记的细胞核,代表所有细胞;红色荧光为EdU标记的新增殖细胞,随机选取3 个视野,计数红色和蓝色荧光标记的细胞数,计算细胞增殖率。细胞增殖率=红色荧光标记的细胞个数/蓝色荧光标记的细胞个数×100%。
1.8 流式细胞术检测各组小鼠不同细胞周期GC-2细胞百分率采用胰酶消化收集细胞,1 000 g 离心5 min,沉淀细胞,去除上清,加入1 mL PBS 缓冲液重悬细胞,再次离心沉淀细胞,小心吸除上清。加入1 mL 预冷的70%乙醇,轻轻吹打混匀,4 ℃固定2 h,1 000 g 离心5 min,沉淀细胞,小心吸除上清,加入1 mL 预冷的PBS 缓冲液,重悬细胞,再次离心沉淀细胞,小心吸除上清。每管细胞样品中加入0.5 mL 碘化丙啶(propidium iodide,PI)染色液,缓慢并充分重悬细胞沉淀,37 ℃避光孵育30 min。孵育完成后,采用流式细胞术进行检测。采用Flowjo 软件分析并拟合细胞周期图,流式检测结果图的第1 个峰代表G0/G1期,第2 个峰较宽,代表S 期,第3 个峰代表G2/M 期。
1.9 流式细胞术检测各组小鼠GC-2 细胞凋亡率
按上述步骤处理细胞后,采用不含EDTA 的胰 酶 消 化 细 胞,于 室 温2 000 r·min-1离 心5 min,收集细胞。采用预冷的PBS 缓冲液重悬细胞,2 000 r·min-1离心5 min,弃上清。加入300 μL 1×Binding Buffer 悬浮细胞,再加入5 μL Annexin Ⅴ-FITC 混匀后,室温避光孵育15 min,最后在上机前5 min 再 加 入5 μL PI 染 色,并 补 加200 μL 1×Binding Buffer。染色完成后,采用流式细胞术进行检测。采用Flowjo 软件进行分析,绘制散点图,FITC 为横坐标,PI 为纵坐标。左上象限(Q1)为细胞碎片或死亡细胞,左下象限(Q2)为正常活细胞,右上象限(Q3)为晚期凋亡细胞,右下象限(Q4)为早期凋亡细胞。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.10 Western blotting 法检测各组小鼠睾丸组织和GC-2 细胞中Sirt 家族蛋白表达水平选取各组小鼠睾丸组织和GC-2 细胞加入放射免疫沉淀法(radioimmunoprecipitation assay,RIPA) 裂解液,采用低温匀浆机匀浆,4 ℃裂解60 min 后,于4 ℃、12 000 r·min-1离心10 min,吸取上清, 采用BCA法检测蛋白浓度。进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate -polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳,于冰水中电转至PVDF 膜上,采用5%脱脂奶粉液室温封闭1 h,分别加入Sirt1~Sirt7 和β-actin 抗体,4 ℃ 孵育过夜。采用TBST 洗膜3 次,每次10 min,再加入二抗室温孵育1 h,TBST 洗膜后,ECL 显色,于成像系统上显影。采用Image J 软件分析目的蛋白的灰度值,计算目的蛋白表达水平。Sirt1~Sirt7 蛋白表达水平= Sirt1~Sirt7 蛋白条带灰度值/β-actin 条带灰度值。
1.11 统计学分析采用SPSS 16.0 统计软件进行统计学分析。各组小鼠平均体质量、睾丸指数、附睾指数、快速前向运动精子百分率、中速前向运动精子百分率、慢速前向运动精子百分率、不动精子百分率、精子畸形率和细胞凋亡率均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠体质量、睾丸指数和附睾指数BPA染毒5 周的过程中,各组小鼠行为活动、粪便性状和外观体征未见显著异常。BPA 染毒5 周后,与对照组比较,各剂量BPA 组小鼠体质量和附睾指数差异无统计学意义(P>0.05),高剂量BPA 组小鼠睾丸指数降低(P<0.05)。见表1。
表1 各组小鼠体质量、睾丸指数和附睾指数Tab.1 Body weights,testis indexes,and epididymal indexes of mice in various groups (n=10±s)
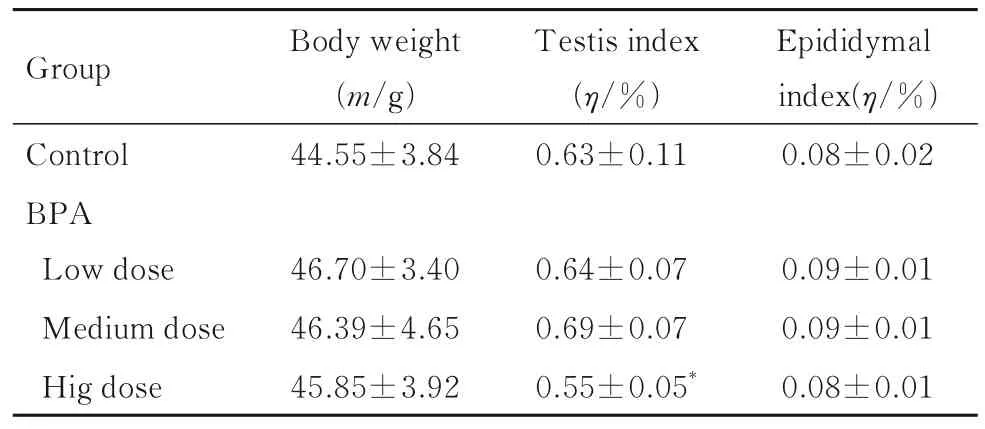
表1 各组小鼠体质量、睾丸指数和附睾指数Tab.1 Body weights,testis indexes,and epididymal indexes of mice in various groups (n=10±s)
*P<0.05 vs control group.
Group Control BPA Body weight(m/g)44.55±3.84 Testis index(η/%)0.63±0.11 Epididymal index(η/%)0.08±0.02 Low dose Medium dose Hig dose 0.09±0.01 0.09±0.01 0.08±0.01 46.70±3.40 46.39±4.65 45.85±3.92 0.64±0.07 0.69±0.07 0.55±0.05*
2.2 各组小鼠精子活力和精子畸形率CASA 系统分析结果显示:与对照组比较,中和高剂量BPA 组小鼠不动精子百分率升高(P<0.01),快速前向运动精子百分率降低(P<0.01),中速前向运动精子百分率降低(P<0.05),高剂量BPA 组小鼠精子畸形率升高(P<0.01)。见表2。
表2 各组小鼠精子活力和精子畸形率Tab.2 Motilities and deformity rates of sperm of mice in various groups (n=10,±s,η/%)

表2 各组小鼠精子活力和精子畸形率Tab.2 Motilities and deformity rates of sperm of mice in various groups (n=10,±s,η/%)
*P<0.05,**P<0.01 vs control group.
Group Control BPA Percentage of rapid progressive sperm 45.48±4.87 Percentage of medium progressive sperm 23.41±2.17 Percentage of nonprogressive sperm 11.67±1.70 Percentage of immobile sperm 19.40±1.85 Deformity rate of sperm 18.00±2.80 Low dose Medium dose High dose 19.80±5.30 23.00±3.70 57.00±17.00**40.08±6.25 28.08±2.44*20.40±2.85**19.43±5.86 15.54±1.93*10.60±3.47*14.56±1.40 15.96±2.38*13.68±1.34 25.93±6.04 40.36±1.97**52.28±6.75**
2.3 各组小鼠睾丸组织病理形态表现对照组小鼠睾丸组织内曲细精管结构正常,生精小管排列整齐,内部生精细胞紧密排列层次分明。各剂量BPA 组小鼠睾丸组织均呈现出不同程度病理异常。低剂量BPA 组小鼠睾丸组织中出现少量曲细精管基底膜处出现空泡,生精细胞减少;中剂量BPA组小鼠曲细精管内各级生精细胞减少排列疏松;高剂量BPA 组小鼠睾丸组织内各级生精细胞显著减少,部分生精细胞缺失,生精细胞排列疏松紊乱,且管腔中心精子数目减少。见图1。
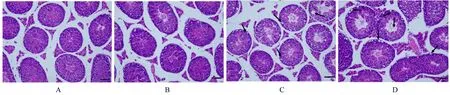
图1 各组小鼠睾丸组织形态表现(HE,Bar= 20 μm)Fig.1 Morphology of testis tissue of mice in various groups (HE,Bar= 20 μm)
2.4 各组小鼠睾丸组织中Sirt 家族蛋白表达水平与对照组比较,低剂量BPA 组小鼠睾丸组织中 Sirt6 蛋白表达水平降低(P<0.01),中剂量BPA 组小鼠睾丸组织中Sirt1、Sirt2 和Sirt6 蛋白表达水平降低(P<0.01),高剂量BPA 组小鼠睾丸组 织 中Sirt1、Sirt2、Sirt3、Sirt4、Sirt5、Sirt6 和Sirt7 蛋白表达水平降低(P<0.05 或P<0.01)。见图2。
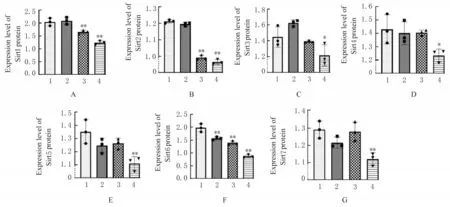
图2 各组小鼠睾丸组织中Sirt1~Sirt7 蛋白表达水平Fig.2 Expression levels of Sirt1-Sirt7 proteins in testis tissue of mice in various groups
2.5 各组小鼠GC-2 细胞增殖率EdU 荧光染色法检测结果显示:20、40 和80 μmol·L-1BPA 处理48 h 后,新生细胞数降低(图3)。与0 μmol·L-1BPA 组 比 较,20、40 和80 μmol·L-1BPA 组 细 胞增殖率降低(P<0.01)(图4)。

图3 各组小鼠GC-2 细胞增殖情况(EdU 荧光染色,×200)Fig.3 Proliferation of GC-2 cells of mice in various groups(EdU fluorescence staining,×200)

图4 各组小鼠GC-2 细胞增殖率Fig.4 Proliferation rates of GC-2 cells of mice in various groups
2.6 各组小鼠不同细胞周期GC-2 细胞百分率作用24 h 后,与0 μmol·L-1BPA 组 比 较,40 和80 μmol·L-1BPA 组S 期及G2/M 期细胞百分率升高(P<0.01);处理48 h 后,与0 μmol·L-1BPA组比较,40 和80 μmol·L-1BPA 组G2/M 期细胞百分率升高(P<0.01)。见图5 和6。

图5 流式细胞术检测各组小鼠GC-2 细胞的细胞周期Fig.5 Cell cycles of GC-2 cells of mice in various groups detected by flow cytometry

图6 各组小鼠不同细胞周期GC-2 细胞百分率Fig.6 Percentages of GC-2 cells at different cell cycles of mice in various groups
2.7 各组小鼠GC-2 细胞凋亡率作用24 h 后,0 μmol·L-1BPA 组GC-2 细胞 凋亡率为(3.65 ±0.78)%,20、40 和80 μmol·L-1BPA 组细胞凋亡率分别为 (3.96±0.29)%、(6.62±0.45)%及(8.96±0.37) % 。 作 用48 h 后, 20、 40 和80 μmol·L-1BPA 组GC-2 细 胞 凋 亡 率 分 别 为(7.71±0.63)%、(11.78±0.46)%及(17.70±0.63)%,均 高 于0 μmol·L-1BPA 组(3.53%±0.81%)(P<0.01)。见图7。

图7 流式细胞术检测各组GC-2 细胞凋亡率Fig.7 Apoptotic rates of GC-2 cells of mice in various groups detected by flow cytometry
2.8 各组小鼠GC-2 细胞中Sirt 家族蛋白表达水平作 用24 h 后,与0 μmol·L-1BPA 组 比 较,20 μmol·L-1BPA 组小鼠GC-2 细胞中Sirt4 和 Sirt7蛋白 表 达 水 平 降 低 (P<0.05 或P<0.01),80 μmol·L-1BPA 组小鼠GC-2 细胞中Sirt4 和Sirt7蛋白表达水平降低(P<0.05 或P<0.01)。作用48 h 后,与0 μmol·L-1BPA 组比较,20 μmol·L-1BPA 组 小 鼠GC-2 细 胞 中Sirt2、 Sirt3、Sirt4 和Sirt6 蛋白表达水平降低(P<0.05 或P<0.01),40 μmol·L-1BPA 组小鼠GC-2 细胞中Sirt1、Sirt2、Sirt3、Sirt4 和Sirt6 蛋白表达水平降低(P<0.05或P<0.01),80 μmol·L-1BPA 组小鼠GC-2 细胞中Sirt1、 Sirt2、Sirt3、Sirt4、Sirt 5 和Sirt6 蛋白表达水平降低(P<0.05 或P<0.01)。见图8。

图8 各组小鼠GC-2 细胞中Sirt1~Sirt7 蛋白表达水平Fig.8 Expressions levels of Sirt1-Sirt7 proteins in GC-2 cells of mice in various groups
3 讨 论
作为一种广泛存在于日常用品中的环境内分泌干扰物, BPA 对雄性生殖系统的毒性(睾丸发育异常、精子质量降低和各级生精细胞损伤等)在人群及动物研究中得到证实[2,10-12]。本研究结果显示:染毒5 周,与对照组比较,各剂量BPA 组小鼠睾丸指数和附睾指数降低,精子畸形率升高,不动精子百分率升高,前向运动精子百分率降低,小鼠睾丸组织中曲细精管排列紊乱,各级生精细胞减少。本实验结果进一步证实了BPA 具有降低精子质量,影响各级生精细胞发育等雄性生殖毒性。
研究[13-16]显示:BPA 的生殖毒性与氧化应激、内质网应激、线粒体损伤、DNA 损伤和DNA 甲基化等有密切关联,但有关BPA 的生殖毒性作用机制仍有待进一步完善。在哺乳动物中,Sirt 家族包括7 个成员(Sirt1~Sirt7),其均有1 个保守的NAD 结合催化结构域,这对活性至关重要。Sirt 家族在细胞稳态、能量代谢、细胞凋亡和年龄相关疾病的发病中发挥重要作用[17-18],但其在BPA 致雄性生殖损伤中的作用尚不清楚。
Sirt1 是Sirt 家族中被广泛研究的成员。Sirt1 缺失的雄性小鼠表现出雄性生殖器官小、各级生精细胞缺失、精子畸形率升高、精母细胞和精子细胞凋亡率增加和精子数降低且无活力[7]。本研究结果显示:BPA 染毒小鼠睾丸组织中Sirt1 表达水平降低,睾丸指数降低,各级生精细胞缺失,精子质量降低,与Sirt1 在雄性生殖系统中的作用一致。小鼠精母细胞GC-2 细胞实验显示:BPA 处理后,精母细胞增殖受到抑制,细胞凋亡率升高,表明BPA可能通过下调Sirt1 表达进而影响雄性生殖系统功能。
Sirt3 表达水平与异常的精子形态和运动性有关[8-9]。WANG 等[19]发现:镉暴露会导致大鼠睾丸形态受损,曲细精管内生殖细胞丢失和空泡化。Sirt3 激活剂可挽救Cd 诱导的睾丸形态损伤,而Sirt3 抑制剂则加剧镉的影响。本研究结果显示:BPA 作用后,小鼠GC-2 细胞中Sirt3 蛋白表达水平降低,提示BPA 染毒造成了小鼠睾丸、各级生精细胞受损和小鼠GC-2 细胞损伤。Sirt3 可能在BPA致雄性生殖毒性中发挥重要作用。
目 前 关 于Sirt2、Sirt4、Sirt5、Sirt6 和Sirt7 在雄性生殖系统的作用还有待进一步完善[17,20]。研究[21-22]显示:Sirt2 可能通过对α-微管蛋白乙酰化的调控而影响精子鞭毛微管的活力,但其在男性生育能力中的作用尚未明确。在LPS 处理的睾丸支持细胞中,过表达Sirt4 可抑制B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2) 和Bcl-2 相 关X 蛋 白(Bcl-2 associated X protein,Bax)易位,降低细胞色素c 和含半胱氨酸的天冬氨酸酶3 (apoptosisrelated cysteine peptiduse 3,caspase 3)的表达,从而 提 升LPS 引 起 的 细 胞 活 力 降 低[23]。Sirt5 可 能 在精子发生过程中发挥作用[24]。研究[25]显示:高脂喂养雄性C57BL6 小鼠16 周后,DNA 受损的精子百分率升高,定位在晚期圆形精子细胞向早期细长精子细胞过渡的细胞核中的Sirt6 mRNA 和蛋白表达水平降低。Sirt7 缺失导致DNA 损伤和DNA 复制应激增加,且Sirt7-/-胚胎成活率低[26],提示Sirt2、Sirt4、Sirt5、Sirt6 和Sirt7 可能在男性生殖中起重要作用,但还需要进一步研究来阐明其作用机制。本研究结果显示:在BPA 染毒的小鼠动物模 型 和GC-2 细 胞 中Sirt2、Sirt4、Sirt5、Sirt6 及Sirt7 蛋白表达水平均降低,提示Sirt2、Sirt4、Sirt5、Sirt6 和Sirt7 可能是BPA 致雄性生殖毒性的作用靶点。
综上所述,Sirt1~Sirt7 蛋白表达水平下调可加重BPA 诱导的雄性生殖损伤,提示Sirt1~ Sirt7 可作为BPA 致雄性生殖毒性的防治靶点。但Sirt 家族在BPA 致雄性生殖毒性中作用机制还需进一步研究。

