肝硬化上消化道出血患者预后营养指数与病情严重程度和短期预后相关性研究
杨金艳,李飞飞,谢元元,穆亚娟,韩瑞瑞,王 蒙,高晓霞
(榆林市第一医院,陕西 榆林 719000)
肝硬化是由多种病因(乙型肝炎最常见,其次为酒精性)所致的进展性、慢性肝脏弥漫性损害与纤维结缔组织增生,肝硬化早期由于肝功能尚处于代偿阶段可无明显临床症状,而后期则以门静脉高压与肝功能受损为其主要特征[1]。上消化道出血属于本病常见的严重并发症(发生率约为15%~33%),是引起患者急诊入院及死亡的主要原因之一[2]。为降低病死率,需要临床医师对病情严重程度及预后情况给出快速准确的判断,既往临床常用终末期肝病模型(MELD)评分、肝功能CTP(Child-Turcotte-Pugh)评分等工具对患者预后进行评估,然而此类评估手段存在一定局限性,如两种评估系统包含了多项内容(前者4项,后者5项),评估起来较为复杂繁琐。其次,此两种评估系统易受治疗因素与主观性的影响,且变量值检测结果缺乏稳定性[3]。因此,临床迫切需要寻找一种简单便捷、客观性好、操作性强、准确有效的评估手段来判断评估患者病情与预后。预后营养指数(Prognostic Nutritional Index,PNI)是近些年临床研究的一个热点,是一种基于免疫系统与营养状况的评估工具。有研究表明,PNI已经应用在心脑血管疾病[4]、骨科疾病[5]、恶性肿瘤[6]的病情评估与预后当中,对临床区分与筛选高危患者具有重要价值。然而其在肝硬化上消化道出血中的应用则鲜有报道。鉴于此,本研究探讨肝硬化上消化道出血患者PNI与病情严重程度和短期预后的相关性,为临床评估此类患者病情预后提供参考。
1 资料与方法
1.1 一般资料 选择2020年12月至2023年3月我院收治的肝硬化上消化道出血患者159例为研究对象,病例纳入标准:①年龄>18岁,且肝硬化诊断符合《肝硬化诊治指南》[7]相关标准,且经过相关病理学或影像学检查所证实。②患者因胃底食管静脉曲张破裂所致的上消化道出血为首诊主诉,患者症状有黑便、呕血、大便隐血试验(+),且经过胃镜证实。排除标准:合并血液系统疾病(如自身免疫性溶血性贫血、血液系统肿瘤、巨幼红细胞性贫血等)者,伴有恶性肿瘤、急性心脑血管疾病者,严重的感染性疾病,严重心、肾功能障碍者,近期服用过影响凝血功能药物者,相关资料缺失而影响分析者。纳入的159例患者,男102例,女57例,年龄34~76岁,平均(57.15±8.56)岁。纳入的患者或家属均签署知情同意书,并经过医院伦理委员会批准。
1.2 研究方法
1.2.1 一般资料的收集:收集患者入院时的一般资料,包括年龄、性别、体重指数(BMI)、肝硬化病程、平均动脉压、肝硬化病因、肝功能Child-Pugh分级(按照肝功能受损严重程度分为3个等级分别为A级、B级和C级,其中C级最为严重)[7]、上消化道出血严重程度(分为3个等级[8],即轻度出血:失血量<500 ml,且心率、血压与血红蛋白含量基本正常,仅有头晕症状;中度出血:失血量为500~1000 ml,心率>100 次/min,血压降低,血红蛋白含量在70~100 g/L,并伴有口渴、晕厥等症状;重度出血:失血量>1000 ml,心率>120 次/min,收缩压<80 mmHg,血红蛋白含量<70 g/L,并伴有意识模糊,四肢发冷等症状)。入院后的血液学实验室检查指标包括C反应蛋白、红细胞计数、血红蛋白、血小板计数、纤维蛋白原、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)、国际标准化比值(INR)、总胆红素、血肌酐。
1.2.2 PNI的定义:PNI是由日本学者小野寺提出,其计算公式PNI=血清白蛋白(g/L)+5×外周血淋巴细胞总数(×109/L)[9]。PNI分为3个等级,分别为PNI≥50分(营养状况正常)、PNI 为45~50分(轻度营养不良)和PNI<45分(中重度营养不良)。
1.2.3 分组方法:按照入院后30 d内的预后情况分为存活组(n=124例)和死亡组(n=35例),同时按照PNI分为PNI≥50分组,PNI 45~50分组和PNI<45分组。
2 结 果
2.1 死亡组和存活组患者一般资料及实验室指标、PNI比较 两组年龄、男性比例、BMI、病程、病因构成、血小板计数、PT、TT等比较差异无统计学意义(均P>0.05)。与存活组比较,死亡组平均动脉压、红细胞计数、血红蛋白水平偏低,肝功能Child-Pugh分级、上消化道出血严重程度较高,C反应蛋白、纤维蛋白原、APTT、INR、总胆红素、血肌酐水平偏高,两组比较差异均有统计学意义(均P<0.05)。死亡组PNI[(36.47±8.21)分]显著低于存活组[(42.31±7.44)分],两组比较差异有统计学意义(P<0.05)。见表1~4。

表1 两组患者一般资料比较

表2 两组患者肝功能分级、上消化道出血严重程度比较[例(%)]

表3 两组患者C反应蛋白、红细胞计数、血红蛋白、血小板计数、纤维蛋白原、PT水平比较

表4 两组患者APTT、TT、INR、总胆红素、血肌酐及PNI水平比较
2.2 不同PNI分组病情严重程度与预后情况比较 PNI≥50分组,PNI 45~50分组和PNI<45分组在肝功能Child-Pugh分级、上消化道出血严重程度、病死率比较差异具有统计学意义(均P<0.05)。其中PNI<45分组C级比例、病死率高于另外两组,而轻度出血比例低于另外两组;PNI 45~50分组C级比例、病死率高于PNI≥50分组,而轻度出血比例低于PNI≥50分组。见表5。

表5 不同PNI分组病情严重程度与预后情况比较[例(%)]
2.3 不同病情严重程度患者PNI比较 肝功能Child-Pugh分级、上消化道出血严重程度患者PNI比较差异均具有统计学意义(均P<0.05),从A级到C级患者PNI值逐渐降低,从轻度出血到重度出血患者PNI值亦逐渐降低,见表6。

表6 不同病情严重程度患者PNI比较(分)
2.4 PNI与病情严重程度指标相关性分析 Spearman秩相关分析显示,PNI与肝功能Child-Pugh分级、上消化道出血严重程度呈负相关(r=-0.432、-0.329,均P<0.05)。
2.5 PNI预测患者入院30 d内死亡的效能 以患者入院30 d内的预后作为终点绘制PNI预测的ROC曲线,其曲线下面积为0.776(95% CI:0.674~0.853,P<0.05),PNI最佳诊断截点值为40.16,敏感度为71.1%,特异度为73.6%,见图1。

图1 PNI预测患者入院30 d内死亡的ROC曲线
2.6 肝硬化上消化道出血患者入院后30 d内死亡的多因素Logistic回归方程分析 经过多因素Logistic回归分析显示,PNI<40.16是肝硬化上消化道出血患者入院30 d内死亡的独立危险因素(P<0.05)。见表7、8。
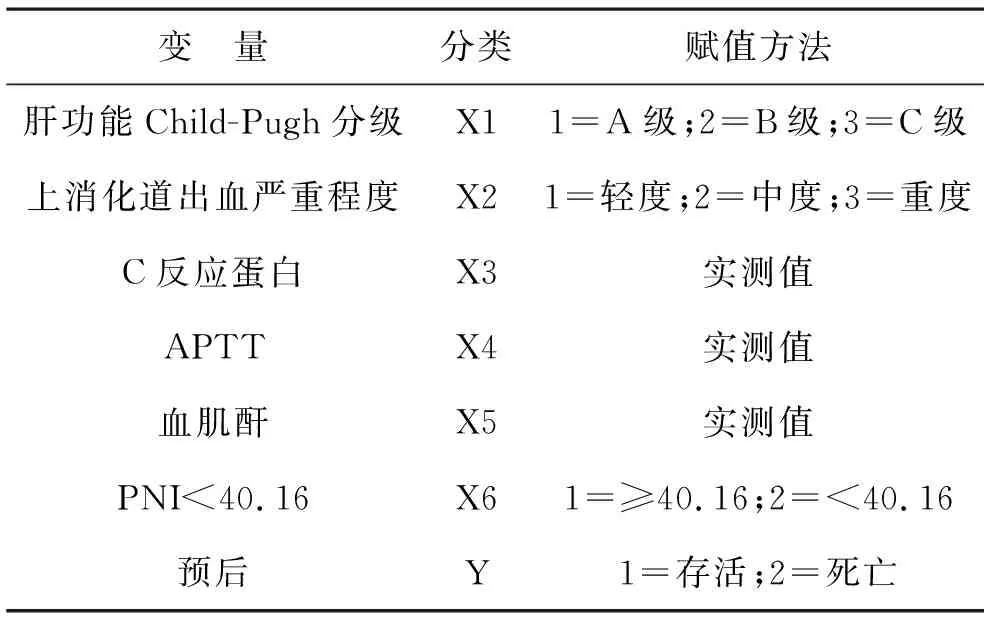
表7 Logistic回归方程中自变量的赋值方法
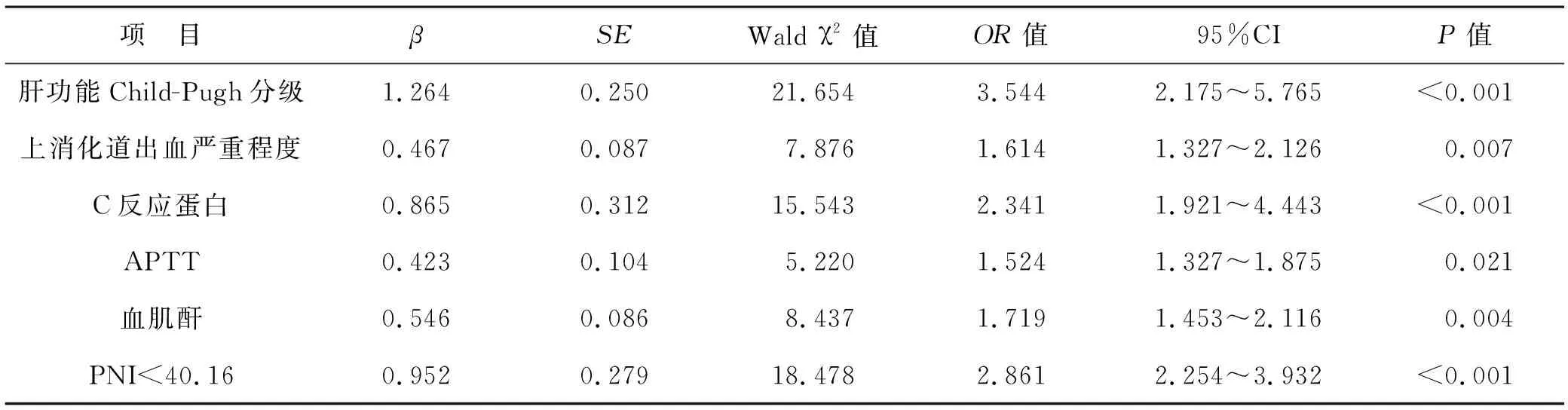
表8 肝硬化上消化道出血患者入院后30 d内死亡的多因素Logistic回归分析
3 讨 论
肝硬化上消化道出血是感染科和消化内科常见的疾病,具有较高的病死率,相关临床资料显示,虽然血管活性药物的普遍使用与内镜下止血技术得到了显著改进,肝硬化上消化道出血患者病死率有了极大的降低,但仍有14%~29%的患者未能挽救生命[10]。另有文献[11]报道显示,食管胃底静脉曲张破裂所致的出血是肝硬化患者发生上消化道出血的主要原因,约占72%,与非静脉曲张性出血患者比较,此类型出血患者入院后30 d内的病死率更高(30.5%与11.6%)。本研究纳入的159例肝硬化患者,出血均为食管胃底静脉曲张破裂所致,入院30 d内病死率为22.0%(35/159),与上述文献报道的基本一致。
虽然临床中对肝硬化上消化道出血患者病情及预后评估的手段有多种(如正文前言所述),但均存在主观性较强,评分细则复杂。PNI的计算方法颇为简单,计算项目仅包括外周血淋巴细胞计数与血清白蛋白,这两项均为临床常规血液学指标,易于获取,计算十分便捷,操作性强,且不受主观意识的影响,更具客观性。PNI综合了白蛋白与淋巴细胞计数两方面的信息,因此能够全面反映机体的营养状态、炎性反应与免疫状况[12-13]。李娟等[14]研究PNI对肝癌术后患者病情进展的预测价值时认为,PNI对肝癌术后病情进展具有较好的预测效能,其ROC曲线下面积为0.781,灵敏度与特异度分别为71.60%、72.84%。陈小彬等[15]将242例肝泡型包虫病患者按照PNI值的高低分为两组,其中高PNI组肝功能Child-Pugh分级,总胆红素与谷草转氨酶水平均优于低PNI组,高PNI组的3、5年生存率显著高于低PNI组,且低PNI是肝泡型包虫病患者死亡的独立危险因素。
本研究结果发现,死亡组PNI低于存活组,两组比较差异有统计学意义。同时将所有患者按照PNI水平分为三组,从PNI≥50分组到PNI<45分组,C级比例与病死率逐渐升高,而出血程度逐渐加重。A级到C级亦或轻度到重度出血患者PNI水平逐渐降低。Spearman秩相关分析显示PNI与肝功能Child-Pugh分级、上消化道出血严重程度呈负相关。上述结果提示了低PNI能够评估此类患者病情与预后。ROC曲线分析显示,PNI预测患者入院30 d内死亡曲线下面积为0.776,提示其具有较高预测效能,具有临床参考价值。PNI最佳诊断截点值为40.16,以此为截点进行的多因素Logistic回归模型分析显示,PNI<40.16是患者入院30 d内死亡的独立危险因素,因此,临床对于PNI<40.16的患者应当高度关注,此类患者应当被视为预后不良的高危群体。
PNI与肝硬化上消化道出血患者病情与预后关系的机制尚不明确,可能的原因为:①肝硬化患者营养不良状况较为明显,血清白蛋白是营养状况的标记物之一,低水平白蛋白与患者肝功能受损,预后不佳具有显著的相关性[16-17]。慢性持续性的炎性反应是肝脏纤维组织增生,肝细胞损害与肝脏血管重塑的重要因素[18-19]。长期的炎性反应不仅进一步加重肝功能损伤,导致营养物质合成障碍,还能进一步促进机体分解代谢,增加白蛋白消耗,而白蛋白含量降低则能进一步削弱机体对抗炎症与抗氧化的能力,不良预后的风险则随之增大。②淋巴细胞总数直接反映了机体细胞免疫功能,亦被认为是蛋白质-热量营养不良的临床指标[20]。肝硬化上消化道出血患者营养物质摄入不足,加之门脉高压以及胃肠道瘀血,导致机体免疫系统(特别是肠道内的免疫调节区)功能受损,体液或细胞介导的免疫力下降,导致淋巴细胞总数减低[21]。另外,肝硬化患者神经-体液分泌失衡,各类炎性细胞因子的激活等亦能够削弱细胞免疫功能,降低淋巴细胞计数[22]。
综上所述,PNI与肝硬化上消化道出血患者病情严重程度呈负相关,低水平PNI可能是此类患者短期死亡的独立危险因素,定期监测PNI有助于评估患者病情并筛选肝硬化上消化道出血不良预后的高危患者。

