栀子苷对部分膀胱出口梗阻模型大鼠膀胱功能障碍的改善作用及机制探讨
马威武,刘 强,李帅彪,苏志恒,臧洪学,邵敬会
(保定市第四中心医院泌尿外科,河北 保定 072350)
膀胱出口梗阻(Bladder outlet obstruction,BOO)是下尿路症状(Lower urinary tract symptoms,LUTS)的常见病因,其可以损害膀胱形态、结构和功能[1-2]。一般情况下,LUTS可以随着阻塞的缓解而缓解,但部分患者在梗阻缓解后仍会出现严重的膀胱功能障碍和难治性LUTS,这表明患者发生了继发于BOO的不可逆膀胱功能障碍,严重者还会出现肾小管和间质损伤,继而出现炎性细胞浸润和间质纤维化,最终损害肾功能[3]。然而,目前仍没有有效的方法治疗BOO继发引起的膀胱功能损害。研究[4-6]表明,炎性反应和氧化应激参与BOO的病理过程,施加在膀胱上的压力会导致过多促纤维化细胞外基质蛋白沉积在膀胱壁中,损害膀胱结构及功能,最终形成难治性膀胱功能障碍。核因子E2相关因子2 (Nrf2)介导的抗氧化应激和核因子κB (NF-κB)参与的炎性反应对维持细胞稳态具有重要作用,激活Nrf2抑制氧化应激和NF-κB信号传导可改善膀胱功能障碍[7]。故找到改善氧化损伤和(或)抑制炎性反应的药物可能是治疗BOO的策略之一。栀子苷(Geniposide,GE)是一种从栀子果实中提取的环烯醚萜苷,具有多种药理活性,包括抗氧化应激和抗炎作用[8]。在本研究中,我们发现GE可以显著逆转部分膀胱出口梗阻(partial bladder outlet obstruction,pBOO)模型大鼠膀胱组织低顺应性和提高膀胱肌张力,激活Nrf2提高抗氧化酶水平,抑制氧化损伤引起的膀胱炎症。本研究明确了口服GE可以改善继发于BOO的膀胱功能障碍,并阐明了其作用机制,为后续GE临床治疗BOO提供数据支撑。
1 材料与方法
1.1 实验试剂 GE (货号为HY-N0009)和ZD7288 (货号为HY-101346)购买于Med Chem Express公司;苏木素-伊红(HE)和丙二醛(MDA)检测试剂盒购买于北京索莱宝科技有限公司(货号G1120、BC0025);谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(货号S0059S)、超氧化物歧化酶(SOD)活性检测试剂盒(货号S0101S)、超敏ECL化学发光试剂盒(货号P0018S)和蛋白印迹相关试剂购自上海碧云天生物技术有限公司;High Capacity RNA-to-cDNA反转录试剂盒(货号4368814)和SYBRTMGreen探针(货号4309155)购自美国赛默飞公司;Nrf2和血红素氧合酶-1 (HO-1)多克隆抗体来自英国Abcam公司(货号ab92946、ab137749);核因子-κB p65 (NF-κB p65)、P-NF-κB p65 (Ser536)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体和辣根过氧化物酶(HRP)偶联的二抗(货号8242、3033、5174、7074S)购买于美国Cell Signaling Technology公司;其余试剂购自国内相关生物公司。
1.2 实验动物 雌性SPF级别 SD大鼠30只,体重150~170 g购自珠海百试通生物科技有限公司,生产合格证号SCXK(粤)2020-0051;大鼠按照广州锐格生物科技有限公司动物饲养管理规程进行饲养,房间温度(22±2)oC,湿度为50%~70%,房间12 h光照/12 h黑暗交替,大鼠自由进食和饮水。
1.3 实验方法
1.3.1 pBOO大鼠模型建立及分组[9]:大鼠经异氟烷麻醉后,沿下腹腹壁切开1~2 cm,暴露膀胱后游离出膀胱颈,紧贴膀胱颈放置PE-20管,使用3-0聚丙烯缝合线在膀胱颈和尿道周围系上系带,拔出PE-20管,缝合切口。术后所有大鼠均皮下注射头孢曲松钠(7 mg/kg)防止术后感染,按照5 mg/(kg·d)摄入量在大鼠笼内放入含有美洛昔康的膳食补充剂果冻,对术后大鼠镇痛。pBOO造模4周后,将大鼠分为五组,假手术(Sham)组,pBOO组,GE 20、40、80 mg/kg组,每组6只,每天灌胃1次;Sham组和pBOO组大鼠给予相同体积的0.9%氯化钠溶液,连续给药14 d。
1.3.2 pBOO模型大鼠膀胱尿流动力学检查:异氟烷麻醉大鼠,从尿道插入直径1 mm PE-20管,按压膀胱排净尿液,将导管连接到与微量输液泵和压力传感器相连的三通阀,微量输液泵以0.2 ml/min持续向膀胱内灌注37 ℃、0.9%氯化钠溶液,然后利用高性能多通道信号处理器系统放大和可视化压力传感器输出的膀胱容量及膀胱压。膀胱容量的变化(ΔV)以灌注0.9%氯化钠溶液到漏尿时的灌注量表示,膀胱内压的变化(ΔP)以漏尿点压力表示,膀胱顺应性(Compliance,C)=ΔV/ΔP。
1.3.3 膀胱肌张力检测:异氟烷麻醉安乐死大鼠,无菌条件下切取大鼠膀胱,使用Krebs-Ringer营养液清洗并剔除膀胱黏膜层,将膀胱切成7 mm×2 mm×2 mm大小的纵行肌条,放入含Krebs-Ringer营养液的浴槽内,外围37 ℃恒温水浴,按照19∶1通入O2和CO2到营养液中,孵育30 min后获得膀胱肌条的基础收缩力,调整基础张力至0.75 g后记录肌条收缩相对稳定之后连续的张力,然后给予终浓度为50 μmol/L的ZD7288,记录膀胱肌条自发性收缩幅度变化。
1.3.4 膀胱组织病理检测:石蜡包埋膀胱组织切成5 μm,按照HE试剂盒说明书进行染色,最后利用荧光显微镜下进行拍照(×100)。
1.3.5 MDA含量及GSH-Px、SOD活性检测:膀胱组织称重后,分别按照MDA、GSH-Px及SOD试剂盒说明书进行检测。MDA含量、GSH-Px和SOD活性结果用各组别BCA定量的蛋白质量进行标准化。
1.3.6 蛋白印迹检测:蛋白定量及变性后,每孔上样25 μg,通过SDS-PAGE电泳和转膜将蛋白质转移到PVDF膜上,5%脱脂牛奶封闭2 h,将膜与对应一抗(1∶1000稀释)在4 ℃下孵育过夜后,加入HRP偶联的二抗(1∶2000稀释)室温孵育2 h,利用Image Lab图像采集和分析软件进行成像与灰度分析。
1.3.7 实时荧光定量PCR (RT-qPCR)检测:利用High Capacity RNA-to-cDNA试剂盒反转录后进行RT-qPCR检测。以18s rRNA为内参基因,采用2-ΔΔCt计算白介素-6 (IL-6)、肿瘤坏死因子-α (TNF-α)和白介素-1β (IL-1β) mRNA的相对表达量。引物序列见表1。

表1 引物序列
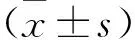
2 结 果
2.1 各组大鼠膀胱重量及膀胱与体重比值比较 与Sham组相比,pBOO组大鼠膀胱重量及膀胱与体重的比值均显著增加(均P<0.05);GE 40、80 mg/kg组治疗2周后,均可以显著降低大鼠膀胱重量及膀胱与体重的比值(均P<0.05)。见表2。

表2 各组大鼠膀胱重量及膀胱与体重比值比较
2.2 各组大鼠膀胱顺应性和膀胱张力比较 与Sham组相比,pBOO组大鼠膀胱出现梗阻性低顺应性和膀胱肌张力下降(均P<0.05);GE 40、80 mg/kg组治疗后可以显著提高大鼠膀胱梗阻性低顺应性和膀胱肌张力(均P<0.05)。见表3。

表3 各组大鼠膀胱顺应性和膀胱张力比较
2.3 GE显著降低pBOO模型大鼠膀胱组织炎性细胞浸润 HE染色结果显示,pBOO大鼠膀胱组织出现明显的炎症细胞浸润,GE治疗后可以明显抑制大鼠膀胱组织中的炎症细胞浸润,见图1。
2.4 各组大鼠膀胱组织MDA含量、SOD和GSH-Px活性比较 与Sham组相比,pBOO组大鼠MDA含量显著上调(P<0.05),SOD及GSH-Px活性明显降低(均P<0.05)。GE 40、80 mg/kg组显著降低MDA含量、增加SOD及GSH-Px活性(均P<0.05)。见表4。

表4 各组大鼠膀胱组织MDA含量、SOD和GSH-Px活性比较
2.5 各组大鼠膀胱组织Nrf2/NF-κB通路蛋白相对表达水平比较 与Sham组相比,pBOO组大鼠Nrf2和HO-1蛋白表达显著下降(均P<0.05),NF-κB蛋白磷酸化水平明显提高(P<0.05);GE 40、80 mg/kg组显著增加Nrf2和HO-1蛋白表达、降低NF-κB蛋白磷酸化水平(均P<0.05)。见表5。

表5 各组大鼠膀胱组织Nrf2/NF-κB通路蛋白相对表达水平比较
2.6 各组大鼠大鼠膀胱组织炎症因子mRNA表达水平比较 与Sham组比较,pBOO组IL-6、TNF-α、IL-1β mRNA表达水平显著升高(P<0.05);与pBOO组比较,GE 40、80 mg/kg组IL-6、TNF-α、IL-1β mRNA表达水平显著降低(均P<0.05)。见表6。

表6 各组大鼠大鼠膀胱组织炎症因子mRNA表达水平比较
3 讨 论
研究[10]发现,BOO诱导的模型大鼠膀胱重塑与有膀胱出口梗阻的患者相似,是探索膀胱结构和功能改变的常用模型。我们发现口服GE可显著改善pBOO大鼠膀胱功能障碍。研究[11-12]表明,口服GE在不同疾病模型中的治疗剂量范围在20~200 mg/kg。急毒研究表明,GE在574 mg/kg可引起大鼠肝毒性;长毒研究表明,大鼠连续口服24.3、72.9 mg/kg 90 dGE,不会引起肝毒性[13]。综上,我们选择的20、40、80 mg/kg剂量是安全的。
BOO可以导致膀胱顺应性下降,逼尿肌层中细胞外基质蛋白沉积是顺应性降低的主要原因,由于逼尿肌对阻塞的适应,膀胱会出现肥大和膀胱肌弹性消失[14-15]。我们的研究同样发现,pBOO大鼠膀胱重量明显增大,膀胱组织出现梗阻性低顺应性和膀胱肌张力下降。口服GE可提高pBOO大鼠膀胱梗阻性低顺应性和膀胱肌张力,降低膀胱重量。这提示我们GE可能通过抑制细胞外基质蛋白沉积改善膀胱功能。
氧化应激产生的活性氧会损伤膀胱组织,激活Nrf2通路可以通过促进抗氧化基因HO-1、谷胱甘肽还原酶和SOD表达来改善膀胱功能障碍[16-17]。研究[18]发现,Nrf2过表达通过抑制炎症细胞募集发挥抗炎作用。因此,我们首先研究了GE在pBOO大鼠膀胱中的抗氧化活性。结果表明,GE治疗后显著逆转了pBOO大鼠中MDA含量及GSH-Px和SOD活性;同时,GE还促进了Nrf2和HO-1蛋白表达,这与预测结果和其他文献[19-20]报道相似。综上,GE可能通过激活Nrf2增加pBOO大鼠的抗氧化酶活性来缓解氧化应激。
pBOO产生的异常膀胱内压触发了从慢性炎症到纤维化的进展,从而导致膀胱结构和功能改变。Sezginer等[7]发现,pBOO可以导致NF-κB易位进入细胞核,引起炎性反应。Yucel 等[21]表明NF-κB抑制剂可以保护膀胱抵抗氧化应激。Chen等[9]检测了继发于pBOO的膀胱中细胞因子(IL-6、IL-1β和TNF-α)的表达,发现pBOO膀胱中IL-6、IL-1β和TNF-α在mRNA和蛋白水平上均显著上调。因此,抑制NF-κB活性降低炎性因子含量可抵抗pBOO中氧化损伤。我们的结果表明,口服GE可以降低pBOO模型大鼠膀胱组织炎性细胞浸润和细胞因子含量。这提示我们,GE的抗炎作用也可能有助于通过长期治疗缓解膀胱纤维化。
综上,口服GE在pBOO模型中显著改善膀胱功能障碍,这可能与激活Nrf2通路,抑制pBOO大鼠膀胱组织中氧化应激和炎性反应相关。GE作为潜在的抑制膀胱炎症和氧化应激缓解膀胱功能障碍的候选药物,未来还需要更多的临床前试验来验证GE对膀胱功能障碍和膀胱纤维化的影响。

