抗炎因子A20与肿瘤患者预后及免疫调节通路的泛癌分析
尹翔安, 谭纤, 蒋斌元, 王丹玲
1.南华大学衡阳医学院, 湖南衡阳 421001;2.南华大学未来科学研究院, 湖南长沙 410008;3.南华大学附属长沙中心医院, 湖南长沙 410004
炎症和肿瘤之间存在密不可分的联系,A20最初作为肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的反应分子被发现,也被称作肿瘤坏死因子诱导蛋白3(tumor necrosis factor inducing protein 3,TNFAIP3),因其抗炎抗凋亡的生物学功能受到肿瘤研究者的广泛关注[1-2]。作为炎症信号转导途径中的重要调节因子,A20对核因子(nuclear factor,NF)-κB通路的激活有负向调控作用,可抑制核转录因子NF-κB信号通路中RELA p65的激活及入核,从而避免机体产生过度的炎症反应[3]。
A20基因全长4 665个核苷酸,定位于6号染色体,编码790个氨基酸的蛋白序列,相对分子质量约90 kDa。A20蛋白在氨基端存在卵巢肿瘤去泛素化酶结构域,具有去泛素化酶的功能;在羧基端存在7个锌指蛋白序列,具有泛素化E3连接酶的作用,A20在泛素化过程中具有双重作用,可对靶向分子进行双向调节[4]。抗炎过程中,A20的主要作用是反馈抑制NF-κB信号通路的过度激活,避免炎症反应的失控[5]。然而在肿瘤的发生发展过程中,慢性炎症反应可能具有双面性,既有抑癌的一面也有促癌的一面,研究发现,NF-κB信号通路的持续激活会促进肿瘤的存活,并引起肿瘤化疗耐受等一系列后果[6-7]。NF-κB信号通路的持续激活会反馈诱导A20基因的过度表达,两者之间的相互调节对炎症反应的影响可能非常复杂,并给肿瘤患者预后带来未知的结果。本研究借助生物信息学方法对不同肿瘤中A20基因的表达进行分析,发现高表达A20对部分肿瘤的预后存在不良影响,A20与肿瘤的免疫反应密切相关,且在大部分肿瘤中与NF-κB信号通路核心分子RELA p65共表达,提示A20是肿瘤免疫过程中非常重要的研究对象。
1 材料和方法
1.1 数据来源及表达分析
不同肿瘤及相应癌旁组织中A20基因的表达数据及随访资料均来自GTEx(https://gtexport.org/home/)和TCGA(https://portal.gdc.cancer.gov/)数据库,整合GTEx和TCGA数据库中样本的表达数据后进行归一化处理,使用log2表达倍数变化,P<0.05表示差异具有统计学意义。数据集中涉及的肿瘤名称及相应的缩写如下:肾上腺皮质癌(adrenocortical carcinoma,ACC)、膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA)、乳腺浸润癌(breast invasive carcinoma,BRCA)、宫颈鳞癌和腺癌(cervical and endocervical cancers,CESC)、胆管癌(cholangiocarcinoma,CHOL)、结肠癌(colon adenocarcinoma,COAD)、弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBC)、食管癌(esophageal carcinoma,ESCA)、多形性胶质母细胞瘤(glioblastoma multiforme,GBM)、头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSC)、肾嫌色细胞癌(kidney chromophobe,KICH)、肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,KIRP)、急性髓细胞样白血病(acute myeloid leukemia,AML)、脑低级别胶质瘤(lower-grade glioma,LGG)、肝细胞肝癌(hepatocellular carcinoma,HCC)、肺腺癌(lung adenocarcinoma,LUAD)、肺鳞癌(lung squamous cell carcinoma,LUSC)、间皮瘤(mesothelioma,MESO)、卵巢浆液性囊腺癌(ovarian serous cystadenocarcinoma,OV)、胰腺癌(pancreatic adenocarcinoma,PAAD)、嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,PCPG)、前列腺癌(prostate adenocarcinoma,PRAD)、直肠腺癌(rectum adenocarcinoma,READ)、肉瘤(sarcoma,SARC)、皮肤黑色素瘤(skin cutaneous melanoma,SKCM)、胃癌(stomach adenocarcinoma,STAD)、睾丸癌(testicular germ cell tumors,TGCT)、甲状腺癌(thyroid carcinoma,THCA)、胸腺癌(thymoma,THYM)、子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)、子宫肉瘤(uterine carcinosarcoma,UCS)、葡萄膜黑色素瘤(uveal melanoma,UVM)。
1.2 危险因素与患者预后分析
使用COX回归分析A20基因表达对不同肿瘤的危险程度,绘制Kaplan-Meier生存曲线研究A20基因表达情况与患者生存期(overall survival time in days,OS)和无进展生存期(progression-free interval,PFI)的关系。危险因素(hazard ratio,HR)和95%可信区间使用单变量因素分析。
1.3 基因富集分析
根据A20基因的表达程度,将样本平均分成高表达和低表达两组检测A20基因表达对肿瘤组织内生物学功能及信号通路的影响,使用GSEA软件分析高表达组和低表达组中KEGG和HALLMARK通路的基因富集情况,FDR<0.05及NES>0.65被认为差异具有统计学意义。
1.4 A20与RELA p65基因的共表达分析
使用TIMER2.0(http://timer.cistrome.org/)对不同肿瘤组织中A20与NF-κB信号通路中RELA p65基因的表达数据进行分析,检测A20基因与RELA p65的共表达情况。
1.5 统计学处理
使用t检验比较A20在癌组织与癌旁组织中的表达;生存分析中,采用COX回归分析计算HR值和P值;采用Kaplan-Meier曲线比较不同A20表达情况的肿瘤患者预后情况。P<0.05代表差异具有统计学意义。
2 结 果
2.1 22种肿瘤中A20基因的表达量发生明显改变
比对27种不同肿瘤的癌组织与癌旁组织A20表达情况,只有BRCA、KICH、KIRP、PRAD、READ 5种肿瘤的癌与癌旁组织A20基因表达量差异无显著性(P>0.05);存在A20表达差异的22种肿瘤中BLCA、LUAD、LUSC、OV、SKCM、THCA、UCEC、UCS这8种肿瘤的癌旁组织A20表达均高于癌组织(P<0.05);剩余14种肿瘤的癌组织中A20表达均高于癌旁组织(P<0.05;图1)。
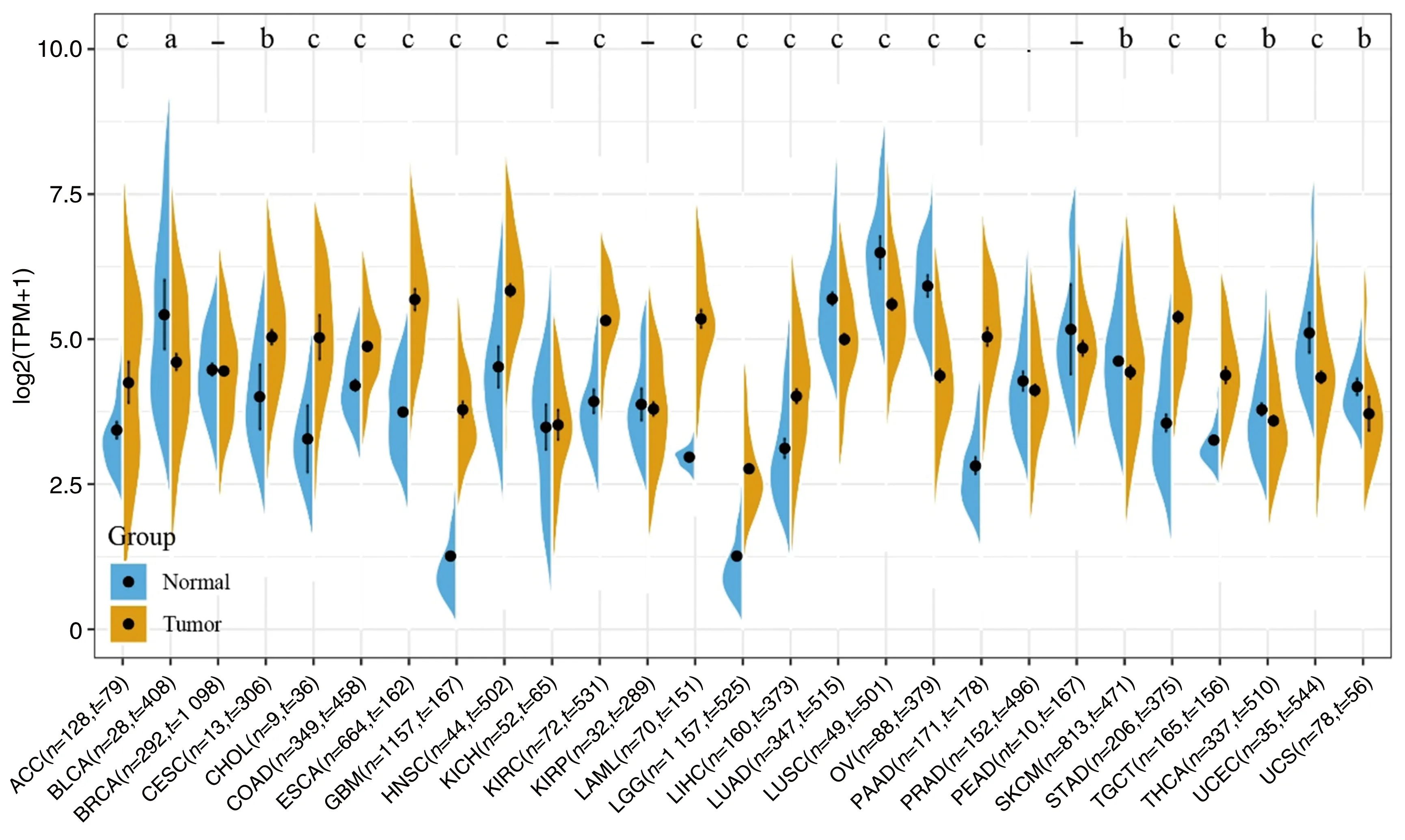
图1 不同肿瘤中A20基因在癌与癌旁组织中的差异表达结果a为P<0.05;b为P<0.01;c为P<0.001,与相应癌旁组织比较。
2.2 A20基因表达与肿瘤患者整体生存期的关系
利用COX回归分析发现,高表达A20基因是ACC、CESC、GBM、LGG这4种肿瘤患者OS的危险因素(图2)。利用A20表达及患者OS数据绘制Kaplan-Meier曲线,结果显示,在ACC、CESC、GBM、LGG肿瘤中A20基因高表达的肿瘤患者整体生存时间短于A20基因低表达的肿瘤患者(图3)。

图2 在ACC、CESC、GBM、LGG这4种肿瘤中A20基因高表达为肿瘤患者OS的危险因素

图3 高表达A20基因表达与OS的Kaplan-Meier曲线
2.3 A20基因表达与肿瘤患者病情无发展间期的关系
利用COX回归分析发现,高表达A20基因是ACC、GBM、THYM这3种肿瘤患者的危险因素(图4)。利用A20基因表达及患者PFI数据绘制Kaplan-Meier曲线,发现在ACC、GBM、THYM这3种肿瘤中高表达A20基因的肿瘤患者PFI明显少于低表达A20基因的肿瘤患者(图5),提示A20基因表达高的肿瘤患者存在更大的肿瘤复发风险。
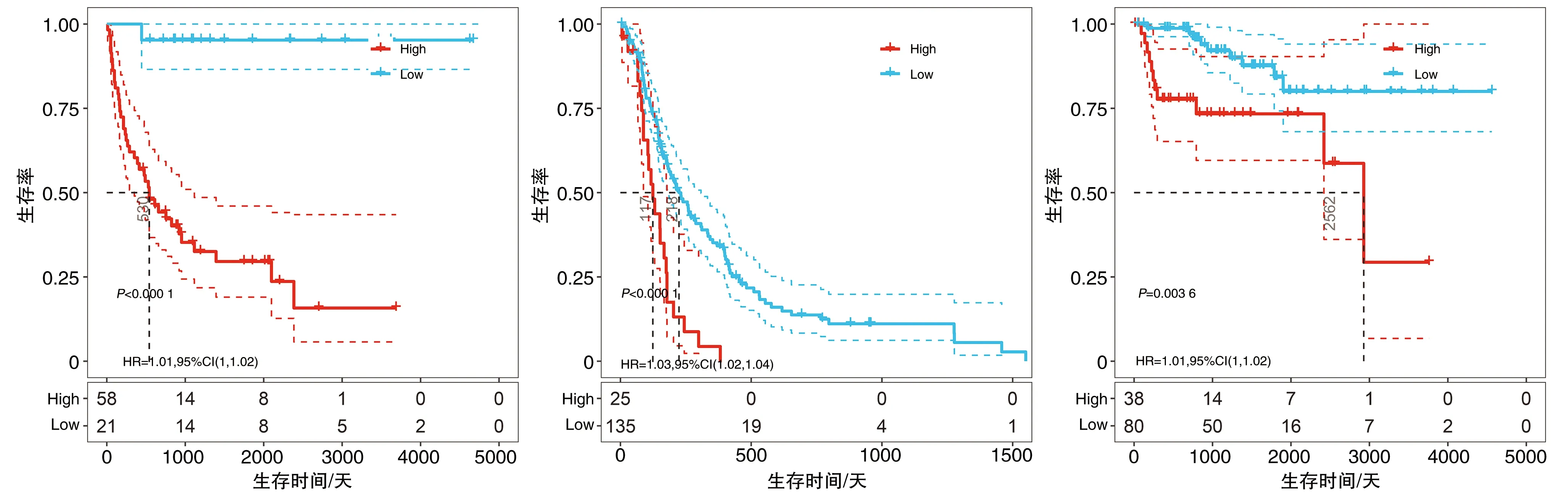
图5 A20基因表达与PFI的Kaplan-Meier曲线
2.4 肿瘤中A20相关基因的功能富集分析结果
使用GSEA分析肿瘤基因信息数据中A20基因高表达组和A20基因低表达组中相关KEGG和Hallmark通路的基因富集情况,发现A20基因高表达与NOD样受体信号通路、Toll样受体信号通路、T细胞受体信号通路的基因富集密切相关,并且TNF-α/NF-κB信号通路、IL-2/STAT5信号通路、炎症反应相关的标志物基因发生富集。当A20基因处于低表达水平时,阿尔茨海默症、核糖体功能、帕金森病及氧化磷酸化相关信号通路的基因发生富集,并且脂肪生成、胰脏B细胞功能、脂肪酸代谢及氧化磷酸化标志物相关基因发生富集(图6)。
2.5 A20与RELA p65基因的共表达情况
鉴于A20与NF-κB信号通路的密切联系,使用TIMER2.0平台分析肿瘤数据库多种肿瘤中A20与RELA p65的共表达情况,发现在大部分肿瘤中A20与NF-κB信号通路中的核心分子RELA p65表达存在显著的正相关表达情况(图7),仅在BRCA-HER2、GBM、SKCM及UVM数据中未存在两者共表达的情况。

图7 A20基因与RELA p65基因的共表达分析
3 讨 论
本研究通过A20基因的泛癌分析发现其在大部分肿瘤中存在表达,且ACC、CESC、CHOL、COAD、ESCA、GBM、HNSC、KIRC、LAML、LGG、LIHC、PAAD、STAD、TGCT这14种肿瘤中A20的表达显著高于癌旁组织。高表达A20基因对于ACC、CESC、GBM、LGG这4类肿瘤患者的整体生存时间是高危因素,并且A20基因高表达可能会造成ACC、GBM、THYM这3类肿瘤患者更短的病情无发展期,提示更短的复发时间和更高的复发风险,但是部分肿瘤如ACC、CHOL、KICH、UCS的患者样本数量未到100例,扩大数量可能会使预测结果更加可靠。基因富集分析发现A20与肿瘤患者的免疫反应密切相关,参与了多个免疫反应途径,结合现有研究认为A20与NF-κB通路关系非常密切,且A20基因与RELA p65基因在30个肿瘤类别中呈现显著的共表达关系;提示A20基因对NF-κB信号通路的调节非常重要,是研究肿瘤免疫的关键切入点。
A20基因的高表达对于GBM患者来说不仅影响整体生存时间还具有更高的复发风险,GBM患者基因表达数据显示,在癌旁组织中A20的表达量明显低于癌组织,但GBM癌组织中A20与RELA p65的表达未发现相关性,推测A20可能通过其他途径被异常持续激活,且可能存在其他A20特异性识别的泛素化靶点,相关的分子机制亟待探索。有研究发现,在GBM中抑制A20基因的表达可降低胶质瘤细胞的生长速度,减少胶质瘤干细胞的生存时间[8-9],本文认为胶质瘤中A20的相关细节值得进一步研究和探索。在SKCM中,癌旁与癌组织的A20表达未发现显著性表达差异,且A20与RELA p65不存在共表达关系,推测SKCM中存在某种特有的免疫反应调控机制,亦或者A20通过其他免疫调控通路参与了黑色素瘤的免疫调节,近年有研究者指出在黑色素瘤中A20可通过泛素化调控STAT3实现对PD-L1表达的影响,A20可能会是黑色素瘤免疫治疗的一个新突破口[10]。
到目前为止,A20基因被发现已有30年,被认为是保持组织免疫平衡的重要分子,其抗炎、抗凋亡、抗坏死的功能也逐步被人们所认识,对A20的机制及应用的研究一直在继续[11-12]。人们发现A20减少与帕金森疾病进展密切相关[13];而髓样细胞A20的缺乏可导致小鼠脂肪酸代谢能力的增强,减少肥胖及胰岛素抵抗的发生[14]。鉴于A20功能的重要性,以A20为基础制定疾病治疗策略将是未来的重要研究方向。随着A20研究文献的积累及生物信息学的进步,泛癌分析将更有效且快速的帮助研究者寻找解决问题的切入点,也希望本文能对A20的研究提供思路与线索。