碘酸钠诱导大鼠视网膜退行性改变的作用机制
邢 岩 张丽梅 赵圆圆 侯思远 金 锋
碘酸钠(NaIO3)是一种氧化剂,可特异性损伤视网膜色素上皮(RPE)细胞,继而引起视网膜光感受器受损。研究表明,NaIO3所引起的视网膜退行性改变与干性年龄相关性黄斑变性(AMD)的病理表现类似[1-2]。NaIO3引起的视网膜损伤在许多哺乳动物,如羊、兔、大鼠和小鼠等都得到了验证。用鼠建立模型,具有良好的可复制性,应用最为广泛[1]。用 20~50 mg·kg-1NaIO3给予大鼠或小鼠尾静脉注射,可引起实验个体视网膜形态结构的不可逆性损伤,且损伤具有时间依赖性[1-3]。
NaIO3诱导RPE细胞损伤涉及多个机制,包括细胞氧化应激反应、坏死/凋亡信号激活、炎症反应等[4];该过程中视网膜退行性改变的具体机制目前并未完全清楚。本研究采用NaIO3诱导产生大鼠干性AMD病变模型,采用蛋白质组学对大鼠视网膜组织进行分析,探讨NaIO3诱导大鼠视网膜退行性改变的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
取雄性SD大鼠20只(中国食品药品检定研究所提供),体重180~200 g,饲养于中国医学科学院药用植物研究所SPF级动物实验室内。随机分为对照组和模型组,每组10只。本研究动物处理遵循《实验动物管理条例》(2017修订版)的规定。
1.1.2 试剂与仪器
NaIO3(上海麦克林生化科技有限公司),HE染色试剂盒(北京博奥森生物技术有限公司),总蛋白定量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛(MDA)测定试剂盒(南京建成生物工程研究所),4-羟乙基哌嗪乙磺酸、 碘乙酰胺(美国Sigma公司),蛋白酶抑制剂 PMSF(瑞士Roche公司),肽段浓度测定试剂盒(美国Thermo公司)。D430小动物视觉电生理检测仪(美国Diagnosys公司),Orbitrap Fusion Tribrid 质谱仪(美国Thermo公司)。
1.2 方法
1.2.1 动物模型的建立
适应性饲养1周后,给予模型组大鼠30 mg·kg-1NaIO3尾静脉注射,对照组大鼠经尾静脉注射等量生理盐水,继续饲养21 d。第22天,各组大鼠称重,检测视网膜电图(ERG),之后过量麻醉处死大鼠,取眼球。实验过程中无大鼠意外死亡。
1.2.2 ERG检测
实验前1天各组大鼠提前进行12 h暗适应。检测时用复方托吡卡胺滴眼液双眼散瞳20 min,采用盐酸氯胺酮(100 mg·kg-1)和氨酸赛拉嗪(15 mg·kg-1)混合麻醉剂进行肌注全身麻醉。使用动物保温装置,采用大鼠专用环形角膜电极,标准闪光刺激诱发视网膜综合电位[5]。根据国际临床视觉电生理协会制定的国际标准检查项目,进行ERG检测,包括以下五项,分别为暗适应0.01ERG、暗适应3.0ERG、暗适应3.0振荡电位以及明适应3.0ERG和明适应3.0闪烁光反应b波振幅。以上操作过程均在暗室红光下进行。
1.2.3 视网膜组织病理学观察
采用氯胺酮过量麻醉法处死大鼠,完整摘除眼球。每组取4只大鼠左侧眼球,采用4 g·L-1多聚甲醛固定 24 h,梯度酒精脱水、透明、浸蜡、石蜡包埋,沿平行眼轴方向进行切片,切片厚 4 μm,脱蜡、HE 染色、脱水、透明并封片。
1.2.4 视网膜组织SOD、CAT活性和MDA含量检测
每组随机选出8只大鼠右眼眼球,在冰盘上剥离出视网膜,冰浴匀浆2 500 r·min-1离心15 min,取上清液,根据试剂盒说明书检测SOD、CAT活性和MDA含量。
1.2.5 液相色谱-质谱联用分析
每组随机取3份大鼠左侧视网膜组织,进行非标定量蛋白组分析[6]。使用装有在线Easy-nLC1200纳米HPLC系统(Thermo)的Orbitrap Fusion Tribrid液相色谱-质谱联用分析样品,注入的样品在反相nano-HPLC C18柱上分离,流速为600 nL·min-1,电喷雾电压为2.2 kV。通过DDA MS/MS采集模式分析样品。在m/z 250-1800的范围内进行Orbitrap全扫描。每个扫描中前20个最强的离子被自动选择进行Orbitrap二级MS HCD碎裂,且碎裂能力为32%。其他的质谱条件是:AGC目标为3×106离子用于全扫描,2×105离子用于MS/MS扫描;全扫描的最大注射时间为35 ms,MS/MS扫描的最大注射时间为80 ms,并采用动态排除18 s。采用PEAKS搜索引擎进行搜库分析。通过 DAVID 在线分析软件(https://david.ncifcrf.gov)进行差异表达蛋白质的基因本体论(GO)和京都基因百科全书(KEGG)富集分析。筛选FC (fold change)>2且P<0.05作为差异蛋白。
1.3 统计学分析
实验数据采用SPSS 24.0统计软件包进行统计学分析,数据采用均数±标准差表示,两组间指标比较采用成组设计t检验。检验水准:α=0.05。
2 结果
2.1 两组大鼠ERG检测结果
ERG检测结果显示,模型组大鼠暗适应 0.01ERG、暗适应3.0ERG、暗适应3.0振荡电位以及明适应3.0ERG和明适应3.0闪烁光反应b波振幅分别比对照组降低79.98%、81.64%、76.08%、61.68%、57.25%,差异均有统计学意义(均为P<0.05)(表1)。这表明 NaIO3可引起显著而广泛的视网膜病变,造成视网膜功能下降。
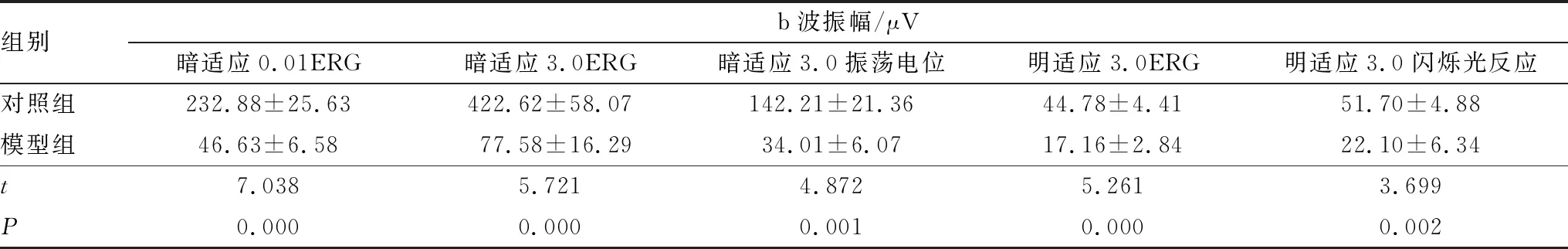
表1 两组大鼠ERG检测结果
2.2 两组大鼠视网膜组织HE染色结果
HE染色结果显示,对照组大鼠视网膜结构清晰,层次分明,胞核排列整齐;模型组大鼠视网膜组织的改变体现在视网膜全层。与对照组相比,模型组大鼠视网膜组织细胞层数减少,尤其是外核层、内核层结构紊乱,呈现明显的波浪形变化(图1)。ERG 检测结果和HE染色结果均提示,30 mg·kg-1NaIO3尾静脉注射诱导的大鼠干性AMD病变模型造模成功。
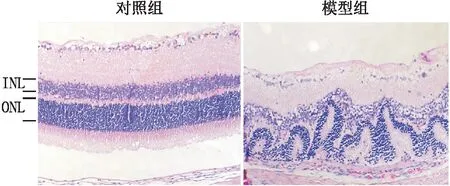
INL示内核层,ONL示外核层。图1 两组大鼠视网膜组织HE染色结果(×200)
2.3 两组大鼠视网膜组织SOD、CAT活性和MDA含量
与对照组相比,模型组大鼠视网膜组织SOD和CAT活性分别下降12.51%和14.08%,MDA含量增加57.96%,差异均有统计学意义(均为P<0.05)。这表明NaIO3可引起视网膜抗氧化酶活性下降,过氧化产物增加(表2)。
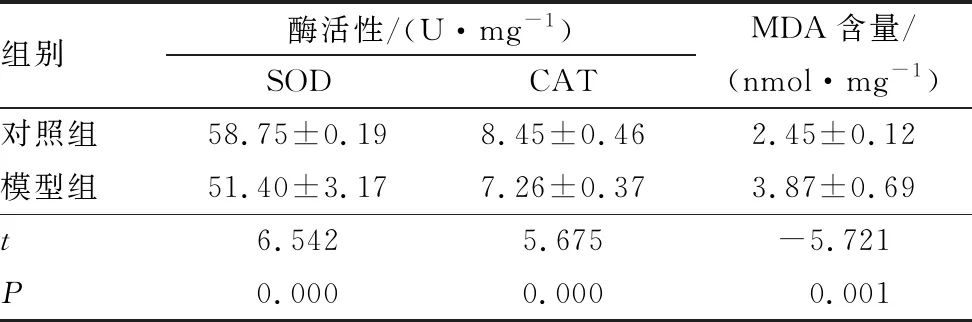
表2 两组大鼠视网膜组织SOD、CAT活性和MDA含量
2.4 视网膜蛋白质组学分析结果
火山图结果显示,模型组与对照组相比,FC>2的蛋白质有285个。进一步统计分析,P<0.05的差异蛋白有98个。和对照组相比,模型组上调蛋白有80个,下调蛋白有18个。P<0.01的上调蛋白主要有Stat3、Cd81、Adgrl2、Hspa2、Mfn2等,下调蛋白主要有Opn1mw、Rom1、Rho、Rgs9、Gnat3等(图2)。
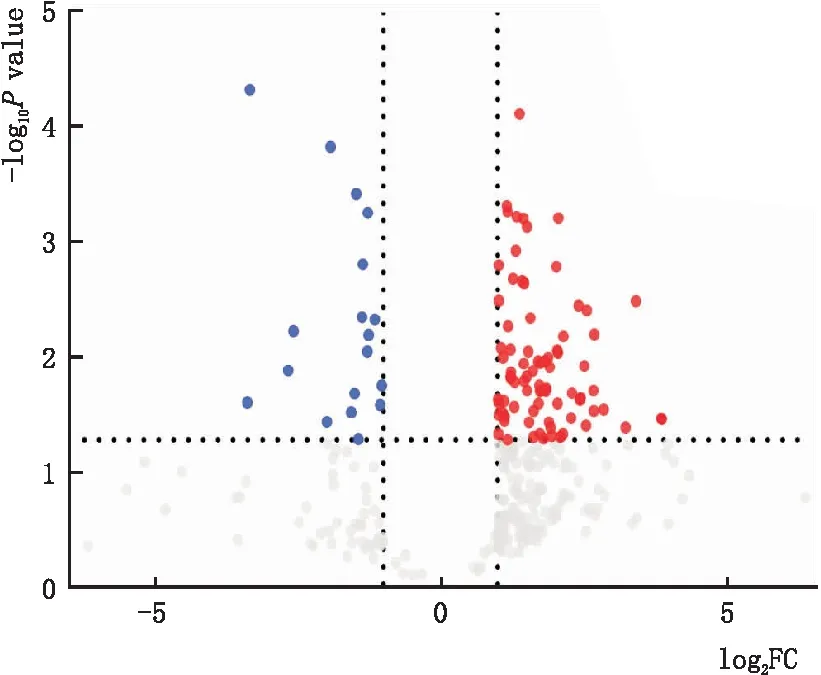
火山图中显示模型组和对照组之间98个差异蛋白的表达情况。红色表示该蛋白在模型组相较于对照组表达上调,蓝色表示下调,灰色表示该蛋白表达在两组间无显著性差异。图2 模型组和对照组差异蛋白表达情况
KEGG分析结果显示,差异蛋白主要富集于光转导(phototransduction)、蛋白酶体(proteasome)、JAK-STAT信号通路(JAK-STAT signaling pathway)、细胞内吞(endocytosis)、补体及凝血级联反应(complement and coagulation cascades)等通路(图3)。

纵坐标为差异蛋白作用通路的富集结果,横坐标代表比例,圆圈大小代表该通路富集到的差异蛋白数。颜色从红到蓝代表P值从小到大的变化。图3 模型组和对照组差异蛋白KEGG分析结果
采用GO分析进一步探究这些差异蛋白所参与的作用,结果显示,模型组较对照组上调的80个蛋白,所参与的生物学过程在调控基因表达(positive regulation of gene expression)、炎症反应(inflammatory response)、衰老(aging)以及对白细胞介素(IL)-6的细胞反应(cellular response to interleukin-6)等方面具有显著性。18个下调蛋白参与的生物学过程非常集中,主要表现在视觉感知(visual perception)、对光刺激的反应(response to light stimulus)、光转导(phototransduction),这些蛋白主要位于光受体外层、光受体内层等部位,分子功能主要体现在光受体活性(photoreceptor activity)方面(图4)。
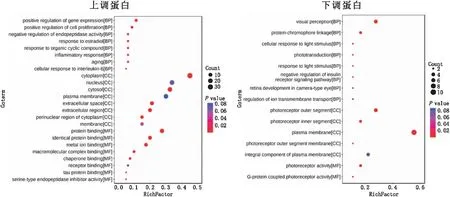
纵坐标为差异蛋白所参与的生物学过程(BP)、细胞组分(CC)和分子功能(MF)的富集结果,横坐标代表比例,圆圈大小代表该条目富集到的差异蛋白数。颜色从红到蓝代表P值从小到大的变化。图4 模型组和对照组差异蛋白GO分析结果
3 讨论
本研究通过对SD大鼠给予一次性30 mg·kg-1NaIO3尾静脉注射,成功诱导产生大鼠干性AMD病变模型。研究发现,氧化应激损伤是NaIO3诱导的视网膜色素变性的机制之一,SOD 和CAT 在视网膜抗氧化系统中起着重要的作用[7-8]。本研究证实了NaIO3可引起视网膜抗氧化能力显著下降。模型组视网膜抗氧化酶SOD和CAT活性均较对照组显著下降,过氧化中间产物MDA水平显著升高。
本研究两组间表达有显著差异的视网膜蛋白可能与该模型成功建立密切相关,因此我们采用蛋白质组学对其进行分析。结果表明,下调蛋白主要有Opn1mw、Rom1、Rho,集中在光转导、视觉感知、对光刺激的反应等生物学功能和通路上。有研究发现,20 mg·kg-1NaIO3可引起小鼠光转导基因的快速表达下调,如Rho、Opn1mw和Pde6b;这些基因与光受体细胞功能密切相关,引起光受体细胞死亡,这种变化可以导致NaIO3造模小鼠出现早期ERG反应[9-10]。因此,光转导通路异常可能与干性AMD的病理机制相关。已有研究提出,非编码RNA在调节光转导、视觉感知中发挥重要作用,可作为视网膜退行性改变的RNA疗法[11],这也从另一个角度印证了光转导通路与干性AMD的相关性。
研究认为,NaIO3可促进视网膜炎症反应[12]。本研究通过对差异蛋白的GO和KEGG分析发现,NaIO3诱导的视网膜损伤与炎症和免疫有着直接的关系。差异蛋白上调了IL-6介导的炎症反应,主要通过JAK-STAT通路、内吞作用、补体及凝血级联反应通路、抗原提呈等介导。我们发现,STAT3在模型组大鼠视网膜表达显著上调,而STAT3是调控JAK2/STAT3通路下游基因的主要蛋白,可调节细胞增殖、分化、凋亡以及免疫反应,参与启动凋亡相关基因Bax、Bcl-2的表达[13]。干性AMD是与衰老相关的退行性疾病。JAK-STAT信号通路在衰老细胞中高度激活,IL-6等细胞外因子可通过作用于JAK受体进而活化STAT蛋白,进一步调节衰老相关靶基因的转录[14]。Duncan等[15]对ARPE-19细胞研究显示,JAK-STAT激活,可上调视网膜促炎因子TLR3的表达,他们认为抑制JAK-STAT通路可能有助于治疗干性AMD。对膳食多酚眼保护作用的研究也证实了这一点,槲皮素和花青素-3-葡萄糖苷能够通过IL-6/JAK2/STAT3抗炎通路保护RPE细胞[16]。因此本研究认为,视网膜炎症和免疫反应的发生,JAK-STAT通路激活与干性AMD发病存在密切关系。
4 结论
本研究采用30 mg·kg-1NaIO3尾静脉注射,成功诱导大鼠干性AMD病变模型,其机制可能为NaIO3造成视网膜特异性氧化应激,激活JAK-STAT和补体及凝血级联反应通路,引发炎症与免疫过程,同时抑制光转导通路,由此导致视网膜发生病变反应。因此降低视网膜氧化应激水平,抑制JAK-STAT通路,调节光转导通路基因表达,可作为今后治疗干性AMD新的思路。
致谢感谢国家蛋白质科学中心的贾辰熙研究员和中国中医科学院眼科医院的梁丽娜研究员给予本课题的支持和指导。

