褪黑素对过氧化氢诱导的人晶状体上皮细胞凋亡及自噬的影响△
王思文 李鹏飞 王从玉 鲍思洁 王 勇 管怀进
年龄相关性白内障(ARC)是全球中老年人失明的主要原因[1]。随着年龄增长,体内氧化还原系统和自噬过程的平衡被打破,氧化损伤被认为是ARC的主要发病机制[2]。目前,针对氧化损伤尚未有特效药物。褪黑素是一种吲哚衍生激素,对年龄相关性眼病可能具有治疗作用[3]。低浓度褪黑素可部分缓解由H2O2诱导的视网膜色素上皮细胞死亡[4];通过黄色滤光片调节眼内褪黑激素浓度可防止晶状体过早混浊[5]。通过H2O2诱导晶状体上皮细胞(LECs)实验验证褪黑素抗氧化能力的研究目前仍较少,褪黑素在氧化损伤过程中对LECs调控的潜在作用有待补充。因此,本实验利用H2O2构建LECs氧化损伤模型,观察褪黑素对LECs细胞活力、细胞凋亡及自噬的影响,探究褪黑素对LECs抗氧化的作用机制,以期为ARC的防治研究提供思路。
1 材料与方法
1.1 实验材料
人晶状体上皮细胞系(SRA01/04)购自中国科学院上海生命科学研究所。DMEM培养液、胎牛血清、胰蛋白酶和细胞培养板均购自Gibco公司(美国),Hanks平衡盐溶液、磷酸盐缓冲液(PBS)和TUNEL试剂盒购自碧云天生物技术有限公司(中国);CCK8试剂盒购自同仁化学研究所(日本);GAPDH抗体、辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG二抗均购自ABclonal公司(中国);蛋白印迹实验抗体P62、Beclin-1、LC3、Bax、Bcl-2抗体均购自Abcam公司(英国)。褪黑素购自MedChemExpress公司(美国)。
1.2 方法
1.2.1 细胞培养与处理
快速取出冻存的SRA01/04细胞并置于37 ℃水浴锅中解冻。离心10 min后弃上清,加入新培养基(含体积分数10%胎牛血清和10 g·L-1青霉素及链霉素的DMEM培养基)重悬,并转移至新培养瓶中。置于温度37 ℃、含体积分数5%CO2的培养箱中培养24 h。待细胞密度达到80%时,使用Hanks液清洗2次,采用400 μmol·L-1的H2O2处理细胞。H2O2是常见的内源性产生活性氧的造模方法,其主要造成LECs氧化损伤,该造模方法适于本研究使用。
1.2.2 实验分组
将培养完成的细胞随机分组:对照组(不做任何处理)、H2O2组(采用400 μmol·L-1的H2O2处理)、DMSO+H2O2组(采用400 μmol·L-1的H2O2和0.2 μmol·L-1的DSMO处理)、褪黑素+H2O2组(采用400 μmol·L-1的H2O2和50 μmol·L-1褪黑素处理)。分组处理后继续培养24 h,进行各项实验室检测比较。
1.2.3 细胞活力检测
将SRA01/04细胞种在96孔板上,每孔10×103个细胞,放在培养箱中培养24 h。每组设置设置6个平行孔,弃培养基,重新向每孔加入100 μL完全培养基和10 μL CCK8溶液(该过程需要避光);继续培养1.5 h,用酶标仪检测450 nm处样品光密度(OD)值。按上述操作步骤重复进行3次实验。设仅含培养基和CCK8的空白组,细胞存活率=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.2.4 TUNEL法检测细胞凋亡
将SRA01/04细胞接种于预先放置细胞爬片的24孔板中,接种密度为每孔3×104个细胞,放入培养箱中培养24 h。待细胞密度达到60%后,将按上述分组处理方式处理后的细胞继续培养24 h。24 h后取出培养板,PBS清洗3次后,采用40 g·L-1多聚甲醛室温固定细胞1 h,1 g·L-1TritonX-100冰上通透细胞5 min。按说明书要求配置TUNEL检测液,每孔加入50 μL TUNEL检测液,37 ℃孵育1 h。加入DAPI,室温避光孵育8 min。PBS清洗3次,每次5 min,然后取出细胞爬片,封片剂封片,荧光显微镜下检测。
1.2.5 免疫印迹实验检测蛋白表达
将各组细胞从培养箱中取出置于冰上,使用冰浴后的PBS清洗2次,每次5 min。吸去PBS后,按1:100比例加入蛋白酶抑制剂和放射免疫沉淀法缓冲液(RIPA)混合的蛋白裂解液100 μL,冰上裂解后用细胞刮将细胞刮下并转移至对应的1.5 mL EP管中,4℃摇床裂解30 min,离心后提取蛋白上清,BCA法测蛋白浓度。凝胶电泳(80 V转150 V)分离蛋白后采用湿性转膜法(250 mA,2 h)将靶蛋白转移至聚偏二氟乙烯(PVDF)膜上;5 g·L-1脱脂牛奶室温下封闭PVDF膜2 h,加入对应条带位置的一抗(1:1 000),置于4 ℃冰箱摇床孵育过夜。次日,采用辣根过氧化物酶标记的山羊抗兔二抗(1:10 000)室温孵育2 h,TBST漂洗3次,每次15 min,之后于暗室内进行曝光显影。以GAPDH为内参,采用ImageJ计算目的蛋白(P62、Beclin-1、LC3、Bax、Bcl-2)表达的灰度值。
1.3 统计学处理
采用Graphpad Prism 8.0软件进行统计分析及绘制图表。各组细胞中蛋白相对表达量比较采用单因素方差分析,两样本间比较采用两样本t检验。检验水准:α=0.05。
2 结果
2.1 褪黑素对H2O2 诱导SRA01/04细胞的保护作用
为验证褪黑素对SRA01/04细胞的保护作用,采用CCK8测定法测定各组SRA01/04细胞的活力。与对照组相比,H2O2组细胞活力下降,差异有统计学意义(P<0.001);与DMSO+H2O2组相比,褪黑素+H2O2组细胞活力升高,差异有统计学意义(P<0.01)。H2O2组与DMSO+H2O2组细胞活力差异无统计学意义(P>0.05)(图1)。褪黑素减轻了H2O2诱导的SRA01/04细胞氧化损伤,增加了细胞活力。
2.2 褪黑素减少H2O2诱导SRA01/04 细胞的凋亡
为验证褪黑素是否通过抗凋亡作用对抗H2O2诱导的细胞损伤,采用免疫印迹实验检测抗凋亡蛋白Bcl-2和促凋亡蛋白Bax的表达情况。结果显示,与对照组相比,H2O2组细胞中Bax表达水平增加, Bcl-2表达水平降低,差异均有统计学意义(均为P<0.001)。与DMSO+H2O2组相比,褪黑素+H2O2组细胞Bax表达水平降低, Bcl-2表达水平增加,差异均有统计学意义(均为P<0.01)(图2)。TUNEL实验结果显示,褪黑素减少了H2O2诱导的SRA01/04细胞凋亡(图3)。

A:各组SRA01/04细胞Bcl-2及Bax蛋白表达情况;B:各组SRA01/04细胞Bcl-2蛋白表达水平比较柱状图;C:各组SRA01/04细胞Bax蛋白表达水平比较柱状图。##P<0.01;####P<0.000 1;***P<0.001;****P<0.000 1。图2 免疫印迹实验检测各组SRA01/04细胞中凋亡相关蛋白表达
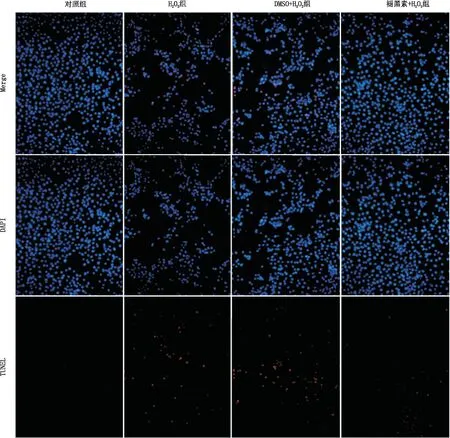
图3 TUNEL法检测各组SRA01/04细胞凋亡图
2.3 褪黑素激活SRA01/04细胞的自噬能力
为研究褪黑素对SRA01/04细胞的保护作用是否涉及自噬,采用免疫印迹实验检测自噬相关蛋白的表达。与对照组相比,H2O2组细胞中LC3-I、LC3-II 及P62蛋白表达水平均降低,差异均有统计学意义(均为P<0.001)。对照组细胞中Beclin-1蛋白表达水平与H2O2组比较,差异无统计学意义(P>0.05)。SRA01/04细胞在H2O2干预下自噬水平受到抑制。与DMSO+H2O2组相比,褪黑素+H2O2组细胞中LC3-I、LC3-II及Beclin-1蛋白表达水平均升高,差异均有统计学意义(均为P<0.000 1)。DMSO+H2O2组细胞中P62蛋白表达水平与褪黑素+H2O2组比较,差异无统计学意义(P>0.05)。褪黑素增强了H2O2干预下SRA01/04细胞的自噬能力(图4、图5)。

图4 免疫印迹实验检测各组SRA01/04细胞自噬相关蛋白的表达
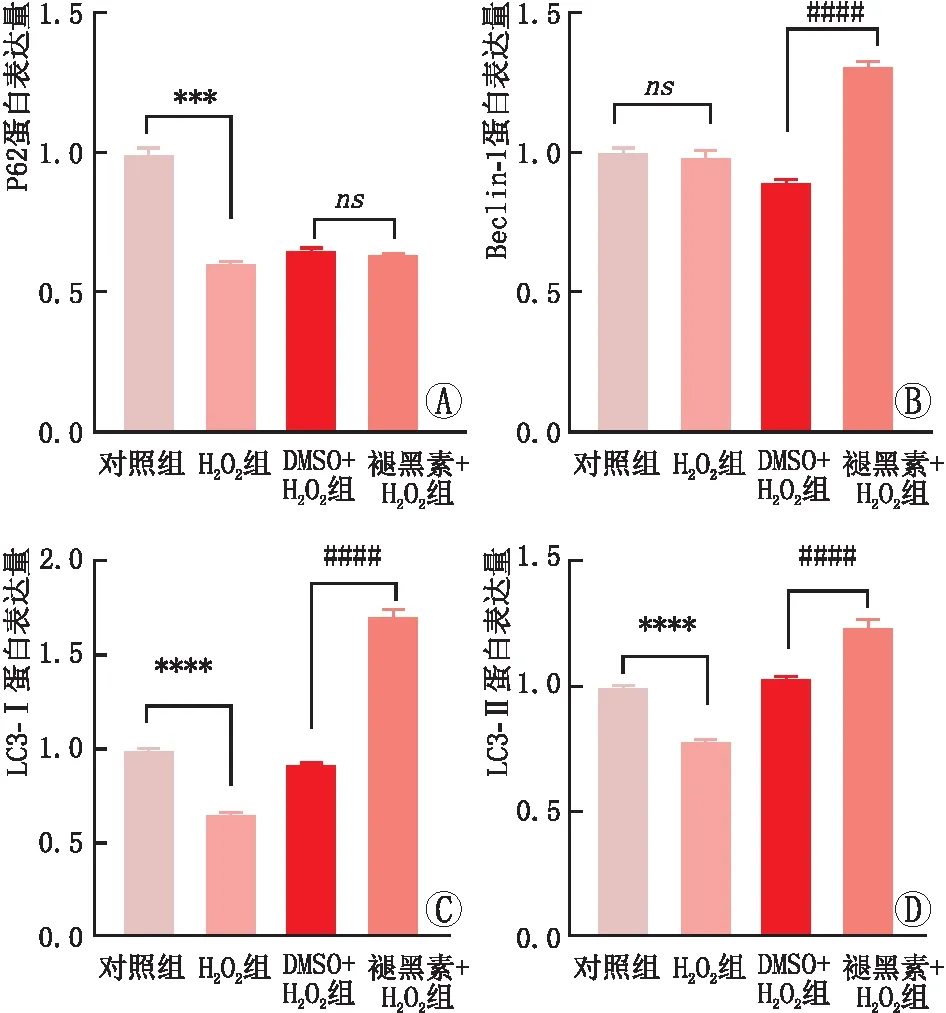
A:各组SRA01/04细胞P62蛋白表达水平比较柱状图;B:各组SRA01/04细胞Beclin-1蛋白表达水平比较柱状图;C:各组SRA01/04细胞LC3-I蛋白表达水平比较柱状图;D:各组SRA01/04细胞LC3-II蛋白表达水平比较柱状图。***P<0.001;****P<0.000 1;####P<0.000 1;ns:差异无统计学意义。图5 免疫印迹实验检测各组SRA01/04细胞自噬相关蛋白表达结果比较
3 讨论
ARC是晶状体逐渐混浊的结果[6]。LECs是晶状体中唯一的细胞类型,在维持晶状体内环境的稳态和透明度方面发挥关键作用[7]。LECs细胞密度随着年龄增长呈下降趋势[8],在此过程中,氧化损伤加剧了LECs的丢失,一旦细胞丢失达到一定程度,就会引起ARC[9]。虽然ARC形成的确切发病机制尚未完全清楚,但LECs的功能障碍,如氧化应激诱导的细胞凋亡和自噬被认为是ARC发生的核心因素[10-12]。因此,自噬和细胞凋亡相关研究被认为是治疗ARC的新靶点研究方向 。
褪黑素由松果体在生物钟的控制下产生,也在眼球的视网膜、睫状体和晶状体等位置合成,并受视网膜光刺激调节[13-14]。褪黑素作为抗氧化剂,通过清除自由基和刺激抗氧化防御机制的活性发挥保护作用[14-15]。褪黑素在年龄相关性黄斑变性和糖尿病性视网膜病变中通过抗氧化应激增加视网膜色素上皮细胞和感光细胞的活力[16-17]。也有少量研究报道有关褪黑素对白内障的影响[18-19]。Abe等[20]发现褪黑素能够抑制新生大鼠白内障的发生,对ARC具有潜在的治疗价值。Bai等[19]研究发现,褪黑素通过PI3K/Akt信号通路对人LECs的氧化损伤产生保护作用,提示褪黑素可能对白内障具有一定治疗作用。
细胞凋亡是一种程序性细胞死亡的形式,能够在胚胎发育期间和成熟期清除不需要及功能障碍的细胞,维持生物体内组织平衡[21]。细胞凋亡途径主要由Bcl-2蛋白家族成员调节。同时Bcl-2相关的X凋亡调节剂Bax在线粒体介导的细胞凋亡启动中起关键作用[22]。研究发现,褪黑素在神经退行性疾病中通过抗凋亡机制保护神经细胞[23-26]。本研究结果显示,褪黑素可提高H2O2诱导SRA01/04细胞的活力,减轻H2O2诱导SRA01/04细胞的氧化损伤程度,同时增加抗凋亡蛋白Bcl-2的表达,抑制促凋亡蛋白Bax的表达,从而抑制SRA01/04细胞的凋亡。
自噬是真核细胞中高度保守的自我降解过程,可将胞质内物质,如蛋白质和细胞器传递至溶酶体进行清除,是维持细胞稳态和适应压力的核心[27-28]。自噬功能失调可能导致各种年龄相关疾病,包括ARC[29]。研究发现,自噬程度随年龄的增长而下降,自噬活性的升高可以延缓细胞衰老并延长小鼠的健康存活时间[30-31]。关于褪黑素的保护作用是通过自噬产生还是抗自噬实现,目前学者存在不同意见。Guo等[32]研究发现,褪黑素在缺血/再灌注损伤的小鼠来源神经瘤母细胞中通过促进自噬作用从而保护细胞。相反地,Teng等[33]证明褪黑素在缺血/再灌注损伤的小鼠来源神经瘤母细胞中发挥抗自噬作用保护神经。本实验研究发现,褪黑素通过增强自噬作用达到保护SRA01/04细胞的效果。微管相关蛋白质LC3是经典的自噬标志物,LC3-I向LC3-Ⅱ的转化被认为是早期自噬活性的指标[34]。因此,本研究分别评估了LC3-I和LC3-Ⅱ的表达。在SRA01/04细胞中,褪黑素使LC3-I与LC3-Ⅱ表达升高,表明自噬体形成增加。P62是一种间接介导自噬体-溶酶体融合的蛋白质,与自噬通量反向相关[35],它的积累被视为抑制自噬的标志物,当自噬被激活时,其会减少。本实验结果显示,H2O2干预后,P62蛋白表达水平降低,但褪黑素干预后,P62蛋白表达水平并未升高。此外,Beclin-1在自噬小体形成中也起重要作用,被认为是自噬小体激活的自噬标志物。本实验中,Beclin-1蛋白表达水平在褪黑素干预后明显增加。LC3-I和Beclin-1蛋白表达水平升高表明褪黑素可能激活了SRA01/04细胞自噬的起始阶段。LC3-Ⅱ蛋白表达水平升高,但P62蛋白表达水平未升高,可能表明褪黑素也可以促进自噬体的成熟,但对自噬降解阶段影响并不显著。总之,本研究中褪黑素具体通过何种机制发挥了促自噬作用,仍需要进一步的研究证实。
4 结论
褪黑素对LECs细胞具有保护作用;褪黑素可以提高H2O2诱导下SRA01/04细胞的存活率,减少细胞凋亡;褪黑素对LECs细胞的保护作用通过促进细胞自噬完成。本研究结果有助于更好地研究褪黑素的临床应用价值,以及探索ARC治疗的新靶点。

