大鼠主动脉血管内皮细胞原代培养方法改良及氧化损伤模型构建
马 露,杨 雷,晏凡晨,刘晓丹,丁 煌,谭 维,李菀榆,唐映红,张 伟,邓常清
(湖南中医药大学中西医结合学院, 湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208)
血管内皮细胞(vascular endothelial cells, VECs)是位于血液和血管平滑肌之间的单层扁平上皮细胞,具有调节血管通透性和顺应性、血管壁物质转运,凝血、抗凝平衡及正常血液流变性等多种生理功能,参与调节氧化/抗氧化、血管舒缩、促炎/抗炎、抗凝/促凝的动态平衡等过程[1]。当血管内皮受到血流冲刷、病原微生物、机械损伤和脂质浸润等病理因素损害时,VECs可发生功能障碍或损伤。血管内皮可受多种因素的影响引起损伤或功能障碍,尤其是氧化应激、肾素-血管紧张素系统、氧化低密度脂蛋白、同型半胱氨酸等是其主要的损伤因素[2]。因此,从血管内皮损伤角度深入研究心血管疾病的病因病理及其防治具有重要的意义。
目前,VECs的提取主要采用机械刮取、组织贴块法和酶消化等从大动脉及微动脉提取AVECs进行原代培养,但都存在细胞获取量少、细胞生长较慢等弊端。大鼠是医学科研的主要实验动物,具有内皮细胞获取方便等特点,是血管生物学研究的重要工具。另外,目前VECs氧化应激损伤模型构建主要有氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)[3]、过氧化氢[4]、脂多糖[5]、三甲胺-N-氧化物[6]等方法,但这些方法都存在模型不稳定的弊端。1-棕榈酰-2-(5-氧丙烯酰)-sn-甘油-3-磷酸胆碱[1-palmitoyl-2-(5-oxovaleroyl)-sn-glycero-3-phosphocholine,POVPC]是ox-LDL氧化代谢产物之一,其结构稳定,是一种促炎症脂质,参与胆固醇的合成[7]。本课题组前期研究发现,VECs是研究血管内皮功能最为直观的工具细胞,50 mg·L-1氧化低密度脂蛋白(ox-LDL)可诱导大鼠胸主动脉内皮细胞氧化损伤模型,但其有不稳定的缺点[8]。因此,本研究以植块联合胶原酶消化改良法建立了大鼠原代主动脉血管内皮细胞(aortic vascular endothelial cells,AVECs)培养方法,并采用POVPC构建了VECs氧化损伤模型,旨在为VECs功能和药物的研究提供一个简便有效的工具。
1 材料与方法
1.1 实验动物SPF级雄性8周龄SD大鼠,体质量(250±20) g,购自湖南斯莱克景达实验动物有限公司,动物许可证号 SKY (湘) 2019-0004。动物饲养于湖南中医药大学动物实验中心,伦理批准号LL202209140。实验前适应性喂养3~7 d,术前禁食12 h,自由饮水。动物的使用符合科技部《关于善待实验动物的指导性意见》相关规定。
1.2 药品与试剂大鼠胸主动脉内皮细胞完全培养基(aortic vascular endothelial cell complete culture medium,AVEC-CCM,批号CM-R075)、DMEM/F12基础培养基(批号PM150312)、特级胎牛血清(批号PM150210)均购自中国武汉普诺赛公司;POVPC(C3601,苏州美国APE×BIO生物科技有限公司);Matrigel基质胶(批号356234,美国康宁);CCK-8细胞增殖试剂盒(批号BS350B,中国广州Biosharp公司);TRITC 标记鬼笔环肽工作液(批号CA1610,北京索莱宝);活性氧(ROS)测定试剂盒(批号E004-1-1,南京建成公司);吐温-20(批号T8220,北京索莱宝);DAPI溶液(即用型,批号C0065,北京索莱宝);抗荧光衰减封片剂(批号S2100,北京索莱宝);Ⅰ型胶原酶 (批号C8140,北京索莱宝);2 g·L-1明胶(批号GUGL-R002,苏州海星生物);青霉素-链霉素双抗液(批号PB180120,北京索莱宝);磷酸盐缓冲液(PBS)(批号PB180327,武汉普诺赛);质量分数为4%多聚甲醛通用型组织固定液(批号BL539A,广州Biosharp公司);0.25 g·L-1胰蛋白酶(批号PB180226,武汉普诺赛);牛血清白蛋白(BSA)(批号4240GR025,广州赛国生物科技有限公司)。兔抗血管性血友病因子(vWF)多克隆抗体(1:200,批号BS-0586R,北京博奥森);FITC标记山羊抗兔IgG(H+L)(批号A0562,上海碧云天)。
1.3 仪器CO2培养箱(德国Heraeus公司);SW-CJ-1FD型超净工作台(苏州安泰空气技术有限公司);BX51光学显微镜(日本奥林巴斯有限公司);ECLIPSE正置荧光显微镜(日本Nikon公司);多功能酶标仪(美国Bio-Tek公司);A1激光共聚焦显微镜(Cytation3,日本NIKON公司)。
2 方法
2.1 AVECs的提取、培养① 大鼠颈椎脱臼处死,无菌条件下分离主动脉,置于含有PBS(含质量分数为1%的双抗)的培养皿中,震荡仪震荡,无菌手术镊去除血管外周脂肪、结缔组织,漂洗3次,转移至新培养皿中,将血管浸于PBS中,显微镊夹住管壁,用显微剪沿血管纵轴剪开,暴露血管内膜。② 漂洗后将主动脉剪成2~3 mm长度的血管段,加入5 mmol·L-1Ⅰ型胶原酶,37 ℃下消化20~30 min后,用含血清培养基终止消化,转移至预先以2 g·L-1明胶包被好的6孔培养板中,加入AVEC-CCM以遮住主动脉即可,于37 ℃、5%CO2、饱和湿度的CO2培养箱培养。③原代细胞难以贴壁,血管段种植好后需紧贴壁不挪动位置,视培养液的量添加,血管段禁漂浮在培养液中。④随后在36 h、48 h每次视培养液的量加AVEC-CCM,以遮住血管为宜,72 h内不换液。然后每隔2~3 d更换AVEC-CCM。第7~9天后细胞生长形态呈现针尖形、梭形、椭圆形、不规则多边形。d 9~12细胞至接近融合。
2.2 细胞传代培养d 10~12原代细胞融合达2/3以上即可传代,弃去培养液和血管段,用PBS冲洗孔板,加入质量分数为0.25%胰蛋白酶消化2~4 min,显微镜下观察内皮细胞皱缩变圆,立即加入质量分数含5%胎牛血清的DMEM/F12培养基,终止消化,轻轻吹打并混匀,移入15 mL离心管中,800 r·min-1离心5 min,弃上清,加入AVEC-CCM制成细胞悬液,根据细胞数目按1 ∶2或1 ∶3传代种植于T25培养瓶中,以后隔12 h观察1次,待培养液变黄换液,d 1~3 待细胞铺满瓶底80%~90%时传代。
2.3 AVECs鉴定取第3代(P3)细胞,制成细胞悬液后按2×108L-1密度接种于24孔培养板,在孔板中加入玻片制作细胞爬片,待细胞融合至70%~80%后,PBS清洗3次,用质量分数为4%多聚甲醛固定爬片20 min,PBST(含1‰吐温20的PBS)清洗3次,每次3~5 min,然后加质量分数为3%BSA室温封闭1 h,再用PBST清洗爬片3次,加入 200 μL抗vWF抗体(1 ∶200),4 ℃过夜。次日用PBST清洗3次,加FITC标记山羊抗兔IgG(H+L)抗体孵育1 h,PBST清洗3次后,加入200 μL DAPI溶液,PBST清洗3次,封片剂封片。荧光显微镜观察拍照,绿色荧光为vWF阳性,即为AVECs。
2.4 AVECs氧化损伤的模型建立及细胞增殖测定参照Yan等[9]方法,用不同浓度POVPC干预P2-P4 AVECs,CCK-8法检测细胞增殖。胰酶消化对数生长期AVECs后,在96孔板中接种100 μL的细胞悬液,每孔1×105个细胞,置培养箱中37 ℃、5% CO2培养24 h,然后分别用含终浓度4.375、8.75、17.5、35、70 μmol·L-1POVPC的DMEM/F12完全培养基处理,空白对照组用等量培养基处理。培养24 h后,每孔加入10 μL CCK-8溶液孵育30 min,用酶标仪测定450 nm吸光度A值,计算细胞存活率和细胞增殖抑制率。细胞存活率=[(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)]×100%;细胞增殖抑制率=(1-不同浓度POVPC处理的A值/对照组A值)×100%。
2.5 激光共微镜检测内皮细胞骨架形态在24孔板中加入玻片,取P2-P6的AVECs进行培养并制作细胞爬片,生长24 h后细胞融合达50%时,吸弃培养液,同上加入含不同浓度POVPC的DMEM/F12完全培养基处理24 h,然后取出细胞爬片,室温条件下PBST清洗2次,4%多聚甲醛室温固定细胞15 min。PBST清洗细胞3次, 3% BSA(PBST配制)封闭30 min,加入TRITC标记鬼笔环肽工作液250 μL/孔(1 ∶100,3% BSA配制)1 h;PBS清洗3次, DAPI染核5~8 min,PBS清洗3次后,抗荧光衰减封片剂封片,共聚焦显微镜下观察细胞骨架形态、纤维丝排列、结构是否断裂缺失等。
2.6 Matrigel 基质胶成管实验测定AVECs成管功能选取P2-P4 AVECs,细胞融合至90%~100%时,胰酶消化后,1 000 r·min-1离心5 min,重悬细胞至1×108L-1,将细胞加入24孔培养板。24 h后细胞融合70%~80%时,同上分别用含不同浓度POVPC的DMEM/F12完全培养基处理。取事先在4 ℃冰箱解冻的Matrigel基质胶加入96孔板中(50 μL/孔),置于培养箱中约30 min待其凝固。将处理结束的培养细胞常规方法消化,800 r·min-1离心5 min,弃上清,加入无血清DMEM/F12基础培养基重悬细胞并调整细胞密度,将细胞悬液加入配制好的Matrigel胶96孔板中(100 μL/孔,1×104个细胞),放入细胞培养箱常规培养4 h,显微镜拍照观察,采用ImageJ进行图像分析,每张图像取相同放大倍数视野,计数血管形成的节点、网格数目、血管总长度、血管分支长度并进行统计分析。
2.7 DCFH-DA荧光探针检测细胞ROS水平取P2 AVECs,按1×104/孔接种于24孔培养板,同前分组并以不同浓度POVPC处理24 h后,PBS清洗3次。每孔加入300 μL DCFH-DA探针应用液(1 ∶1 000无血清培养基稀释,终浓度为10 μmol·L-1),37 ℃避光孵育30 min后,弃培养基,PBS清洗3次,荧光显微镜检测,采用ImageJ软件,测定相同面积下的荧光强度,以荧光强度定量细胞内ROS水平。绿色荧光值越强,则ROS水平越高。
3 结果
3.1 大鼠主动脉原代AVECs的提取、培养和鉴定取大鼠胸腹主动脉,采用6孔板植块联合胶原酶消化改良法进行提取培养AVECs。倒置显微镜下观察,主动脉血管段培养d3,血管周围可见原代内皮细胞贴壁,第7~9天后细胞形态呈现针尖形、梭形、椭圆形、不规则多边形。12 d后,迁出生长的细胞覆盖6孔板面积的2/3以上,融合成致密的单层,可见细胞呈“铺路石”样,呈典型的内皮细胞生长特征(Fig 1)。vWF免疫荧光染色发现,在激光共聚焦显微镜下vWF阳性呈绿色,细胞核DAPI染色呈蓝色,vWF阳性即为AVECs,阳性占比达0.95(Fig 2)。

Fig 2 Immunofluorescence identification of vWF (×100, bar=100 μm)
3.2 POVPC对AVECs增殖的影响为建立AVECs氧化损伤模型,用不同浓度POVPC干预细胞,检测细胞增殖活性。POVPC在17.5~70 μmol·L-1范围内可明显抑制细胞增殖(P<0.05),其中以35 μmol·L-1的POVPC对细胞增殖的抑制作用尤为明显,增殖抑制率为0.26±0.01。表明,POVPC对AVECs增殖有抑制作用(Fig 3)。
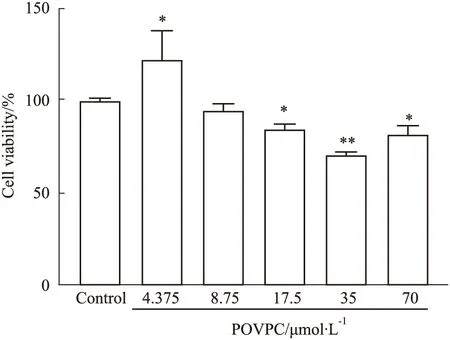
Fig 3 Effect of POVPC on cell proliferation n=5)
3.3 POVPC对AVECs细胞骨架的影响细胞骨架中F-肌动蛋白(F-actin)呈红色荧光信号。空白对照(control)组及4.375 μmol·L-1POVPC组红色荧光信号较强,细胞伸展良好,纤维状F-actin位于胞浆内,排列整齐、沿细胞纵轴均匀分布、细胞骨架蛋白聚集,表明细胞骨架完整。8.75~70 μmol·L-1POVPC作用后,细胞骨架呈一定程度的损伤,F-actin纤维排列不均匀,细胞骨架散乱,纤维丝交叉分布散乱,尤其是35 μmol·L-1POVPC作用后,F-actin纤维排列混乱,数量明显减少,丝状结构断裂、堆积,纤维丝交叉、甚至缺失,细胞骨架解聚、结构模糊。表明POVPC在8.75~70 μmol·L-1时可损伤细胞骨架,以35 μmol·L-1POVPC作用尤为明显,可诱导VECs形态结构改变、细胞骨架蛋白解聚、重排(Fig 4)。
3.4 POVPC对内皮细胞成管活性的影响Matrigel成管实验显示,与control组比较, POVPC在8.75~70 μmol·L-1范围可使网格数、节点数明显减少,总长度、血管分支长度明显缩短(P<0.01)。表明8.75~70μmol·L-1的POVPC对内皮细胞成管活性有抑制作用,尤以35 μmol·L-1POVPC对AVECs成管活性的抑制作用明显(Fig 5)。
3.5 POVPC对AVECs活性氧水平的影响与control比较,4.375 μmol·L-1POVPC组荧光强度无明显变化(P>0.05),但POVPC在8.75~70 μmol·L-1时可使细胞内ROS水平明显增加(P<0.05),尤以35 μmol·L-1的POVPC细胞内ROS增加明显。表明POVPC可诱导AVECs细胞内ROS生成增加(Fig 6)。
4 讨论
VECs与人体的生理、病理过程息息相关, 在心血管疾病的发生、发展中具有重要作用。诸多心血管疾病的防治亟待解决,VECs的体外培养备受关注,尤其原代内皮细胞的提取与培养。由于内皮细胞存在极性、低更新的特性,在体外培养和贴壁比较困难。VECs提取及体外培养还存在数量不足、传代少、纯度不高等问题。自Jaffe等[10]首次开展VECs体外培养以来,人们对VECs原代细胞提取和培养的方法进行了不断探索,提高细胞分离效率、缩短培养时间、优化体外培养方法是VECs培养探索的主要问题。

Fig 4 Effect of POVPC on cytoskeleton (×400, bar=50 μm) F-actin is red fluorescence and DAPI is blue fluorescence.

Fig 6 Effect of POVPC on ROS levels in AVECs n=5)
培养原代VECs,主要选取人脐静脉和猪、小牛、兔、大鼠、小鼠[11]等动物的主动脉,原代细胞提取多采用机械刮取、贴块法和酶消化等方式。大鼠作为主要的实验动物,具有经济方便、血管功能与人类相似等特点,建立大鼠VECs的体外培养方法是研究内皮细胞功能和药物作用的重要手段。目前传统的大鼠VECs提取的方法大致分为植块法、酶消化法、机械刮取法等几种[12]。①大鼠主动脉管腔单独采用酶消化法虽简单便捷,但缺点是提取的内皮细胞数量较少;②传统的植块法原代培养将组织块贴壁培养, 存在培养周期较长、分离效率低、霉菌污染的可能性增加等问题;③机械刮取法提取的内皮细胞容易混杂其他细胞。
由于目前VECs提取、培养存在细胞获取数量少、纯度低等问题,为探寻更好的培养方式,我们采用6孔板植块联合胶原酶消化改良法分离AVECs,在AVECs提取过程中要注意,由于重力和PBS张力的作用,难以区分血管腔的内外侧面。操作时注意血管腔外侧面由于有血管分支,表面粗糙,而内侧面光滑,另外,种植时要注意内侧面贴壁,否则细胞难以移行到孔板上。本改良法提前加入了Ⅰ型胶原酶至6孔板,主动脉管腔用显微剪沿血管纵轴剪开,将主动脉剪成2~3 mm长度的血管段,在滴有胶原酶的6孔板上均匀摊开内膜面并贴壁,按照3块血管段/孔进行接种,72 h内不换液,动作轻柔,在细胞完全移行至孔板前尽量减少移动次数。该法主要优势表现在以下3个方面:①简单易行,操作便捷,可重复性强,不需要覆盖盖玻片、反复添加昂贵的生长因子等繁琐的步骤;②明显缩短原代培养时间,从另一角度减少了换液次数,节省了高昂的AVEC-CCM,减少了实验耗材;③高纯度AVECs的获取大幅度提高了时间效率;④传代次数多达16~18代,一根大鼠主动脉AVECs的提取培养即可满足血管内皮相关的实验需求,进而明显降低了实验成本。总之,该法获取的内皮细胞较多,纯度达0.95以上,刘倩等[13]研究表明,VECs提取鉴定的纯度占0.38,本研究分离效率和纯度明显提高,远远高于其他提取方法所获得的VECs,同时6孔板面积相对较小,细胞融合较快,缩短了培养时间。另外,在培养时选择大鼠原代AVECs专用培养基,使混杂其中的平滑肌细胞及成纤维细胞选择性凋亡,进而获取纯度较高的AVECs,从而为VECs功能和药物研究提供了良好的手段。
本课题组一直致力于中药复方及单体对血管相关疾病治疗的实验研究[14-15],我们前期研究发现,VECs可作为开展血管内皮氧化损伤研究稳定的细胞工具,ox-LDL 具有高度细胞毒性,损伤内皮细胞,使 VECs 生成一氧化氮合酶 (NOS)减少,分泌一氧化氮 (NO) 量绝对减少,血管收缩,血小板和白细胞在内膜损伤处黏附、聚集。ox-LDL可促使活性氧释放增加,抑制VECs增殖、成管、迁移,构建血管内皮氧化损伤模型,但模型稳定性欠佳,影响进一步深入研究。因此,为寻求更为稳定的血管内皮氧化损伤药物显得尤为重要。
POVPC是由1-棕榈酰-2-花生酰-sn-甘油-3-磷脂酰胆碱(1-Palmitoyl-2-arachidonoyl -sn-glycero-3-phosphatidylcholine, PAPC)氧化而来,可诱导内皮细胞向间质过度转化,与血管增生和慢性炎症密切相关[16]。研究表明,POVPC通过解偶联和抑制eNOS以及诱导内皮细胞氧化应激而损伤内皮功能,POVPC可抑制CD31和eNOS表达,减少NO产生,增加细胞氧化应激[17]。另外,POVPC在较高浓度下可促进ROS依赖的Src激酶激活和VE-钙粘蛋白在Tyr(658)和Tyr(731)磷酸化,导致内皮细胞结构破坏[18]。但是,POVPC对内皮细胞功能的影响仍不完全清楚。如我们所知,内皮细胞的增殖、迁移和成管活性不仅代表了血管生成的特性,也反映了内皮细胞的功能,活性氧、细胞骨架是内皮细胞氧化损伤的重要标志。因此,在本研究中,我们构建了POVPC血管内皮细胞氧化损伤模型。结果发现,8.75~70 μmol·L-1的POVPC可以抑制VECs增殖和成管功能,破坏细胞骨架,使细胞内ROS水平增加,尤以35 μmol·L-1的POVPC对VECs损伤作用明显。提示POVPC可引起VECs氧化损伤,是构建VECs氧化损伤的有效手段。
综上所述,本研究建立了改良提取培养大鼠原代主动脉内皮细胞的方法,摒弃了植块法、酶消化法、机械刮取法等方法的不足,6孔板联合使用前两法让其优势互补,分离效率和纯度明显提高,原代培养周期明显缩短,实验经费得以节省,细胞高活力,传代次数多,一根血管即可满足相关实验需求。本方法便捷,可操作性、重复性、实用性均较强。同时,本试验构建了POVPC诱导的VECs氧化损伤模型,发现POVPC可抑制VECs增殖、成管、破坏细胞骨架,提高细胞ROS水平,解决了ox-LDL不稳定的弊端,为研究VECs氧化损伤和药物的作用提供了有效的手段。

