柚皮苷的生物学功能及其在畜牧生产中的应用
李留学 赵玉超 余诗强 蒋林树
(北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206)
除中药外的所有促生长类药物饲料添加剂被禁用后,我国饲料行业进入“无抗”时代,寻找新的饲料添加剂替代抗生素成为畜牧业关注的热点。天然植物提取物因其来源广、毒副作用小以及具有多种生物活性作用成为替抗产品的潜在候选物,并引起广泛关注。柚皮苷(naringin,NAR)是柑橘类水果中主要的生物活性多酚,其具有抗氧化[1]、抗炎[2]、抗肿瘤[3]以及调节糖和脂代谢[4]等多种生物学活性。欧盟委员会于2012年发布法规,批准NAR作为所有动物饲料添加剂,并于2023年进行了授权续期。但目前关于NAR在畜牧生产中的研究相对较少,阻碍了其作为饲料添加剂在生产中的应用和推广。因此,本文就NAR的理化性质、生物学功能以及在畜牧生产中的应用进行综述,旨在为其饲用化研究提供理论参考。
1 NAR的来源、结构及理化性质
NAR又称柚苷、柑橘苷和异橙皮苷,主要存在于柠檬、橙子和葡萄柚等多种柑橘类水果的果皮和果肉中,同时也是骨碎补[5]、化橘红[6]和枳壳[7]等中药的主要药效成分。NAR最早于1857年在柚子树花中被发现,但直到1928年其化学结构才被首次阐明,其由2个鼠李糖单元连接在其苷元(柚皮素)C-7位置[8-10](图1)。NAR为一种淡黄色结晶性粉末,味苦,常温下在水中的溶解度仅为0.1%,易溶于甲醇、乙醇和稀碱溶液中,不溶于乙醚、己烷和氯仿等非极性溶剂[11]。
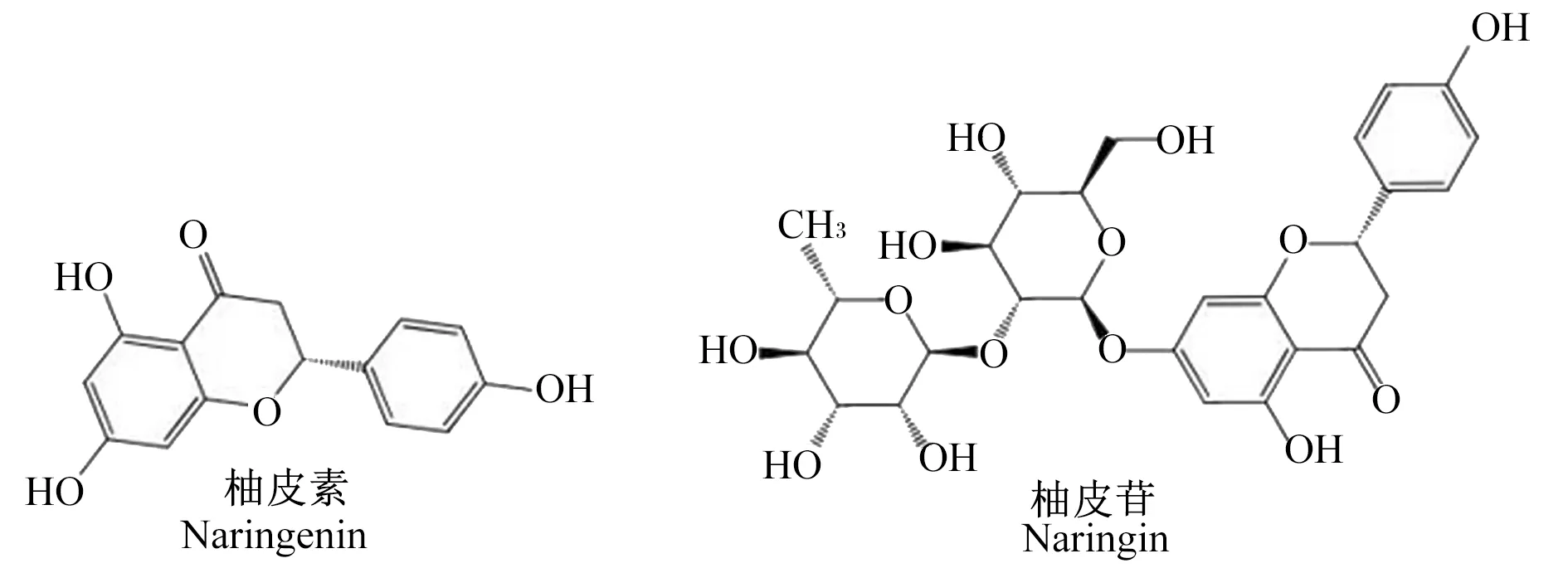
图1 NAR的结构
2 NAR的生物学功能及其作用机制
2.1 抗氧化功能
NAR具有较强的抗氧化能力。研究发现,NAR(0.5 g/kg)抗氧化能力可与商用抗氧化剂普罗布考(0.5 g/kg)和洛伐他汀(0.3 g/kg)相媲美[12-13]。NAR可直接清除自由基,减少机体氧化应激的发生。研究发现,NAR清除羟基自由基和2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基的半抑制浓度分别为0.32和0.39 mg/mL,而且其清除羟基自由基的能力比抗氧化剂2,6-二叔丁基-4-甲基苯酚更强[14]。同时,NAR对超氧阴离子自由基和2,2-联苯基-1-苦基肼基也具有显著的清除能力[15]。NAR也可提高内源性抗氧化酶的活性,减轻氧化应激损伤。体外试验表明,NAR显著改善了因缺氧/复氧导致H9C2细胞中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性的降低,其还显著降低了细胞内活性氧(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)的水平,减少了氧化应激损伤[16]。体内试验也发现,NAR通过提高SOD和CAT活性,上调SOD、CAT和GSH-Px基因的表达,在调节机体抗氧化能力中发挥重要作用[13]。NAR还参与调控氧化应激信号通路,增强机体抗氧化防御能力。核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是抗氧化信号通路的关键调节因子,负责调控Ⅱ相解毒酶和抗氧化酶基因的协调和表达,而NAR通过磷酸肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路激活Nrf2,提高受Nrf2调控的抗氧化蛋白血红素加氧酶-1(heme oxygenase-1,HO-1)和还原型烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶1[NAD(P)H quinone oxidoreductase 1,NQO1]的表达,减少机体氧化损伤[17-18]。此外,另有研究发现,NAR还可通过激活单磷酸腺苷活化蛋白激酶(AMP-activated kinase,AMPK)/Nrf2途径减轻体外氧化应激[19]。综上可知,NAR一方面通过直接清除自由基,拮抗自由基对细胞的攻击;另一方面通过提高机体内源性抗氧化酶活性,缓解机体氧化应激;此外,NAR还可通过激活抗氧化信号通路,增强机体抗氧化防御系统(图2)。
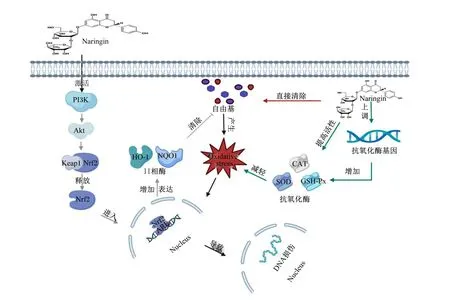
Naringin:柚皮苷;PI3K:磷酸肌醇3激酶 phosphatidylinositol 3 kinase;Akt:蛋白激酶B protein kinase B;Keap1:Kelch样环氧氯丙烷相关蛋白1 Kelch-like epichlorohydrin-associated protein 1;Nrf2:核因子E2相关因子2 nuclear factor E2-related factor 2;ARE:抗氧化反应元件 antioxidant response element;HO-1:血红素加氧酶-1 heme oxygenase-1;NQO1:还原型烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶1 NAD(P)H quinone oxidoreductase 1;Nucleus:细胞核;Oxidative stress:氧化应激;CAT:过氧化氢酶 catalase;SOD:超氧化物歧化酶 superoxide dismutase;GSH-Px:谷胱甘肽过氧化物酶 glutathione peroxidase。
2.2 抗炎功能
炎症是一种先天的免疫机制,是免疫反应的一个组成部分。但炎症过度或不受控的情况下,会损害宿主组织并引起机体损伤。目前,已有大量研究表明,NAR在动物气道炎症[20-21]、肝炎[22]、关节炎[23]及结肠炎[24]等炎症疾病中发挥抗炎及缓解炎症损伤作用。在小鼠腹膜炎模型中,NAR显著逆转了卡拉胶引起的炎症过程所导致的腹膜液中辅助型T细胞1细胞因子白细胞介素(interleukin,IL)-2、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IL-17水平的升高,并刺激了腹膜液中辅助型T细胞2细胞因子IL-4和IL-10的分泌[25];该研究还表明,NAR处理可降低肺组织中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶-2(cyclooxygenase-2,COX-2)、细胞黏附分子-1和巨噬细胞炎性蛋白-2等炎性介质的mRNA表达水平,并显著升高转化生长因子-β1的mRNA表达水平[25]。以上研究表明,NAR不仅通过重新调整促炎和抗炎细胞因子释放之间的平衡来诱导其抗炎作用,而且还在基因表达上影响这些细胞因子的平衡。研究发现,芸香柚皮苷显著抑制脂多糖(lipopolysaccharide,LPS)/ATP刺激的巨噬细胞中促炎因子IL-6、IL-1β和TNF-α的分泌[26]。芸香柚皮苷还可抑制LPS/ATP刺激的巨噬细胞中NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)介导的促炎过程[IL-1β的成熟、活化的半胱氨酸天冬氨酸蛋白酶(Caspase)-1的产生、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)的寡聚化及gasdermin D-N末端(GSDMD-NT)的产生和焦亡][26]。此外,NAR还通过抑制核因子-κB(nuclear factor-κB,NF-κB)、丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和PI3K/Akt信号通路抑制LPS诱发的NLRP3和IL-1β表达,并通过干扰NLRP3和ASC之间的相互作用抑制NLRP3炎性小体组装,发挥抗炎作用[26]。NAR还可通过抑制炎症信号通路发挥抗炎功能。Liu等[27]研究表明,NAR通过干扰NF-κB和MAPK信号通路显著抑制了LPS诱导的趋化因子IL-8、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和巨噬细胞炎症蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)的分泌,并呈剂量依赖性显著降低LPS诱导的IL-8、MCP-1和MIP-1α的mRNA表达。此外,NAR还通过抑制NF-κB的活化减少LPS诱导的一氧化氮(NO)的产生[28]。综上可知,NAR可通过调整促炎和抗炎细胞因子释放之间的平衡,抑制NLRP3途径介导的促炎过程和促炎因子的释放,抑制炎症信号通路发挥抗炎功能(图3)。
2.3 抗肿瘤功能
近年来研究发现,NAR具有良好的抗癌作用,有希望成为预防和治疗癌症的候选化合物[29]。一方面,NAR通过干扰细胞周期,诱导癌细胞凋亡。NAR通过降低磷酸β-连环蛋白(Ser675)和磷酸糖原合酶激酶-3β(Ser9)的表达和磷酸化阻断β-连环蛋白信号通路,同时增加细胞周期检查点蛋白P21/cip和P27/kip的表达,触发宫颈癌细胞周期停滞在G0/G1期,阻断癌细胞分裂[30]。在胃癌细胞中同样发现NAR阻断癌细胞周期,诱导胃癌细胞凋亡[31]。另一方面,NAR通过外源性和内源性途径介导癌症细胞凋亡。Banjerdpongchai等[32]研究表明,NAR通过激活线粒体介导的Caspase-9和Caspase-8介导的促凋亡因子Bid蛋白的水解,诱导肝癌HepG2细胞凋亡。Ramesh等[33]研究发现,NAR通过死亡受体和线粒体途径增加促凋亡基因Caspase、p53、B细胞淋巴瘤-2相关X蛋白(B-cell lymphoma 2-associated X protein,Bax)、Fas死亡受体及其衔接蛋白Fas相关死亡域蛋白(Fas associated death domain protein,FADD)的表达诱导SiHa宫颈癌细胞凋亡。NAR可通过信号通路介导的自噬诱导癌症细胞凋亡。NAR通过阻断PI3K/Akt信号通路,增加微管相关蛋白1轻链3B-Ⅱ和自噬相关蛋白Beclin1的表达以及减少p62的表达激活自噬,诱导胃癌细胞凋亡[34]。NAR还可通过激活MAPK抑制PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路诱导自噬,发挥其抗AGS胃癌细胞的增殖活性[35]。此外,NAR通过阻断MAPK信号通路的激活,降低基质金属蛋白酶的表达和活性,抑制胶质瘤U87细胞的侵袭、迁移和黏附作用[36]。除以上途径外,NAR还可通过抑制新生血管的形成,减少癌细胞侵袭和转移,以及与抗癌药物联合应用,抑制癌细胞生长并减弱抗癌药物的副作用[37-38]。
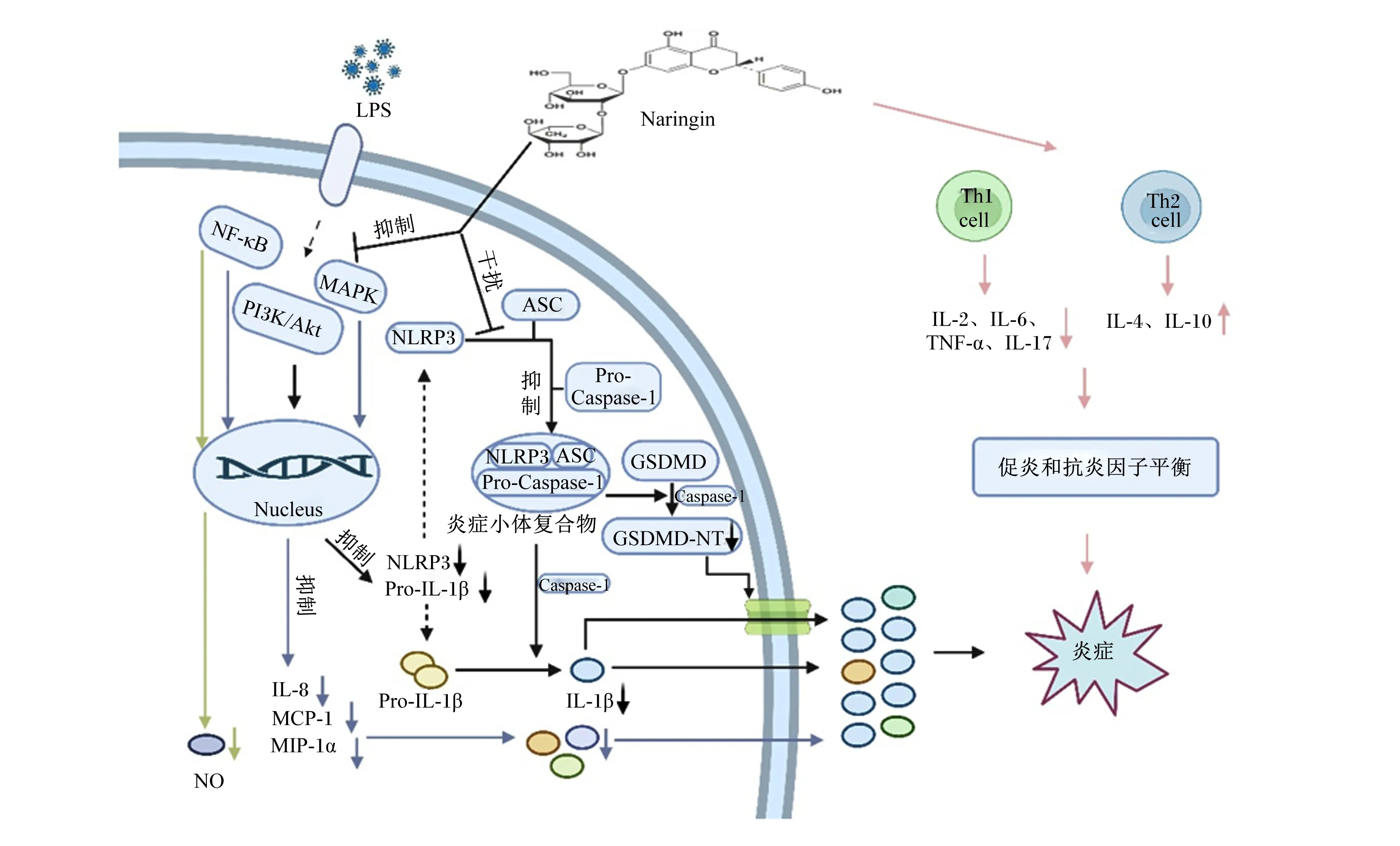
Naringin:柚皮苷;LPS:脂多糖 lipopolysaccharide;NF-κB:核因子-κB nuclear factor-κB;NO:一氧化氮 nitric oxide;MAPK:丝裂原活化蛋白激酶 mitogen activated protein kinase;PI3K:磷酸肌醇3激酶 phosphatidylinositol 3 kinase;Akt:蛋白激酶B protein kinase B;Nucleus:细胞核;IL-8:白细胞介素-8 interleukin-8;MCP-1:单核细胞趋化蛋白-1 monocyte chemotactic protein-1;MIP-1α:巨噬细胞炎症蛋白-1α macrophage inflammatory protein-1α;NLRP3:NOD样受体蛋白3 NOD-like receptor protein 3;Pro-IL-1β:白细胞介素-1β前体 interleukin-1β precursor;ASC:凋亡相关斑点样蛋白 apoptosis-associated speck-like protein;Pro-Caspase-1:半胱氨酸天冬氨酸蛋白酶1前体 cysteine aspartate protease 1 precursor;Caspase-1:半胱氨酸天冬氨酸蛋白酶1 cysteine aspartate protease 1;GSDMD:gasdermin D;GSDMD-NT:gasdermin D-N末端 gasdermin D-N terminal;IL-1β:白细胞介素-1β interleukin-1β;Th1 cell:辅助型T细胞1 T helper cell 1;Th2 cell:辅助型T细胞2 T helper cell 2;IL-2:白细胞介素-2 interleukin-2;IL-6:白细胞介素-6 interleukin-6;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;IL-17:白细胞介素-17 interleukin-17;IL-4:白细胞介素-4 interleukin-4;IL-10:白细胞介素-10 interleukin-10。
2.4 调节血糖代谢功能
NAR通过调节碳水化合物分解酶的活性干扰体内碳水化合物代谢。α-淀粉酶和α-葡萄糖苷酶是动物体内负责催化碳水化合物分解产生单糖以供机体吸收的酶,在医学领域常通过抑制α-淀粉酶和α-葡萄糖苷酶活性,延缓机体对碳水化合物的吸收,降低餐后血糖水平[39]。研究发现,NAR可显著抑制α-淀粉酶和α-葡萄糖苷酶活性,且都呈浓度依赖性[40]。另一项研究同样表明,NAR显著抑制了α-淀粉酶和α-葡萄糖苷酶的活性,且其对2种酶的半抑制浓度作用效果高于降糖药阿卡波糖[41]。因此,NAR可被认为是一种有效的餐后高血糖调节的天然化合物。NAR也可通过调节肝脏糖酵解和糖异生限速酶的活性,控制葡萄糖进入循环,进而调控机体血糖水平。研究表明,NAR通过显著降低肝脏葡萄糖-6-磷酸酶、磷酸烯醇式丙酮酸羧化酶的活性和升高肝脏葡萄糖激酶活性,进而调控糖异生和糖酵解,改善2型糖尿病db/db小鼠的高血糖[42]。另有研究表明,NAR抑制了磷酸烯醇式丙酮酸羧化酶和葡萄糖-6-磷酸酶的mRNA表达,显著上调了葡萄糖激酶的mRNA水平,改善了2型糖尿病小鼠的高血脂症和高血糖[43]。胰岛素是一种降糖激素,通过促进葡萄糖摄取、抑制肝糖异生来维持机体葡萄糖稳态,而胰岛素抵抗是一种无法对胰岛素刺激做出反应的病理状态,导致细胞内糖代谢紊乱[44]。研究发现,NAR可以剂量依赖性地改善胰岛素缺陷型糖尿病小鼠的高血糖,通过抑制内源性和外源性途径抵消链脲霉素诱导的β细胞凋亡且这种保护作用与抑制DNA损伤、NF-κB和MAPK介导的信号传导途径有关[45]。此外,NAR还可改善高脂饮食诱导和2型糖尿病大鼠模型的胰岛素抵抗,调节机体血糖水平[46-47]。
2.5 调节脂质代谢功能
脂质从头生成和甘油-3-磷酸(glycerin-3-phosphate,G3P)途径是机体甘油三酯合成的重要途径,乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪酸合成酶(fatty acid synthetase,FAS)、甘油-3-磷酸酰基转移酶-1(glycerol-3-phosphate acyltransferase-1,GPAT-1)和二酰基甘油酰基转移酶-2(diacylglycerol acyltransferase-2,DGAT-2)分别是脂质从头生成和G3P途径的限速酶[48-50]。研究发现,NAR可逆转果糖喂养大鼠肝脏中碳水化合物反应元件结合蛋白(carbohydrate response element binding protein,ChREBP)、甾醇调节元件结合蛋白-1c(sterol regulatory element binding protein-1c,SREBP-1c)表达的增加,以及它们下游靶点ACC和FAS的表达上调,同时降低GPAT-1和DGAT-2的蛋白水平,抑制脂质从头生成和G3P途径,减少肝脏中甘油三酯产生[51]。NAR通过激活AMPK的mRNA水平及蛋白磷酸化表达,显著抑制其下游ACC、FAS和SREBP-1c的mRNA及蛋白表达,抑制脂质合成[52]。Zhang等[53]研究发现,NAR还可通过下调白细胞分化抗原36(leukocyte differentiation antigen 36,CD36)和ACC降低脂肪酸的摄取和新生脂肪的生成。
AMPK被认为是细胞能量传感器和脂质代谢的调节器,在脂解过程中调节脂解基因激素敏感脂肪酶(hormone-sensitive lipase,HSL)和脂肪甘油三酯脂酶(adipose triglyceride lipase,ATGL)的表达,控制脂质降解[54]。AMPK在脂肪酸β-氧化中可上调过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor α,PPARα)调控的下游基因肉毒碱棕榈酰转移酶1(carnitine palmitoyl transferase 1,CPT1)和酰基辅酶A氧化酶1(acyl-CoA oxidase 1,ACOX1)诱导脂肪酸β-氧化[55]。研究发现,NAR处理可增强肥胖小鼠AMPK的激活,显著提高脂肪组织中脂解限速酶HSL和ATGL的蛋白表达,上调小鼠组织中与脂肪酸β-氧化相关基因CPT1、ACOX1和解偶联蛋白2(uncoupling protein 2,UCP2)的表达,表明NAR通过促进脂肪分解和脂肪酸β-氧化有助于减少脂肪堆积[4]。NAR还可通过增加AMPK和ACC的磷酸化,降低3-羟基3-甲基戊二酰辅酶A还原酶(3-hydroxy 3-methylglutaryl CoA reductase,HMGCR)的表达从而降低3T3-L1脂肪细胞的脂质积累和甘油三酯含量[56]。因此,NAR可通过降低脂质从头生成和G3P途径中关键酶活性及脂肪酸的摄取减少脂质合成,提高脂解途径中酶活性及脂肪酸β-氧化水平促进脂质分解,从而调节机体脂质代谢(图4)。
3 NAR在畜牧生产中的应用
3.1 NAR在家禽生产中的应用
3.1.1 NAR对家禽生长性能的影响
饲粮中添加NAR不仅可提高鸡的生长性能,而且可保护机体免受有毒、有害物质导致的鸡机体损伤。研究发现,在农药福美双诱导的胫骨软骨发育不良的肉鸡饲粮中添加30 mg/kg NAR,不仅可通过下调印第安刺猬蛋白、上调甲状旁腺激素相关肽mRNA和蛋白的表达恢复受损胫骨的发育,而且能够提高肉鸡的采食量和平均日增重;此外,NAR还可提高肝脏抗氧化能力,减轻肉鸡肝脏损伤[57]。Ebirim等[58]研究表明,饲粮中添加80和160 mg/kg NAR显著提高了小公鸡的体重。此外,NAR还显著提高了醋酸铅毒性诱导的公鸡体重下降,缓解了铅中毒导致的GSH-Px、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)和SOD活性下降,并改善了公鸡的抗氧化防御系统及血清NO的生物利用度[58]。胚蛋注射NAR的研究中发现,17.5 d胚龄的胚蛋注射30 mg NAR可显著增加蛋中孵化小鸡的体重和体长,降低胚胎晚期死亡率[59]。然而,Goliomytis等[60]研究发现,饲粮中添加0.75和1.5 g/kg NAR对肉鸡的体重及胴体和内脏质量无显著影响。NAR导致鸡在促增重方面的差异可能归因于不同品种和不同的添加剂量,因此还需进一步研究。
3.1.2 NAR对家禽繁殖性能和产品品质的影响
研究发现,饲粮中添加NAR显著提高了产蛋后期三黄鸡的血清雌激素水平以及雌激素受体蛋白和基因的表达水平,提高了卵黄前体物形成中的关键基因的转录水平,以及通过增加抗氧化物、减少氧化产物,上调肝脏组织中抗氧化基因的转录水平,增强肝脏抗氧化能力来促进卵黄前体的形成和运输[61]。另一项研究表明,饲粮中添加0.1%、0.2%和0.4%的NAR 8周后,可降低产蛋后期三黄种鸡的料蛋比,提高产蛋率和蛋重,改善蛋黄颜色[62]。此外,饲粮中添加0.2%和0.4%的NAR均可提产蛋后期三黄鸡排卵前的排卵数、生长卵泡数、卵巢指数和卵巢体细胞增殖率,且这种作用可能是由于NAR提高了三黄种鸡抗氧化能力,减轻了氧化应激引起的卵泡闭锁[62]。Bao等[63]证实了NAR能够缓解氧化应激诱导的小白卵泡闭锁,并通过降低氧化应激维持衰老母鸡的产蛋性能。除以上生长和繁殖性能外,饲粮中添加NAR还可提高鸡蛋和屠宰后鸡胴体的抗氧化能力,延长畜产品的货架期。研究表明,NAR能通过减少饱和脂肪酸和增加多不饱和脂肪酸含量改善肉鸡脂肪酸谱,且其对脂肪酸的作用可能是通过调节肝脏中PPARα和ACOX1的表达来增加脂肪酸β-氧化而介导的[64]。在肉鸡饲粮中添加1.5 g/kg NAR对鸡肉的pH、肉色、剪切力和蒸煮损失无影响,却显著降低了鸡肉储存期间(4 ℃下6和9 d,-20 ℃下120 d)MDA的含量,并且其抗氧化效果与维生素E相当[60]。此外,在蛋鸡饲粮中添加0.75 g/kg NAR,提高了鸡蛋的氧化稳定性,延长了鸡蛋的货架期,并可改善蛋黄颜色[65]。
3.2 NAR在猪生产中的应用
NAR可提高仔猪的生产性能,改善育肥猪肉品质和氧化稳定性。在仔猪饲粮中添加NAR可显著提高整个试验期(25~66日龄)的体重和饲料转化率,提高仔猪的生产性能[66]。此外,NAR还显著提高了磷、丙氨酸、天冬氨酸、亮氨酸、赖氨酸和总氨基酸的表观盲肠前消化率[66]。在育肥猪饲粮中添加0.5 g/kg NAR显著提高了猪的眼肌面积和瘦肉含量,且添加剂量为1.5 g/kg时显著提高了背最长肌pH45 min、肌苷酸含量以及SOD活性和总抗氧化能力,并提高了肝脏SOD和GSH-Px活性[67],表明NAR不仅可改善育肥猪的胴体特性,还可提高猪肉氧化稳定性和品质。此外,在猪里脊肉中添加1、3、5和7 g/kg的NAR改变了肉色的光学指标,并且添加5 g/kg NAR可显著提高猪肉的亮度和红度值,降低黄度值,改善新鲜感官度[68]。
3.3 NAR在反刍动物生产中的应用
反刍动物生产常通过提高饲粮的精料比例来提高生产性能。然而,高精料常导致瘤胃pH下降,并引起瘤胃酸中毒等一系列代谢性疾病。因此,如何缓解高精料造成代谢性疾病的发生是反刍动物生产中面临的重大问题。研究发现,在高精料饲粮中添加0.5 g/kg NAR显著提高了山羊瘤胃pH和丁酸比例,降低了戊酸比例和乳酸浓度,缓解了因高精料饲粮导致的瘤胃内环境稳态失衡和瘤胃酸中毒[69]。此外,NAR还显著降低了山羊血清IL-6和淀粉样蛋白A含量,缓解了高精料饲粮诱导的炎症反应,显著提高了血清GSH-Px活性,降低了血清MDA含量,改善了高精料饲粮诱发的氧化应激[69]。Balcells等[70]同样研究证明,饲粮中添加生物黄酮(主成分为NAR)可有效改善饲喂高精料饲粮的小母牛瘤胃发酵,并降低瘤胃酸中毒的发生率。
热应激可降低动物体抗氧化状态和免疫反应并引起机体氧化应激和炎症,降低反刍动物生产性能[71-72]。Alhidary等[73]研究发现,给予热应激羔羊7 g/周NAR,显著提高了羔羊的平均日增重和饲料转化效率,改善了羔羊的生产性能;给予14 g/周NAR显著提高了血浆SOD和GSH-Px活性,增强了机体的抗氧化状态。此外,补充NAR增加了注射植物血凝素24 h后羔羊的皮褶厚度,改善了机体细胞免疫[73]。
反刍动物饲粮中添加NAR还可提高肉和乳的抗氧化能力。研究发现,羔羊饲粮中添加2.5 g/kg的NAR对肉的pH、肉色、持水力、剪切力和蒸煮损失均无显著影响,但延缓了冷藏条件下羔羊胸最长肌中的脂肪氧化,提高了肉的抗氧化能力[74]。此外,在母羊饲粮中添加6 g/kg NAR提高了羊乳的氧化稳定性,且作用效果与维生素E相当,并对乳样的化学成分、凝固特性和脂肪酸组成无影响[75]。
4 小 结
在“无抗”背景下,NAR作为天然植物饲料原料陈皮、枳壳和骨碎补的主要成分,不仅具有多种生物学功能,而且可提高畜禽的生产性能、繁殖性能和改善畜产品品质,可见其具有较好的应用前景。但目前关于NAR在畜禽生产中的研究相对较少,且集中在家禽生产上,在猪和反刍动物上的研究匮乏。这就导致NAR在畜禽生产中的研究不够系统和深入,不能明确同品种不同生长阶段或不同品种畜禽的最适添加剂量及作用效果。因此,未来应加强开展NAR在畜禽生产上的研究,为饲料禁抗背景下NAR在畜禽生产上的应用和推广提供依据。

