植物活性成分诱导动物细胞自噬的研究进展
李菲菲 童津津 方洛云 蒋林树
(北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206)
动物机体健康状况与生产性能和经济效益密切相关。在实际生产中,畜禽机体极易发生炎症和氧化应激,增加饲养难度,导致动物生产性能下降,产品品质降低,甚至死亡率增高。动物机体内有一套完整的自我防御体系,自噬调节是一种高度保守的先天性免疫,具有消除细胞质异物、清除入侵病原微生物等生物学功能,对各种组织的发育和分化具有极其重要的作用[1]。本文以自噬调节的分子机制、细胞自噬与动物健康的关系及植物活性成分对动物细胞自噬的调控作用为主题,结合近几年国内外研究进展进行综述,以期为动物疾病的防治提供新的思路和方法。
1 自噬调节的分子机制
1.1 自噬调节
自噬调节是动物机体一种存在广泛且保守型的先天性免疫,是真核细胞中普遍存在的一种降解机制,是细胞维持自身生存非常关键的修复途径之一[2]。在自噬相关蛋白的调控下,自噬利用溶酶体降解自身受损的细胞器、大分子物质及入侵的微生物,来实现细胞本身的代谢需要、某些细胞器的更新以及抵抗病原微生物的感染,从而维持细胞内环境稳定及细胞的完整性[3]。自噬调节是一种受多条通路[如磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/丝苏氨酸蛋白激酶(serine-threonine kinase,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、丝裂原活化蛋白激酶(MEK)1/2-蛋白激酶(ERK)1/2和单磷酸腺苷活化蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)/ULK1(unc-51 like autophagy activating kinase 1)等]以及自噬相关基因 (autophagy related gene,Atg)5、Atg7、Atg12等40余种蛋白共同调控的细胞机制[4]。
1.1.1 自噬调节的分类
自噬是一种依赖溶酶体降解途径的免疫机制,具有多方面的免疫生物学功能。免疫系统的发育、先天和适应性免疫、炎症反应、细胞内微生物选择性降解以及机体对病原微生物的免疫反应,都离不开自噬调节的作用[5]。根据自噬是否依赖自噬相关蛋白和经典通路,将其分为经典性自噬和非经典性自噬。其中,经典性自噬又根据其对底物的运输方式和底物类型的差异分为巨自噬、微自噬和分子伴侣介导性自噬[6]。巨自噬是研究较多的一种自噬,由线粒体、内质网、高尔基体或质膜的双层膜结构发生延伸,将受损的细胞器与健康的细胞器分离,形成自噬体,最终自噬体与溶酶体融合形成自噬溶酶体,将受损细胞器降解。有研究表明,缺失自噬相关蛋白Atg16L1的小鼠,其胎肝巨噬细胞经脂多糖(lipopolysaccharide,LPS)处理后,半胱氨酸天冬氨酸酶-1(cysteinyl aspartate specific proteinase-1,Caspase-1)活化和白细胞介素-1β(IL-1β)分泌增加,表明自噬可负向调节炎症小体激活和炎症因子分泌[7];微自噬指溶酶体直接将细胞内的异物吞噬;分子伴侣介导性自噬是一种选择性降解机制,通过伴侣介导的自噬受体溶酶体相关膜蛋白将细胞内物质递送至溶酶体进行降解[8]。研究发现,促进脂肪吞噬和分子伴侣介导的自噬可以保护肝细胞免受脂肪毒性[9]。随着研究的不断深入,除了常见的几种自噬类别外,还存在一些对底物降解选择专一的形式,如线粒体自噬、过氧化物酶体自噬、聚集体自噬、内质网自噬和核糖体自噬等[10]。最近,发现Atg8蛋白的自噬独立性的功能,导致其吞噬底物时可以采取降解或分泌等不同方式,称为非经典性自噬。非经典性自噬的形式有降解性自噬、分泌性自噬和循环自噬等[11]。非经典性自噬目前研究报道较少,可能成为未来研究的新热点。
1.1.2 自噬调节的利与弊
自噬是一种保守性高的自我消化过程,对不同病原体的作用机制存在个体差异性,具有不同的影响[12]。Berton等[13]研究发现,在结核分枝杆菌和李斯特菌的降解中,自噬作为一种先天性的免疫反应途径,限制其在细胞质中的复制与存活;此外,有研究报道,布鲁氏菌可以针对性地选择自噬起始复合物,将其菌液泡转换为具备自噬特征的液泡,逃避宿主的免疫清除,继而复制感染,导致持续性、慢性疾病的发生[14]。
自噬在某些疾病中对机体可起到保护作用,但在某些细菌病毒中则起到相反作用。研究发现,利用饥饿诱导自噬从酵母菌到大猿的几种动物模型中,可延长其寿命,有利于动物机体的健康[15]。在阿尔兹海默症小鼠模型的大脑中,发现线粒体自噬受损,利用尿石素A(urolithin A,UroA)诱导线粒体自噬后,显著减少阿尔兹海默症小鼠模型大脑中细胞外β-淀粉样蛋白(β-amyloid,Aβ)的产生、抑制微管相关蛋白(microtubule-associated protein,Tau)包涵体的过度磷酸化,从而改善阿尔兹海默症小鼠的神经炎症水平和认知障碍,达到神经保护的作用[16]。然而,研究发现布鲁氏菌可以变异进化出完全的机制,来逃避自身自噬调节的吞噬,并通过劫持自噬成分Atg9和WIPI(Wireless Internet Platform for Interoperability)蛋白来实现促进其在细胞内的繁殖与复制[17]。此外,当猪肾脏细胞(PK15)感染浓度为50%的猪圆环病毒(PCV2)1 h时,可诱导自噬体形成,自噬通量增加,促进病毒复制[18]。因此,自噬是一把“双刃剑”,对宿主是利还是弊,取决于病原体、宿主物种等条件。
1.2 自噬调节的发生机制
自噬的激活与抑制是一个复杂的过程,受到多种自噬相关蛋白与信号通路的调控。据报道,自噬发生的过程如图1所示,首先,双层膜结构发生延伸,将受损的细胞器与健康的细胞分离;其次,双层膜将受损的细胞器包裹,并形成自噬体;最后,自噬体与溶酶体相融合,形成自噬溶酶体,通过溶酶体蛋白达到降解受损细胞器的目的[19]。自噬体能够吞噬各种形状、大小不一的细胞物质,从几纳米的蛋白质寡聚体到整个细菌[20]。目前已发现与自噬相关的蛋白有40多种,主要包括Beclin1、微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)、p62、mTOR、AMPK等,自噬体的形成与18种相关蛋白有着密切联系,其中LC3和p62是自噬标志性的蛋白,可作为自噬体形成和自噬通量的标志物[21]。
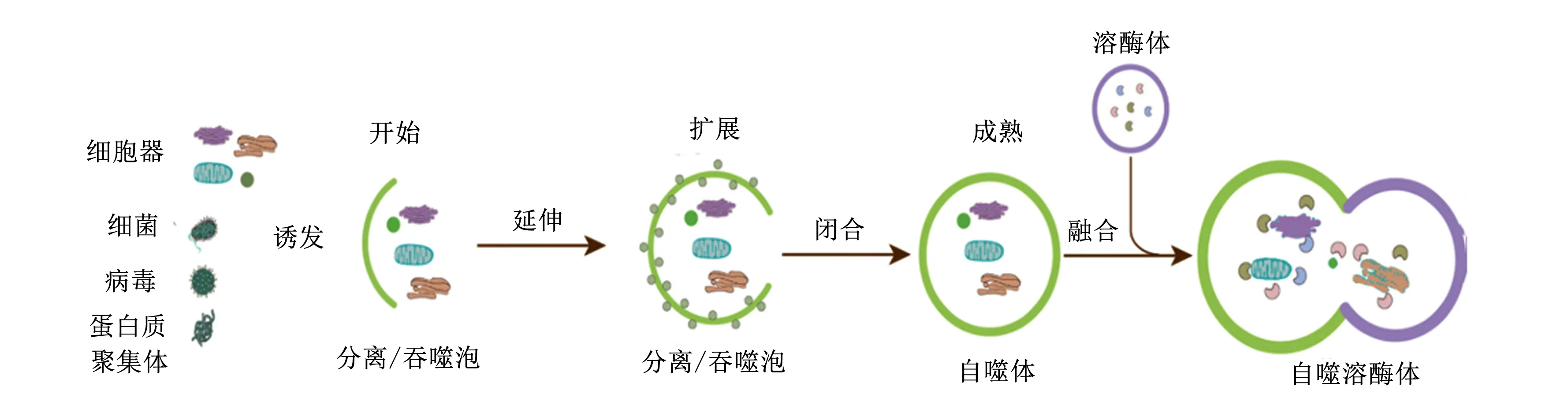
图1 自噬发生的过程
Beclin1由BECN1基因所编码,与Ⅲ类磷脂酰肌醇3激酶(class Ⅲ PI3K,PI3KC3,又称Vps34)相互作用,参与早期自噬诱导过程,在自噬体的形成过程中起关键作用[22]。正常情况下,Beclin1含有与B淋巴细胞瘤-2(Bcl-2)结构域同BH3结构域,使其可与Bcl-2及Bcl-xl的BH3受体结构域相结合,从而减弱Beclin1与Vps34的相互作用,抑制自噬激活[23]。LC3是哺乳动物细胞中最早鉴定的自噬小体定位蛋白之一,参与自噬体的形成[24]。LC3通过脂质化修饰获得膜结合能力,靶向细胞内的吞噬体和溶酶体等多种单层膜结构,主要促进吞噬体-溶酶体的融合[25]。p62是一种泛素结合蛋白,促进多泛素化蛋白聚集物的周转,对于泛素化聚集体的形成及运输至关重要。它是选择性自噬中发挥重要作用的接头蛋白,可调控溶酶体降解途径,在细胞自噬过程中充当底物,并通过自噬途径降解[26]。mTOR是一种丝氨酸/苏氨酸蛋白激酶,由mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)组成,与上游分子PI3K发生反应,是自噬的主要负调节因子[27-28]。AMPK和p53信号通路抑制mTOR通路,促进自噬的发生[29]。
在乳腺癌裸鼠模型中,当自噬发生时,LC3-Ⅱ参与自噬泡膜的延伸,Beclin1促进自噬体的形成并募集其他Atg相关蛋白。研究发现,每天给小鼠腹腔注射5 mg/kg的白头翁皂苷D后,p62在自噬通量不足的情况下大量积累,阻止泛素化的蛋白质被运转到溶酶体,进而抑制自噬降解的进程[30]。因此,自噬发生时相关蛋白LC3、Beclin1等表达水平升高,p62表达水平下降;反之,则表现为自噬活性受到抑制,自噬受损。
1.2.1 PI3K/Akt/mTOR信号通路
细胞自噬调控通路中的关键蛋白包括mTOR、ULK1、Beclin1、p62、LC3等,mTOR是细胞自噬的关键靶点,可调节细胞内蛋白质的合成与降解、能量代谢和细胞的增殖与凋亡。给大脑动脉闭塞的大鼠胃内给药10 mL/kg黄芪红花合物后,PI3K被活化,催化磷脂酰肌醇二磷酸酯(PIP2)向磷脂酰肌醇三磷酸酯(PIP3)转化,AKT转位到细胞膜,结构发生变化并发生双重磷酸化。活化的Akt磷酸化结节性硬化症复合体复合物解除其对下游mTOR活性的抑制作用,激活mTOR。活化后的mTOR可磷酸化ULK1与自噬相关蛋白Atg13,进而抑制ULK1-Atg13-200 kDa的家族相互作用蛋白(family interacting protein of 200 kDa, FIP200)复合体的形成,阻碍自噬的发生[31]。
同时有研究表明,对阿尔兹海默病的小鼠,每天1次向各组小鼠腹膜内分别注射10、20、40 mg/kg黄芪甲苷(astragalin,AST),持续1个月,可通过降低PI3K/Akt/mTOR通路相关蛋白的磷酸化水平,促进小鼠海马神经元自噬体形成和自噬溶酶体降解,从而减轻小鼠海马神经元损伤和认知障碍,缓解阿尔兹海默病症状[32]。此外,将人中枢神经系统多形性胶质母细胞瘤(GBM)细胞系U87以1×107/0.1 mL皮下植入小鼠的右胁腹中,12 d后当肿瘤体积达到约100 mm3时,每天1次分别用青藤碱衍生物sino-wcj-33(SW 33)(30和60 mg/kg)灌胃治疗,持续3周。结果表明,SW33可显著降低线粒体膜电位并诱导GBM发生细胞凋亡,通过促进吞噬体和溶酶体的融合过程,调节PI3K/Akt/mTOR和AMPK/mTOR信号通路诱导GBM细胞自噬,从而抑制GBM细胞的迁移、侵袭和增殖[33]。
1.2.2 转录因子EB(transcription factor EB,TFEB)
TFEB是碱性螺旋-环-螺旋黑素细胞诱导转录因子(melano-cyte inducible transcription factor,MITF)或转录因子增强子家族(transcription factor enhancer family,TFE)成员,是溶酶体生物合成和自噬的主要调节因子,可与自噬基因的启动子区结合,诱导自噬体的合成[34]。在正常环境下,TFEB被磷酸化并滞留在细胞质中,当受到刺激时,TFEB去磷酸化进入细胞核,诱导下游自噬和溶酶体等相关基因的表达[35]。研究表明,将小鼠巨噬细胞用80 μg/mL氧化低密度脂蛋白(oxidized low-density lipoprotein,OX-LDL)作用24 h转化为泡沫细胞,以建立动脉粥样硬化模型,分别加入200、400、800和1 000 μg/mL的褐藻糖胶,孵育24 h。褐藻糖胶可以通过上调TFEB表达促进自噬,从而发挥其降血脂作用,减少泡沫细胞中的脂质积聚,成为治疗动脉粥样硬化的新靶点[36]。同时,有研究证明,应用3 mg/kg鱼藤酮构建小鼠帕金森病(PD)模型,可引起多聚腺苷二磷酸核糖聚合酶-1(PARP-1)过度激活,从而促进TFEB丝氨酸211的磷酸化,进而阻断TFEB诱导的自噬,促进NLRP3介导的炎症反应[37]。综上所述,TFEB作为转录因子,在自噬调节过程中发挥不可或缺的作用。
1.2.3 ULK1相关通路
ULK1是自噬关键蛋白中唯一1个具有丝氨酸/苏氨酸激酶酶活性的蛋白,在自噬溶酶体形成之前,ULK1、Atg13、FIP200组成的复合物活化介导自噬相关信号通路[38]。ULK1复合物是上游营养和自噬体形成之间的桥梁,磷酸化的ULK1是自噬过程中一个关键调控因子[39]。在机体营养充足的条件下,mTOR与ULK1的色氨酸相结合,从而抑制ULK1与AMPK之间的相互作用,导致ULK1失活,关闭自噬信号通路;在饥饿或病原微生物侵袭等应激刺激环境下,AMPK被活化,通过磷酸化抑制mTORC1的活性,进而使mTOR失活,活化的AMPK催化ULK1的色氨酸发生磷酸化,以达到启动自噬发生的目的[40]。受到饥饿刺激的小鼠,体内AMP激活AMPK,进而磷酸化ULK1,促进Beclin1-Vps34复合物的形成,募集跨膜蛋白Atg9点位于早期自噬体组装的位点,诱导自噬的发生,保护机体免受损伤[41]。
1.2.4 Atg相关基因
细胞自噬除受以上自噬调节相关通路调控,一些自噬相关基因Atg也参与自噬的调节进程。酮病奶牛的乳腺组织发生氧化应激,自噬在乳腺的氧化损伤过程中能够被活性氧(ROS)所激活。首先双层膜延伸,将受损的细胞器与健康细胞器分离,包被受损细胞器,形成自噬体。调控自噬体形成的相关基因包括:Atg12、Atg5和LC3等[42]。Atg5、Atg12形成的基础是Atg7和Atg10形成硫酯中间体,与Atg5发生偶联反应后,Atg5与Atg12再与Atg16形成一个更大的复合体。该复合物在体内Atg8-磷脂酰乙醇胺(PE)形成过程中必不可少,Atg12-Atg5缀合物也可以体外刺激Atg8-PE的形成[43]。Atg12-Atg5-Atg16复合物还可以通过参加LC3-PE缀合过程或者直接与膜结合来调控自噬体膜的形成[44]。其中,Atg5是一个重要的调节因子,是细胞自噬与凋亡的分水岭。一方面Atg5参与自噬体的形成,调节自噬;另一方面Atg5的过表达会降低细胞活力,诱导细胞凋亡[45]。用0或者1.2 mmol/L的血液中非酯化脂肪酸(NEFA)处理体外培养的奶牛乳腺上皮细胞(BMECs)24 h,分别添加0、100、200 μmol/L的荷叶碱(nuciferine,NF)处理12 h,可增加LC3-Ⅱ的蛋白表达。LC3是自噬体形成过程中的关键蛋白,其羧基段被Atg4酶切后可形成LC3-Ⅰ,LC3-Ⅰ在Atg3和Atg7相互作用下,与PE反应,最终形成LC3-Ⅱ,与p62相互作用,最终将需要降解的自噬内容物转运至自噬溶酶体中,缓解BMECs的氧化损伤[46]。
综上所述,自噬的发生受到多种相关蛋白和通路所调控,过度或异常的自噬都会引起细胞功能的紊乱,导致疾病的发生。正常的自噬调节可回收受损的蛋白质、细胞器和聚集体,调节细胞线粒体的功能,清除受损的内质网和过氧化物酶体,有助于清除体内废物,提供能量,并有可能成为癌症、神经退行性疾病和其他慢性疾病的治疗靶点。
2 细胞自噬与动物健康的关系
自噬作为细胞代谢的重要一环,是机体内的“智能回收站”,承担处理异常、冗余物质并为再造新分子提供材料的任务,帮助维持机体内的稳态平衡。它可以清除细胞内病原体,增强免疫系统功能,防御错误折叠的有毒蛋白质对健康组织和器官的损害,促进动物机体健康。
2.1 自噬与应激损伤
饲养环境、气候等条件的突然变化,免疫刺激等因素均可引起动物机体发生应激损伤,导致动物体温升高、呼吸困难、消瘦、脱水等症状。病理上表现为肾上腺出血、胃肠黏膜出血、溃疡或糜烂,严重会导致动物死亡。自噬可回收受损细胞器、调节线粒体功能,有助于清除机体内废物,增强机体免疫能力,缓解动物机体应激损伤。氧化应激是最常见的应激损伤之一,当动物机体受外界因素影响或自身生理活动调节紊乱时,细胞内产生大量的氧自由基无法及时清除,氧化-抗氧化动态失衡,导致氧化应激发生[47]。目前,研究表明,细胞的氧化状态与其自噬调节密切相关。一方面,脂质过氧化产生的ROS是细胞自噬重要的调控因子,可通过PI3K/Akt/mTOR、AMPK/ULK1等通路激发自噬缓解氧化应激损伤,达到保护细胞的作用;而另一方面,当ROS刺激超过一定时间或强度时,可阻断自噬进程,造成细胞损伤[48]。
研究发现,临床发生酮病的奶牛乳腺组织中超生理水平的游离脂肪酸(FFA)会引起乳腺组织发生氧化损伤。低浓度的FFA(0.6 mmol/L)可激活自噬通路,缓解氧化应激;而较高浓度的FFA(1.2 mmol/L)则可抑制自噬,加剧氧化损伤[49]。何忻宜等[50]利用高糖及小鼠巨噬细胞共培养研究成骨细胞氧化应激及自噬的影响,结果表明,大量的葡萄糖导致了ROS的产生和蓄积,引起成骨细胞线粒体功能损伤,细胞自噬随之被激活,在35 mmol/L葡萄糖的高糖环境下,自噬一定程度上可缓解细胞的氧化应激压力,但当压力超过临界点时间或强度时,凋亡和非凋亡致死程序则被激活,最终导致细胞死亡。据报道,当氧化应激发生时,机体细胞产生大量的ROS与第10号染色体缺失的磷酸酶和张力蛋白同源物(PTEN)氧化失活密切相关,进而增强PI3K/Akt/mTOR信号传导活性,通过mTOR间接方式调节自噬[51]。此外,ROS还可以激活腺苷单磷酸活化蛋白激酶/过氧化物酶体增殖物激活受体-γ/核转录因子-κB(AMPK/PPAR-γ/NF-kB)通路,增加Beclin1的表达量,以及LC3Ⅱ/LC3Ⅰ和p62比率,来调控自噬的发生,引起细胞凋亡[52]。自噬可以通过线粒体的吞噬作用来消除受损的线粒体,使其无法产生大量的ROS蓄积[53]。自噬调节与氧化应激之间存在复杂的相互作用,这种关系对细胞在多种生理条件和各种病理环境的反应中起着重要的作用。
2.2 自噬与炎症
自噬是细胞维持正常生命活动的重要手段,参与各种炎症反应和屏障修复[54]。炎症小体是机体受到病原菌和内源性刺激时胞浆应答的产物,是由病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)激活的胞质炎症信号复合物,炎症小体蛋白水解激活白细胞介素-1β(IL-1β)并诱导其分泌促炎性细胞因子,自噬可以通过抑制炎症小体的形成来缓解炎症[55]。在利用LPS诱导小鼠单核巨噬细胞(RAW264.7)建立的炎症模型,将三百棒(TAAE)醇提物配制成溶液,给予不同浓度(0、0.25、0.50、1.00 mg/mL)TAAE于炎症模型中,药物作用2 h后,各药物干预组再加入1 μg/mL的LPS,干预24 h。结果发现,TAAE通过抑制PI3K/Akt/mTOR信号通路,促进自噬泡的形成、自噬体溶酶体融合和降解,Beclin1、Atg5和LC3Ⅱ/LC3Ⅰ的蛋白表达量逐渐增加,底物p62蛋白表达量逐渐降低,同时炎症相关蛋白表达降低[56]。
在金黄色葡萄球菌感染的细胞模型中,加入适量的硒可促进细胞的自噬调节,从而有利于清除金黄色葡萄球菌,抑制其在胞内增殖,并能显著抑制NF-κB和MAPK信号通路的关键蛋白的表达水平,最终达到抑制炎症的目的[57]。在视黄酸受体2(RARRES2)对奶牛乳腺上皮细胞炎症影响的试验中,RARRES2可显著提高自噬关键蛋白的含量,激活自噬调节,从而与先天免疫系统相互调节,消除内源性炎症小体及其对相关炎性信号的分泌,以达到调节炎症的目的。自噬还可以通过调控免疫细胞分化来调控炎症反应,在巨噬细胞中自噬相关蛋白具有调节吞噬物质的功能,以达到维持细胞增殖和代谢稳态的目的[58]。
3 植物活性成分对动物细胞自噬的调控作用
植物活性成分指构成植物体内的物质除水分、糖类、蛋白质类、脂肪类等必要物质外,还包括其次生代谢产物(如萜类、黄酮、生物碱、甾体、木质素、矿物质等),这些物质对生命机体具有生理调节作用,且因其疗效与安全性,在畜牧业越来越受到关注。例如,黄芪长期被广泛用作药物和食品,其主要活性成分为AST,具有抗炎、抗氧化、降血糖和免疫调节等药理作用。研究发现,AST能通过抑制PI3K/Akt/mTOR通路,上调LC3Ⅱ/LC3Ⅰ和Beclin1水平,降低p62水平,进而激活自噬,减轻肾脏功能损害,减少糖尿病肾病大鼠的足细胞凋亡[59]。此外,黄芪和红花组合(HQ-HH)可以激活PI3K/Akt/mTOR信号通路,并抑制大鼠自噬,防止肠道微生物结构变化,预防缺血性卒中后肠道菌群失衡[31]。在鸡饲粮中添加黄芩苷后可通过核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)信号通路调控自噬,减轻鸡毒支原体诱导的巨噬细胞炎症反应[58]。而且,研究发现黄连素(BBr)可激活猫肠中的mTORC和自噬,促进肠上皮细胞增殖,维持细胞代谢,恢复肠屏障功能,改善肠道微生物的稳态[60]。
在LPS诱导的小鼠软骨细胞炎症模型中,添加槲皮素可激活细胞自噬,促进自噬标志性蛋白LC3Ⅱ的表达,同时抑制自噬底物受体蛋白p62的过度表达,从而促进LPS诱导的软骨细胞增殖,使其外基质合成与代谢达到平衡,抑制炎症反应,恢复细胞功能[61]。陈家涟等[62]证实,巴西木素可增加纤维滑膜细胞的自噬小体积累,提高LC3Ⅱ表达水平,从而降低炎性因子水平。此外,研究发现,姜黄素可通过调节沉默调节蛋白1(Sirtuin 1,SIRT1)/mTOR信号通路,诱导大鼠自噬激活,上调LC3Ⅱ蛋白表达,降低促炎因子的分泌,从而治疗葡聚糖硫酸钠诱导的溃疡性结肠炎[62]。
肠道菌群在维持动物健康过程中具有重要作用。当菌群失调时,会引起显著的生理变化,导致多种疾病。通常上调自噬相关蛋白的表达水平,可抑制促炎因子分泌,调节菌群平衡。连翘黄酮可调节自噬相关蛋白Beclin1和LC3Ⅱ的表达水平,进而促进巨噬细胞自噬发生,提高肠黏膜的免疫水平,改善炎症症状,调节肠道菌群,恢复肠黏膜保护屏障[63]。中药芍药的主要活性成分是芍药苷,具有抗炎、抗溃疡、调节免疫的作用。在溃疡性结肠炎的小鼠模型中添加芍药苷,可提升小鼠结肠组织LC3Ⅱ/Ⅰ蛋白表达水平,下调p62蛋白表达,并有效抑制mTOR,降低结肠组织促炎细胞因子的mRNA转录水平,恢复肠道菌群的丰度[64]。综上所述,以自噬相关蛋白LC3Ⅱ、Beclin1、p62为治疗靶点,调节自噬,可能提升肠黏膜的免疫强度,抑制炎症反应,保持肠道菌群稳定,恢复肠道黏膜的保护屏障。
由此可见,植物的活性成分大部分可以通过调节信号通路,诱导自噬发生,进而调节改善机体病症。植物活性成分疗效好,安全性高,越来越受到畜牧业的关注,也为生产中动物疾病预防与治疗提供了新方法和新思路。
4 小 结
自噬和动物机体之间存在复杂的相互作用,在生产过程中的各个阶段均对动物机体产生重要的影响,通过添加植物活性成分对机体自噬的调节,利用动物机体自身免疫对生产中动物疾病进行防治,更有利于畜牧业健康、绿色发展。但是,针对不同病原体、宿主条件,自噬是一把双刃剑。目前,自噬调节对一些病原微生物侵入机体后的作用机制还尚不清楚,未来的研究对于促进了解细胞感染机制及其对动物健康影响的理解是必要的,也是后续研究的重点与难点。

