蜂巢小甲虫OBP4的克隆及表达谱分析
李良斌,武丽仙,许雅静,3,刘家莉,赵红霞*
(1.华南农业大学植物保护学院,广州 510642;2. 广东省科学院动物研究所,广东省野生动物保护与利用公共实验室,广东省动物保护与资源利用重点实验室,广州 510260;3. 福建农林大学动物科学学院(蜂学学院),福州 350002)
蜂巢小甲虫Aethinatumida属鞘翅目Coleoptera露尾甲科Nitidulidae,是一种世界范围内的入侵性害虫,于2017年入侵我国广东省,对当地的养蜂业造成了严重损失(张明明等, 2021)。蜂巢小甲虫成虫和幼虫均以蜂蜜和花粉为食,争夺蜜蜂幼虫的食物,严重时会导致蜜蜂发生逃群现象;同时还会导致蜂蜜发酵,巢脾发臭等一系列后果,严重影响蜂群健康和蜂产品品质(Neumannetal., 2004)。蜂巢小甲虫的幼虫在发育到13~14日龄左右,就会进入游走期,爬出蜂箱,寻找化蛹场所,待羽化为成虫后继续飞回蜂巢内产卵(Neumannetal., 2013)。
昆虫嗅觉系统在许多生理和行为活动中发挥着重要作用,如寻找合适的寄主、食物来源、产卵地点和交配伙伴(Breer, 2003)。昆虫的外周嗅觉系统负责识别和转运外部的气味分子,将化学信号转化为电生理信号;中枢神经系统负责传导电生理信号并引起昆虫的气味识别反应(Britoetal., 2016)。嗅觉系统是一个极其复杂的通路,涉及多种蛋白质,包括气味结合蛋白(odorant-binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)、气味降解酶(odorant degrading enzymes, ODEs)、气味受体(odorant receptors, ORs)和感觉神经元膜蛋白(sensory neuron membrane proteins, SNMPs)(杜亚丽等, 2020)。
OBP是一类小分子水溶性蛋白,大量存在于嗅觉感受器的淋巴液中,承担着识别外界气味物质并将其结合转运到气味受体OR上的功能(Fanetal., 2011)。最初,在鳞翅目中,OBPs依据基因功能和氨基酸序列的同源性分类为普通气味结合蛋白(general odorant binding proteins,GOBPs)、信息素结合蛋白(pheromone binding protein,PBP)和触角特异性结合蛋白(antennal binding proteins,ABPs),但是该方法在其他昆虫中并不适用;根据OBPs含有保守半胱氨酸(Cys)的数量可以分为Classical OBPs,Minus-C OBPs,Plus-C OBPs,Dimer OBPs和Atypical OBPs(Rihanietal., 2021)。昆虫OBP的数量也大不相同,随着基因组和转录组测序的发展,先后在桔小实蝇Bactroceradorsalis、飞蝗Locustamigratoria和德国小镰Blattellagermanica等昆虫中鉴定出多个OBPs(Guoetal., 2018; Liuetal., 2020; Heetal., 2022)。但是目前关于蜂巢小甲虫的OBPs研究还相对欠缺,笔者通过搜索蜂巢小甲虫的基因组数据库和转录组数据库,并首次克隆得到一个新的OBP基因,将其命名为AtumOBP4,通过qRT-PCR分析了该基因的表达模式,为深入研究AtumOBP4基因在蜂巢小甲虫嗅觉识别过程中的功能奠定基础,也为以OBP为分子靶标防治蜂巢小甲虫提供新思路。
1 材料与方法
1.1 供试昆虫
试验用蜂巢小甲虫由广东省科学院动物研究所蜜蜂中心人工饲养,成虫和幼虫均以蜂蜜、茶花花粉1∶2配比混合后的蜂蜜花粉糊饲喂,饲养条件为温度28±2℃,相对湿度75%~80%,光周期0 L∶24 D(Wuetal., 2021)。
1.2 主要试剂和仪器
Total RNA提取试剂盒RNAex Pro Reagent、cDNA第一链合成试剂盒EvoM-MLV RT Mix Kit With gDNA Clean for qPCR、荧光定量试剂盒SYBR Green Priemix Pro Taq HS qPCR Kit等试剂均购于湖南艾科瑞(AG)生物工程有限公司;胶回收试剂盒E.Z.N.A Gel Extraction Kit购于OMEGA公司;PCR反应试剂2×Es Taq MasterMix购自北京康为世纪生物科技有限公司;克隆载体pEASY-T3 Cloning Kit、表达感受态BL21(DE3)和克隆感受态细胞Trans1-T1均购于北京全式金生物有限公司;同源重组试剂盒ClonExpress©II One Step Cloning Kit购于Vazyme公司;内切酶Not I和EcoR I购于Takara公司;梯度PCR仪和实时荧光定量PCR仪CFX ConnectTMOptics Module由美国BIO-RAD公司生产,紫外凝胶成像分析系统由上海天能科技有限公司生产,研磨仪CRINDER GT100由北京格瑞德曼仪器设备有限公司生产,冷冻离心机Sigma 3K15由Sigma公司生产,紫外分光光度计由BIONANO由美国赛默飞世尔科技公司生产。
1.3 总RNA提取及cDNA的合成
收集蜂巢小甲虫卵、幼虫、蛹和雌雄成虫;解剖蜂巢小甲虫羽化后第7天的头部、表皮、鞘翅、足部、脂肪体、肠道、马氏管、精巢和卵巢共9个组织部位;另外,收集羽化后不同日龄(1~8 d)蜂巢小甲虫的头部。每15个样本作为一个生物学重复,共设3个生物学重复。将收集的样本置于液氮中速冻并研磨,参照RNAex Pro Reagent试剂盒说明书提取总RNA。以1 μg RNA为模板参照EvoM-MLV RT Mix Kit With gDNA Clean for qPCR反转录试剂盒说明书合成cDNA,-20℃保存。
1.4 AtumOBP4基因的克隆
搜索蜂巢小甲虫转录组(Wuetal., 2021)和基因组数据库(Evansetal., 2018)得到蜂巢小甲虫OBP序列,使用Primer Premier 5.0软件设计引物(表1)。以文中1.3部分合成的第7天蜂巢小甲虫头部cDNA为模板,克隆蜂巢小甲虫OBP基因的开放阅读框序列。PCR反应体系(50 μL):PCR Mixture 25 μL,cDNA模板1.0 μL,上下游引物(10 μmol/L)各1.0 μL,ddH2O 22 μL。PCR反应条件:98℃预变性1 min;98℃变性30 s,55℃退火1 min,72℃延伸1 min,35个循环;72℃终延伸10 min。PCR产物采用1%琼脂糖凝胶电泳验证,并将符合预期大小的目的片段纯化,并连接到pEASY-T3载体上,转化至大肠杆菌Trans1-T1感受态细胞中,37℃培养12 h,菌液PCR验证后,挑选3管送生工生物测序。

表1 本试验所用引物
1.5 AtumOBP4基因的序列分析
将克隆测序得到的蜂巢小甲虫OBP序列在NCBI中用Blastn(http://blast. ncbi.nlm.nih. gov/Blast.cgi)工具进行核酸序列的同源性分析;利用在线软件ORF Finder(http://www.ncbi. nlm.nih.gov/gorf/gorf.html)查找序列的开放阅读框,用DNAMAN软件预测其编码的氨基酸序列。运用在线工具NCBI Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析保守结构域;运用在线工具TMHMM-2.0对AtumOBP4进行跨膜结构的预测,利用在线网址Swiss-model为模板进行AtumOBP4三维结构预测;利用NCBI在线工具Constraint-based Multiple Alignment(https://www.ncbi.nlm.nih.gov/tools/cobalt/cobalt.cgi)进行氨基酸多序列比对,采用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树,Bootrap为1 000次。
1.6 AtumOBP4的时空表达
以文中1.3部分中得到的cDNA为模板,选取GAPDH作为内参基因,利用Primer Premier 5.0设计定量引物(表1),委托生工生物工程(上海)股份有限公司进行合成。使用SYBR Green Priemix Pro Taq HS qPCR Kit试剂盒进行荧光定量PCR。反应体系(20 μL):cDNA模板3 μL,SYBR Premix Ex TaqTMⅡ(2×)10 μL,上下游引物各0.8 μL,ddH2O 5.4 μL。反应程序:95℃预变性30 s,95℃变性5 s,60℃退火及延伸30 s,40个循环;生成溶解曲线的程序为65℃ 5 s,95℃ 5 s。每个反应均进行3次生物学重复和2次技术重复。
1.7 AtumOBP4的原核表达
根据基因AtumOBP4和表达载体pET-32a(+)的序列,设计带有NotⅠ和EcoRⅠ限制性酶切位点的特异性引物(表1)。以文中1.4中测序正确的菌液为模板,使用2×Es Taq MasterMix DNA聚合酶进行扩增,产物经割胶回收后测浓度置于-20℃冰箱备用。将表达载体pET-32a(+)用NotⅠ和EcoRⅠ双酶切,产物经琼脂糖凝胶电泳确认酶切成功后回收备用。参照ClonExpress©Ⅱ One Step Cloning Kit说明书将双酶切的pET-32a(+)载体与回收的目的片段进行同源重组,并转化到Trans1-T1感受态细胞中。转化后菌液涂布在含有100 μg/mL氨苄的LB固体培养基平板中,37℃倒置培养16 h。挑取平板中大小适中的菌落到1.5 mL LB液体培养基中(含氨苄100 μg/mL),37℃ 200 rpm振荡培养2 h。菌液PCR扩增后经电泳检测后,挑取目的片段范围内的菌液送生工生物测序。
将测序正确的菌液扩大培养,通过质粒提取试剂盒提取质粒,将提取的pET-32a(+)/AtumOBP4质粒转化BL21表达感受态细胞中,转化后菌液涂布在含有100 μg/mL氨苄的LB固体培养基平板中,37℃倒置培养16 h。挑取平板中大小适中的菌落到8 mL LB液体培养基中(含氨苄100 μg/mL),37℃ 200 rpm振荡培养2 h。以1%的接种量将过夜培养的菌液接入100 mL的LB液体培养基中(含氨苄100 μg/mL),37℃ 200 rpm振荡培养至OD600≈0.7时,加入IPTG(终浓度1 mmol/L)诱导表达,25℃ 200 rpm继续振荡培养12~16 h。收集菌体,超声波破碎及分离上清及包涵体。使用SDS-PAGE电泳检测蛋白表达情况及表达形式。
1.8 数据分析
通过Bio-Rad CFX Maestro 1.1软件对荧光定量的结果进行分析,采集目的基因和内参基因Ct值,用2-△△Ct相对定量法求得基因的相对表达量(Schmittgen, 2001)。使用SPSS 19.0软件进行Tukey’s(HSD)单因素方差分析,结果以平均数±标准误(Mean±SE)表示,通过GraphPad Prism 8.0软件进行图形分析。
2 结果与分析
2.1 克隆及序列分析
克隆获得了一个新的蜂巢小甲虫气味结合蛋白基因,命名为AtumOBP4(GeBank登录号: ON813082)(图1)。基因AtumOBP4开放阅读框全长465 bp,编码154个氨基酸,预测其分子量大小为17.4 kDa,理论等电点为5.07。SignalP-4.1在线预测该蛋白N末端的前23个氨基酸为信号肽序列(图2);跨膜结构域预测表明该蛋白不是跨膜蛋白;NCBI Conserved Domains对蛋白AtumOBP4的保守结构域分析表明它在第27~142位氨基酸具有PBP-GOBP superfamily家族的保守结构域。
图1 AtumOBP4基因PCR产物电泳图

图2 AtumOBP4核苷酸序列及推导的氨基酸序列
2.2 氨基酸序列对比及系统发育分析
利用NCBI中的Blastp对AtumOBP4进行同源性搜索,发现其与鞘翅目昆虫的OBP同源性较高,将AtumOBP4与其它9个鞘翅目昆虫OBPs进行序列对比发现,这些序列都具有6个典型的半胱氨酸残基,且分布方式为符合Classical-OBP家族 6个保守的半胱氨酸位点结构模型:C1-X20-66-C2-X3-C3-X21-43-C4- X8-14-C5-X8-C6(图3)。

图3 AtumOBP4与其他鞘翅目昆虫OBP的序列比对
将以上序列通过MEAG 7.0构建系统进化树,结果显示AtumOBP4与TmolOBP8聚在同一支上,表明蜂巢小甲虫与黄粉虫可能有相同的基因起源(图4)。
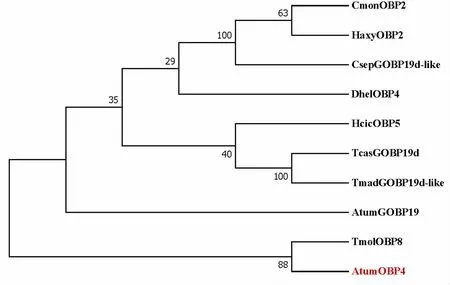
图4 AtumOBP4与其他鞘翅目昆虫OBP的系统发育树(邻接法)
2.3 AtumOBP4的时空表达
以成虫足部的基因AtumOBP4表达量为基准,通过qRT-PCR分析基因AtumOBP4在蜂巢小甲虫不同组织、不同发育阶段(整虫)以及羽化后不同日龄头部的表达情况。结果显示在蜂巢小甲虫的卵期、幼虫期、蛹期、雄性成虫和雌性成虫中,基因AtumOBP4均有表达;在雄性成虫中的表达量最高,显著高于卵期、蛹期和雌性成虫中的表达(P<0.05),雄性成虫的表达量是雌性成虫的8.21倍(图5-A)。AtumOBP4在蜂巢小甲虫的头(包含触角)、翅、足、表皮、脂肪体、肠道、马氏管、精巢和卵巢中均有表达,但表达量各有差异。头部(包含触角)的表达量最高,极显著高于其他组织(P<0.001),脂肪体的表达量仅次于头部,但与其它组织并无显著性差异(图5-B)。在蜂巢小甲虫羽化后的第1~7天,AtumOBP4呈总体上升的趋势,在第7天达到最高,第8天开始下降(图5-C)。
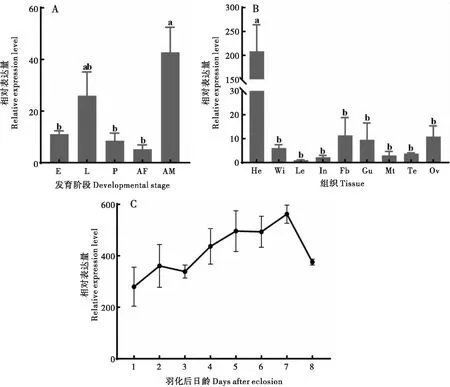
图5 AtumOBP4在蜂巢小甲虫不同发育阶段(A)、成虫不同组织部位(B)和羽化后成虫不同日龄头部(C)的表达分析
2.4 AtumOBP4原核表达
将生工生物测序正确的pET-32a(+)/AtumOBP4的原核表达载体,转入BL21感受态细胞中进行诱导表达。经过条件优化,在菌液OD600≈0.7时,加入IPTG(终浓度1 mmol/L),25℃,200 r/min诱导12 h后,大量表达,超声破碎对上清和包涵体进行分离,用SDS-PAGE电泳检测,目的蛋白主要在包涵体中大量表达。SDS-PAGE结果显示,含有His-tag的重组蛋白分子量约在35 kDa,与预测的重组蛋白大小一致(图6)。
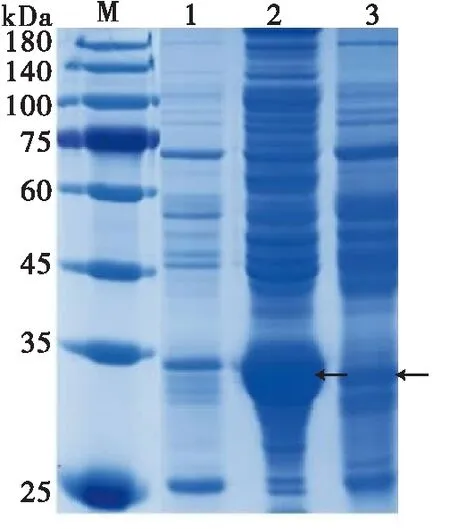
图6 AtumOBP4蛋白诱导表达
3 结论与讨论
气味结合蛋白OBPs在昆虫的嗅觉识别系统中起着至关重要的作用,对于昆虫觅食、寻找合适的产卵地以及交配等行为具有重要的意义(Leal, 2012)。随着转录组技术的发展,越来越多昆虫的OBPs被鉴定出来,前期研究中笔者所在团队通过转录组和基因组数据分析鉴定出29个蜂巢小甲虫OBPs(Wuetal., 2021)。本研究克隆出一个新的蜂巢小甲虫气味结合蛋白基因AtumOBP4,开放阅读框序列全长465 bp,编码154个氨基酸,预测其分子量大小为17.4 kDa,含有6个保守的半胱氨酸位点,从属于典型的OBPs家族。进化树结果表明AtumOBP4与黄粉虫TmolOBP8的聚在同一分支,表明它们在进化关系上同源关系更近,可能发挥类似的普通气味结合蛋白的功能,负责识别一般气味(Liuetal., 2015)。
研究表明,触角高表达的OBPs往往在昆虫的嗅觉系统中发挥着重要的作用(张雪等, 2021)。例如在美洲斑潜蝇Liriomyzasativae触角特异性高表达的LsatOBP13参与对寄主绿叶植物中大量存在的气味物质的识别过程,在美洲斑潜蝇嗅觉识别、寄主植物定位中发挥功能(陈东凯等, 2018)。本研究发现AtumOBP4在蜂巢小甲虫头部(包含触角)特异性高表达,与上述研究相符,表明AtumOBP4可能是参与蜂巢小甲虫多种嗅觉识别的重要蛋白。OBPs除了参与嗅觉识别外,还可能在昆虫的其它组织参与各种生理活动,例如参与卵膜形成、味觉识别和营养物质运输等,意味着OBPs也在昆虫的各种组织部位表达(Costa-da-Silvaetal., 2013; 张方梅等, 2019)。AtumOBP4基因在蜂巢小甲虫的翅、足、表皮、肠道、脂肪体、马氏管、精巢和卵巢等组织中均有一定的表达量;在马氏管、肠道的表达量要略高于其它组织,暗示着AtumOBP4可能在消化系统中发挥一定的作用,类似的现象也出现在伏蝇Phormiaregina和棉铃虫Helicoverpaarmigera等昆虫(张帅等, 2012; Ishidaetal., 2013)。本研究还发现AtumOBP4在蜂巢小甲虫的不同发育阶段均有表达,幼虫期的表达量高于卵期和蛹期,可能与蜂巢小甲虫幼虫相较于卵和蛹存在更丰富的取食行为与更广泛的活动范围有关。OBP基因在雌雄成虫中普遍存在偏向表达,如绿豆象Callosobruchuschinensis雄成虫各组织中CchiOBP1的表达量显著高于雌成虫的,推测该基因可能在雌雄之间交配时,或是与寄主互作的过程中发挥重要作用(王宏民等, 2021);韭菜迟眼蕈蚊Bradysiaodoriphaga雌性高表达的BodoOBP5在识别寄主挥发物和性信息素中发挥重要功能(Yangetal., 2021)。本研究中,雄性成虫中AtumOBP4的表达量明显高于雌性成虫,这可能与蜂巢小甲虫的交配行为相关,事实上蜂巢小甲虫不仅存在雌雄交配,还存在尝试性雄雄交配行为(Neumannetal., 2008; Mustafaetal., 2015)。在羽化后不同天数头部表达谱分析表明,AtumOBP4在羽化后的1~7天内呈现逐渐升高的趋势,第5~7天呈现稳定的较高水平表达,在第7天达到最高,第8天开始降低。蜂巢小甲虫在羽化后的5~7天性成熟,开始寻找配偶和寄主蜂箱(Neumannetal., 2016)。头部是昆虫感觉和取食的中心,在其表面分布着大量的嗅觉感受器(Matsuoetal., 2007)。因此推测在蜂巢小甲虫羽化后第7天头部高度表达的AtumOBP4参与了性信息素和蜂巢相关气味的嗅觉识别过程。
OBPs作为嗅觉结合蛋白,最重要的功能是在嗅觉系统中结合转运气味和信息素分子;OBPs为球状结构,亲水性氨基酸分布于蛋白表面,使它们具有强水溶性,疏水性氨基酸在内部形成空腔,用于结合配基(吴帆等, 2021)。因此进一步研究气味结合蛋白的功能需要通过表达蛋白来实现,本研究成功的建立了基因AtumOBP4原核表达体系,并成功在包涵体中表达出AtumOBP4蛋白,与Li等(2021)的研究结果一致,可用于下一步的荧光竞争结合研究,并通过RNAi技术来进行功能验证。

