人绒毛膜促性腺激素对反复种植失败不孕患者子宫内膜容受性的影响
王 婧,段世超
(1.河南省人民医院妇产科,河南 郑州 450003;2.河南省人民医院临床医学研究中心,河南 郑州 450003)
临床上有一部分行辅助生殖助孕的不孕患者,其年龄<40岁、接受≥3个胚胎移植周期、累计移植≥4枚优质胚胎但未能成功妊娠,这类患者被诊断为反复种植失败(repeated implantation failure,RIF)。子宫内膜容受性与RIF患者的妊娠结局密切相关[1]。人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)能够调节RIF患者的子宫内膜容受性,促进胚胎种植,改善妊娠结局,但其具体作用机制较复杂[2]。白血病抑制因子(leukemia inhibitory factor,LIF)通过影响胚胎种植窗期子宫内膜腺上皮细胞的蜕膜形态调节胚胎着床,LIF表达水平越高,子宫内膜容受性越好,胚胎着床成功率越高,因此,LIF是子宫内膜容受性的标志性因子,检测子宫内膜中LIF表达水平可以反映子宫内膜容受性状态[3]。基于此,本研究通过在体外构建子宫内膜和胚胎共培养模型,观察HCG干预后子宫内膜和胚胎共培养模型培养液中LIF表达的变化,探讨HCG对RIF患者子宫内膜容受性的影响,旨在为HCG改善RIF患者妊娠结局的临床应用提供参考。
1 资料与方法
1.1 标本来源
选择2015年1月至2022年12月在河南省人民医院行辅助生殖助孕的20例RIF患者为子宫内膜组织标本的来源对象。病例纳入标准:(1)年龄20~40岁;(2)不孕年限≥ 1 a;(3)体质量指数(body mass index,BMI)18~24 kg·m-2;(4)血清卵泡刺激素(follicle stimulating hormone,FSH)<15 IU·L-1。排除标准:(1)子宫内膜结核患者;(2)子宫内膜异位症患者;(3)存在宫腔积液;(4)存在直径≥ 5 cm的子宫肌瘤。同时选择40枚相同时间段行辅助生殖助孕并成功分娩、已无生育需求患者的实验室冻存胚胎为废弃胚胎标本的来源对象。本研究经河南省人民医院伦理委员会批准(2022-182号),患者自愿签署胚胎废弃知情同意书。实验结束后,按照实验室胚胎废弃相关规定处理标本。
1.2 主要试剂与仪器
达尔伯克改良伊戈尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胎牛血清(fetal bovine serum,FBS)、胶原酶、胰蛋白酶、磷酸盐缓冲液(phosphate buffered saline,PBS)、雌激素(estrogen,E2)、孕激素(progesterone,P)、HCG购自上海晶抗生物工程有限公司,LIF一抗及二抗、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、增强电化学发光(enhanced electrochemical luminescence,ECL)试剂购自上海妙一生物技术有限公司;凝胶成像系统购自美国Bio-Rad公司。
1.3 方法
1.3.1 子宫内膜细胞培养
用一次性无菌子宫内膜取样器采集20例RIF患者月经第14天的子宫内膜组织。在无菌操作台用解剖镊剪碎子宫内膜组织,用含体积分数10% FBS、100 U·L-1青链霉素的DMEM洗涤3次,迅速移入含1 g·L-1胶原酶的离心管中,37 ℃消化2 h,加入DMEM终止消化,2 000 r·min-1离心5 min;弃上清,收集细胞悬液,计数细胞密度,按1×108L-1接种于60 mm3培养皿,置于37 ℃、含体积分数5% CO2培养箱中培养,待细胞聚合度超过95%时,加入胰蛋白酶消化传代,2 000 r·min-1离心5 min;静置后收集沉淀物,加入细胞冷冻保护液混悬后分别置于1~20号冻存管中,置于液氮中保存备用[4]。
1.3.2 子宫内膜和胚胎体外共培养模型的构建
参照YU等[5]的方法构建40个子宫内膜和胚胎体外共培养模型:从液氮中取出20个冻存管,立即置于37 ℃水浴箱中,完全解冻后,将每个冻存管的细胞悬液分成2份,分装至40个含5 mL DMEM的离心管中,2 000 r·min-1离心5 min;收集40份细胞悬液,计数细胞密度,按每孔1×108L-1接种于10个4孔板中,每孔加入5 mL含有子宫内膜细胞的细胞悬液;同时,每孔加入2 mL子宫内膜细胞培养液(含1 mg·L-1E2和10 mg·L-1P的 DMEM)和1枚复苏解冻成功的实验室废弃胚胎,然后将其分为子宫内膜-胚胎-HCG共培养组(试验组)和子宫内膜-胚胎共培养组(对照组),每组20个共培养模型,均置于37 ℃、含体积分数5% CO2培养箱中培养。培养第1天(D1),试验组加入1 mL HCG(1 mg·L-1),对照组加入1 mL子宫内膜细胞培养液(含 1 mg·L-1E2和10 mg·L-1P),连续培养7 d。
1.3.3 试验组和对照组培养液的收集
培养过程中,分别收集培养D1、第3天(D3)、第5天(D5)、第7天(D7)试验组和对照组培养液各1 mL,平均分成2份,每份0.5 mL,加入细胞冷冻保护液混悬后置于冻存管中,-20 ℃冻存。
另于培养D7收集试验组培养液5 mL,按每孔1×108L-1细胞密度接种于5孔板中,每孔1 mL,将5孔板分为阴性未干预组、1 mg·L-1HCG组、2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组,分别加入0、1、2、4、5 mg·L-1HCG 1 mL;同时收集对照组培养液5 mL,按每孔1×108L-1细胞密度接种于5孔板中,每孔1 mL,将5孔板分为阴性未干预组、1 mg·L-1E2+10 mg·L-1P组、2 mg·L-1E2+20 mg·L-1P组、4 mg·L-1E2+40 mg·L-1P组、5 mg·L-1E2+50 mg·L-1P组,分别加入含0、1、2、4、5 mg·L-1E2和0、10、20、40、50 mg·L-1P的子宫内膜细胞培养液1 mL;以上各组均置于37 ℃、含体积分数5% CO2培养箱中继续培养1 d,分别收集试验组中各组及对照组中各组培养液各1 mL,平均分成2份,每份0.5 mL,加入细胞冷冻保护液混悬后置于冻存管中,-20 ℃冻存。
1.3.4 ELISA法检测不同培养时间试验组和对照组培养液中LIF水平
分别取D1、D3、D5、D7试验组和对照组冻存培养液各1份,解冻后,3 000 r·min-1离心15 min,取上清液,按照ELISA试剂盒说明书方法检测LIF水平,显色后,应用多功能酶标仪检测LIF在 450 nm波长处的吸光度值,根据绘制的标准曲线计算LIF水平。
1.3.5 Western blot法检测不同培养时间试验组和对照组培养液中的LIF蛋白相对表达量
分别取D1、D3、D5、D7试验组和对照组冻存培养液各1份,解冻后,用预冷的PBS重悬,加入裂解液于冰上裂解30 min,12 000 r·min-1离心 15 min;取上清液,采用BCA法测定蛋白浓度,每孔上样30 μg蛋白,100 ℃煮沸5 min,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离蛋白;采用转膜仪在250 mA条件下湿法转膜100 min,脱脂奶粉封闭 2 h;加入LIF一抗(滴度为11 000),4 ℃孵育过夜,洗膜3次,每次5 min;加入LIF二抗(滴度为 15 000),室温孵育2 h,洗膜3次,每次5 min;采用ECL试剂显色,凝胶成像系统获取图像,应用Image J软件分析目的蛋白灰度值,以目的蛋白灰度值与β-actin内参蛋白灰度值的比值表示目的蛋白的相对表达量。
1.3.6 ELISA法检测不同浓度HCG或E2、P干预后的试验组和对照组培养液中LIF水平
分别取试验组中阴性未干预组、1 mg·L-1HCG组、2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组以及对照组中阴性未干预组、1 mg·L-1E2+10 mg·L-1P组、2 mg·L-1E2+20 mg·L-1P组、4 mg·L-1E2+40 mg·L-1P组、5 mg·L-1E2+50 mg·L-1P组的冻存培养液各1份,解冻后,采用ELISA法检测培养液中的LIF,操作步骤同“1.3.4”项。
1.3.7 Western blot法检测不同浓度HCG或E2、P干预后的试验组和对照组培养液中LIF蛋白相对表达量
分别取试验组中阴性未干预组、1 mg·L-1HCG组、2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组以及对照组中阴性未干预组、1 mg·L-1E2+10 mg·L-1P组、2 mg·L-1E2+20 mg·L-1P组、4 mg·L-1E2+40 mg·L-1P组、5 mg·L-1E2+50 mg·L-1P组的冻存培养液各1份,解冻后,采用Western blot法检测培养液中的LIF蛋白相对表达量,操作步骤同“1.3.5”项。
1.4 统计学处理
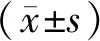
2 结果
2.1 不同培养时间试验组和对照组培养液中LIF水平比较
D1、D3、D5、D7时,试验组培养液中LIF水平均高于对照组,差异有统计学意义(P<0.05)。试验组和对照组D3、D5、D7时培养液中LIF水平均高于D1时,差异有统计学意义(P<0.05);试验组和对照组D5、D7时培养液中LIF水平均高于D3时,差异有统计学意义(P<0.05);试验组和对照组D7时培养液中LIF水平均高于D5时,差异有统计学意义(P<0.05)。结果见表1。

表1 不同培养时间试验组和对照组培养液中LIF水平比较Tab.1 Comparison of the level of LIF protein in culture medium between the experimental group and thecontrol group at different culture time
2.2 不同培养时间试验组和对照组培养液中LIF蛋白相对表达量比较
D1、D3、D5、D7时,试验组培养液中LIF蛋白相对表达量均高于对照组,差异有统计学意义(P<0.05)。试验组和对照组D3、D5、D7时培养液中LIF蛋白相对表达量均高于D1时,差异有统计学意义(P<0.05);试验组和对照组D5、D7时培养液中LIF蛋白相对表达量均高于D3时,差异有统计学意义(P<0.05);试验组和对照组D7时培养液中LIF蛋白相对表达量均高于D5时,差异有统计学意义(P<0.05)。结果见图1和表2。

图1 不同培养时间试验组和对照组培养液中LIF蛋白的表达Fig.1 Expression of LIF protein in culture medium in the experimental group and the control group at different culture time

表2 不同培养时间试验组和对照组培养液中LIF蛋白相对表达量比较Tab.2 Comparison of the relative expression of LIF protein in culture medium between the experimental group and the control group at different culture time
2.3 不同浓度HCG或E2、P干预后试验组和对照组培养液中LIF水平比较
对照组阴性未干预组、1 mg·L-1E2+10 mg·L-1P组、2 mg·L-1E2+20 mg·L-1P组、4 mg·L-1E2+40 mg·L-1P组、5 mg·L-1E2+50 mg·L-1P组培养液中LIF水平分别为(23.78±1.97)、(23.69±1.99)、(23.72±1.99)、(23.71±2.01)、(23.72±1.92)mg·L-1。对照组阴性未干预组、1 mg·L-1E2+10 mg·L-1P组、2 mg·L-1E2+20 mg·L-1P组、4 mg·L-1E2+40 mg·L-1P组、5 mg·L-1E2+50 mg·L-1P组各组之间培养液中LIF水平比较差异无统计学意义(P>0.05)。试验组阴性未干预组、1 mg·L-1HCG组、2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF水平分别为(30.29±3.55)、(31.69±0.69)、(32.86±0.85)、(34.93±0.82)、(37.65±0.73)mg·L-1。试验组 1 mg·L-1HCG组、2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF水平高于阴性未干预组,差异有统计学意义(P<0.05);2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF水平高于1 mg·L-1HCG组,差异有统计学意义(P<0.05);4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF水平高于2 mg·L-1HCG组,差异有统计学意义(P<0.05);5 mg·L-1HCG组培养液中LIF水平高于 4 mg·L-1HCG组,差异有统计学意义(P<0.05)。试验组阴性未干预组培养液中LIF水平高于对照组阴性未干预组,差异有统计学意义(P<0.05)。 1 mg·L-1HCG组培养液中LIF水平高于1 mg·L-1E2+10 mg·L-1P组,差异有统计学意义(P<0.05)。2 mg·L-1HCG组培养液中LIF水平高于2 mg·L-1E2+20 mg·L-1P组,差异有统计学意义(P<0.05)。4 mg·L-1HCG组培养液中LIF水平高于4 mg·L-1E2+40 mg·L-1P组,差异有统计学意义(P<0.05)。5 mg·L-1HCG组培养液中LIF水平高于5 mg·L-1E2+50 mg·L-1P组,差异有统计学意义(P<0.05)。
2.4 不同浓度HCG或E2、P干预后试验组和对照组培养液中LIF蛋白相对表达量比较
对照组阴性未干预组、1 mg·L-1E2+10 mg·L-1P组、2 mg·L-1E2+20 mg·L-1P组、4 mg·L-1E2+40 mg·L-1P组、5 mg·L-1E2+50 mg·L-1P组培养液中LIF蛋白相对表达量分别为0.33±0.01、0.33±0.01、0.34±0.01、0.34±0.01、0.34±0.01。对照组阴性未干预组、1 mg·L-1E2+10 mg·L-1P组、2 mg·L-1E2+20 mg·L-1P组、4 mg·L-1E2+40 mg·L-1P组、5 mg·L-1E2+50 mg·L-1P组各组之间培养液中LIF蛋白相对表达量比较差异均无统计学意义(P>0.05)。试验组阴性未干预组、1 mg·L-1HCG组、2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF蛋白相对表达量分别为0.87±0.02、1.01±0.02、1.39±0.03、1.67±0.04、2.03±0.03。试验组1 mg·L-1HCG组、2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF蛋白相对表达量高于阴性未干预组,差异有统计学意义(P<0.05);2 mg·L-1HCG组、4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF蛋白相对表达量高于1 mg·L-1HCG组,差异有统计学意义(P<0.05);4 mg·L-1HCG组、5 mg·L-1HCG组培养液中LIF蛋白相对表达量高于2 mg·L-1HCG组,差异有统计学意义(P<0.05);5 mg·L-1HCG组培养液中LIF蛋白相对表达量高于4 mg·L-1HCG组,差异有统计学意义(P<0.05)。试验组阴性未干预组培养液中LIF蛋白相对表达量高于对照组阴性未干预组,差异有统计学意义(P<0.05)。1 mg·L-1HCG组培养液中LIF蛋白相对表达量高于1 mg·L-1E2+10 mg·L-1P组,差异有统计学意义(P<0.05)。2 mg·L-1HCG组培养液中LIF蛋白相对表达量高于2 mg·L-1E2+20 mg·L-1P组,差异有统计学意义(P<0.05)。4 mg·L-1HCG组培养液中LIF蛋白相对表达量高于4 mg·L-1E2+40 mg·L-1P组,差异有统计学意义(P<0.05)。5 mg·L-1HCG组培养液中LIF蛋白相对表达量高于5 mg·L-1E2+50 mg·L-1P组,差异有统计学意义(P<0.05)。结果见图2。

A1:试验组阴性未干预组;A2:试验组1 mg·L-1 HCG组;A3:试验组2 mg·L-1 HCG组;A4:试验组4 mg·L-1 HCG组;A5:试验组5 mg·L-1 HCG组;B1:对照组阴性未干预组; B2:对照组1 mg·L-1 E2+10 mg·L-1 P组;B3:对照组2 mg·L-1 E2+20 mg·L-1 P组;B4:对照组4 mg·L-1 E2+40 mg·L-1 P组;B5:对照组5 mg·L-1 E2+50 mg·L-1 P组。
3 讨论
辅助生殖技术的迅速发展为众多不孕患者解决了生育难题,但部分不孕患者经历多次胚胎移植仍然未能获得临床妊娠,这类患者被称为RIF[6]。子宫内膜容受性是影响胚胎种植和妊娠结局的关键因素,RIF患者想要获得良好的妊娠结局,必须改善其子宫腔内环境,提高子宫内膜容受性[7]。因此,如何提高RIF患者的子宫内膜容受性是辅助生殖领域研究的热点和难点。
HCG是胎盘合体滋养细胞分泌的一种二聚体糖蛋白激素,是影响胚胎种植的关键信号分子[8]。有研究表明,HCG能够调节RIF患者的子宫内膜容受性,可能通过以下途径发挥作用:HCG通过自分泌方式促进滋养细胞的分化,启动及控制胚胎种植前分泌绒毛的侵袭性,增加自然杀伤细胞的数量,加速滋养细胞对子宫内膜的浸润,促进子宫内膜血管内皮生长因子、Ki67等因子的表达,改善子宫腔内环境[9];同时,HCG通过旁分泌方式作用于子宫内膜Treg细胞表面受体,促进子宫内膜Treg细胞归巢,延迟子宫内膜蜕膜化进程,减少子宫内膜蠕动,加速子宫内膜增殖,提高子宫内膜容受性,改善妊娠结局[10]。LIF是子宫内膜与胚胎间传递信息的关键因子,在胚胎种植过程中,LIF能够调节子宫内膜局部免疫微环境,抑制严重炎症反应,促进子宫内膜血管生成,丰富子宫内膜血流供应,增加胚胎与子宫内膜表面的黏附能力,提高胚胎侵袭力和种植力,促进胚胎种植[11]。LIF同时也是子宫内膜容受性的标志性因子,检测子宫内膜中LIF的分泌和表达能够监测子宫内膜容受性的变化,反映子宫内膜容受性的状态[12]。本研究以此为背景,采用体外培养的方法,通过在体外构建子宫内膜和胚胎共培养模型,观察HCG干预后子宫内膜和胚胎共培养模型培养液中LIF表达的变化,探讨HCG对RIF患者子宫内膜容受性的影响。
AGHAJANZADEH等[13]研究发现,HCG能够调控RIF患者种植窗期子宫内膜腺上皮细胞相关信号通路的开放,激活大量子宫内膜容受性相关信号因子的释放,上调LIF蛋白的表达,提高子宫内膜容受性,促进胚胎种植。胚胎种植发生于女性正常月经周期排卵后6~7 d,故本研究选取RIF患者月经第14天的子宫内膜细胞作为饲养层,并以子宫内膜和胚胎体外共培养模型建立后培养D1至D7天为检测LIF表达的时间点,与胚胎种植窗期的时间点相吻合。本研究结果显示,在培养D1、D3、D5、D7时,试验组培养液中的LIF水平和蛋白相对表达量均高于对照组;说明,HCG能够激活子宫内膜腺上皮细胞相关信号通路,促进子宫内膜腺上皮细胞短暂、瞬间性分泌大量LIF;而对照组因为缺少HCG,无法有效调节相关信号通路,子宫内膜腺上皮细胞无法迅速传递关键信息,导致LIF的分泌和表达低于试验组。以上结果提示,HCG对RIF患者LIF的分泌和表达具有促进与诱导作用,HCG通过促进LIF的高分泌表达,提高子宫内膜容受性,与AGHAJANZADEH等[13]的研究结果相符。子宫内膜中LIF的分泌和表达水平能够反映子宫内膜容受性的状态,LIF表达水平越高,子宫内膜容受性越好。本研究发现,随着培养时间增加,试验组和对照组LIF水平和蛋白相对表达量均逐渐增加,在培养D7时最高,说明种植窗期LIF的分泌和表达呈现逐步升高趋势,子宫内膜容受性在种植窗期D7时达到最佳状态,这与BALAKIER等[14]研究发现的女性正常月经周期中排卵后6~7 d子宫内膜容受性最好、最利于胚胎着床的结论是一致的。
REZAEE等[15]研究显示,RIF患者胚胎移植前行宫腔灌注HCG治疗,使用不同水平HCG可以获得不同的妊娠结局。ALSBJERG等[16]研究发现,RIF患者胚胎移植前行宫腔灌注HCG治疗可以提高胚胎种植率,宫腔灌注液中的HCG水平与RIF患者的胚胎种植率及子宫内膜容受性具有一定正向相关性,相对于低水平HCG,高水平HCG对子宫内膜容受性的改善作用更加明显。本研究选取LIF水平和蛋白相对表达量最高、子宫内膜容受性最好的D7培养液,观察HCG水平对LIF表达及子宫内膜容受性的影响,结果显示,随着HCG浓度的增加,试验组培养液中的LIF水平和蛋白相对表达量逐渐升高;而随着E2和P水平的增加,对照组培养液中的LIF水平和蛋白相对表达量无明显变化;说明,HCG水平与子宫内膜LIF的分泌和表达密切相关,在子宫内膜容受性达到最佳状态时,一定程度上增加HCG水平,能够进一步启动LIF的转录和表达,LIF的分泌和表达在原有基础上可以继续增加;而继续增加E2和P水平并不能增加LIF的分泌和表达。此结果与ALSBJERG等[16]的研究结果相符。以上结果提示,HCG水平对LIF的分泌和表达呈现促进作用,可以尝试增加RIF患者的HCG水平以进一步提高其子宫内膜容受性。
4 结论
在体外共培养条件下,HCG能够促进RIF患者子宫内膜LIF的分泌和表达,提高RIF患者的子宫内膜容受性。临床工作中,RIF患者可以尝试应用HCG提高胚胎种植率,改善妊娠结局。但本研究尚有一定局限性:本研究仅发现LIF的分泌和表达具有一定的HCG浓度依赖性,对于HCG提高RIF患者子宫内膜容受性的最佳浓度以及改善RIF患者妊娠结局的更多作用机制尚需在后期工作中进一步研究。

