半理性设计提高甲酸脱氢酶(CbFDH)活力及热稳定性
倪晗朦, 胡孟凯, 张恒维, 张 显, 潘学玮, 饶志明, 周楠迪
(江南大学生物工程学院,江苏无锡 214122)
NAD+依 赖 型 甲 酸 脱 氢 酶 ( formate dehydrogenase,FDH,EC 1.2.1.2) 属于D-2-羟基酸脱氢酶超家族[1],是脱氢酶合成光学活性化合物中NADH 再生酶之一[2],常见于甲基营养型微生物,例如可利用甲醇的一些酵母及其他真菌、细菌等[3-7]。甲酸脱氢酶可以将甲酸盐底物的醛基或羰基氧化成CO2,并利用NAD+作为辅因子接受和转移氢从而产生大量NADH[8],故而该酶常被用于不对称合成手性化合物过程中NADH 的原位再生[9-10]。 早在1995 年,甲酸脱氢酶就已经被用于偶联亮氨酸脱氢酶以实现L-叔亮氨酸的工业化生产[11],还被用于多种非天然氨基酸、手性醇及各种衍生物[12-13]。 相比于葡萄糖脱氢酶和亚磷酸脱氢酶等介导的辅酶再生体系,甲酸脱氢酶的共反应产物CO2更容易从体系中分离出来, 并且不会引起反应体系pH 的剧烈变化,大大降低了生产过程中使用酸碱的成本。 然而野生型的甲酸脱氢酶具有稳定性差、 酶活低等缺点, 往往会造成反应体系中辅酶NADH 供应不足,进而使产品转化效率降低。 因此提高甲酸脱氢酶的稳定性和增强其对NAD+/NADH 辅酶再生的催化能力成为当下一大研究热点。
随着基因工程技术日渐成熟,多种不同来源的甲酸脱氢酶在大肠杆菌中被克隆表达[14],其中博伊丁假丝酵母 (Candida boidinii) 来源的甲酸脱氢酶研究最为广泛。 定向进化技术是甲酸脱氢酶改造的常用手段之一,通过构建序列多样的突变文库并从中筛选出符合预期效果的突变体。 尽管高通量筛选甲酸脱氢酶的方法已有报道[15-16],但正向突变体的筛选过程仍非常复杂且耗时。 近年来,随着蛋白质工程技术的迅速发展,越来越多的蛋白质三维结构被精确解析[17-18]。 研究者们针对甲酸脱氢酶辅酶特性、酶活力和稳定性等方面进行分子改造,大量关键氨基酸残基被挖掘以提高FDH 性能[19-20]。 作者前期基于CbFDH 二级结构计算预测, 构建了A10C、I239C 突变株, 通过引入半胱氨酸残基形成二硫键大大提高了CbFDH 的热稳定性[21]。 Bulut 等对博伊丁假丝酵母来源的甲酸脱氢酶的Phe285、Gln287和His311 位保守氨基酸残基进行定点突变,验证了其作为热稳定性改造靶点的研究潜力[22]。 Q197 和P68 位氨基酸残基被认为是影响甲酸脱氢酶辅酶再生能力的重要位点。 随着蛋白质理性设计研究的深入,大量基于生物信息学和人工智能算法的蛋白质预测工具被用于探索蛋白质结构和氨基酸残基特性对酶的影响[23]。例如,Sumbalova 等设计出HotSpot Wizard web 服务器(http://loschmidt.chemi.muni.cz/hotspotwizard/),其主要功能是针对活性位点和底物通道中的具有改造潜能的氨基酸残基,计算预测诱变“热点”,之后对“热点”进行饱和突变和性能筛选,以达到提高蛋白质的稳定性、催化活性、底物特异性和对映体选择性的目的[24]。
作者首先将博伊丁假丝酵母来源的甲酸脱氢酶(CbFDH) 在大肠杆菌中异源表达, 然后利用HOTSPOT WIZARD v3.1 (https://loschmidt.chemi.muni.cz/hotspotwizard)对CbFDH 氨基酸序列建模预测, 以期通过半理性设计优化CbFDH 的酶活及其热稳定性。经筛选,P68G、Q197K 突变株比酶活较野生型分别提高11%和33%,但突变体热稳定性明显降低,因此结合前期工作进一步引入二硫键以提高突变体热稳定性, 最终获得一株热稳定性显著提高,比酶活较野生型提高31%、较I239C 提高45%的突变株CbFDH Q197K/I239C。
1 材料与方法
1.1 菌株、质粒与试剂
选用大肠杆菌Escherichia coliBL21 (DE3) 作为表达宿主, 表达Candida boidinii来源的FDH 基因Cbfdh(GenBank 登录号:AJ 011046.2), 含有Cbfdh的pUC19-Cbfdh质粒由苏州金唯智生物科技有限公司合成,并根据大肠杆菌表达宿主的密码子偏好性进行密码子优化。 pET-28a 购自Novagen 公司,带有卡那霉素抗性基因。 本实验所用酶制剂均购自诺唯赞公司 (中国南京);Bradford 蛋白质浓度试剂盒及卡那霉素:购自生工(上海)生物工程有限公司;质粒快速提取试剂盒:购自Generay 公司;胰蛋白胨、酵母提取物及琼脂粉:购自OXOID(英国);其他试剂购自国药集团(中国上海)。
1.2 研究方法
1.2.1 重组表达载体构建以pUC19-Cbfdh为模板利用Cbfdh-F/Cbfdh-R 引物PCR 扩增获得Cbfdh基因,以pET-28a 为模板利用28a-F/28a-R 引物反向PCR 扩增获得线性化载体。基因片段与线性化载体通过同源重组方式连接, 导入大肠杆菌E. coliBL21 中, 构建重组大肠杆菌BL21/pET28a-Cbfdh。以pET28a-Cbfdh为模板,设计点突变引物,通过反向PCR 引入突变点,构建一系列突变体。 带有突变基因的重组质粒送金唯智公司测序,基因比对完全正确后标记保藏。 本研究所用引物如表1 所示。
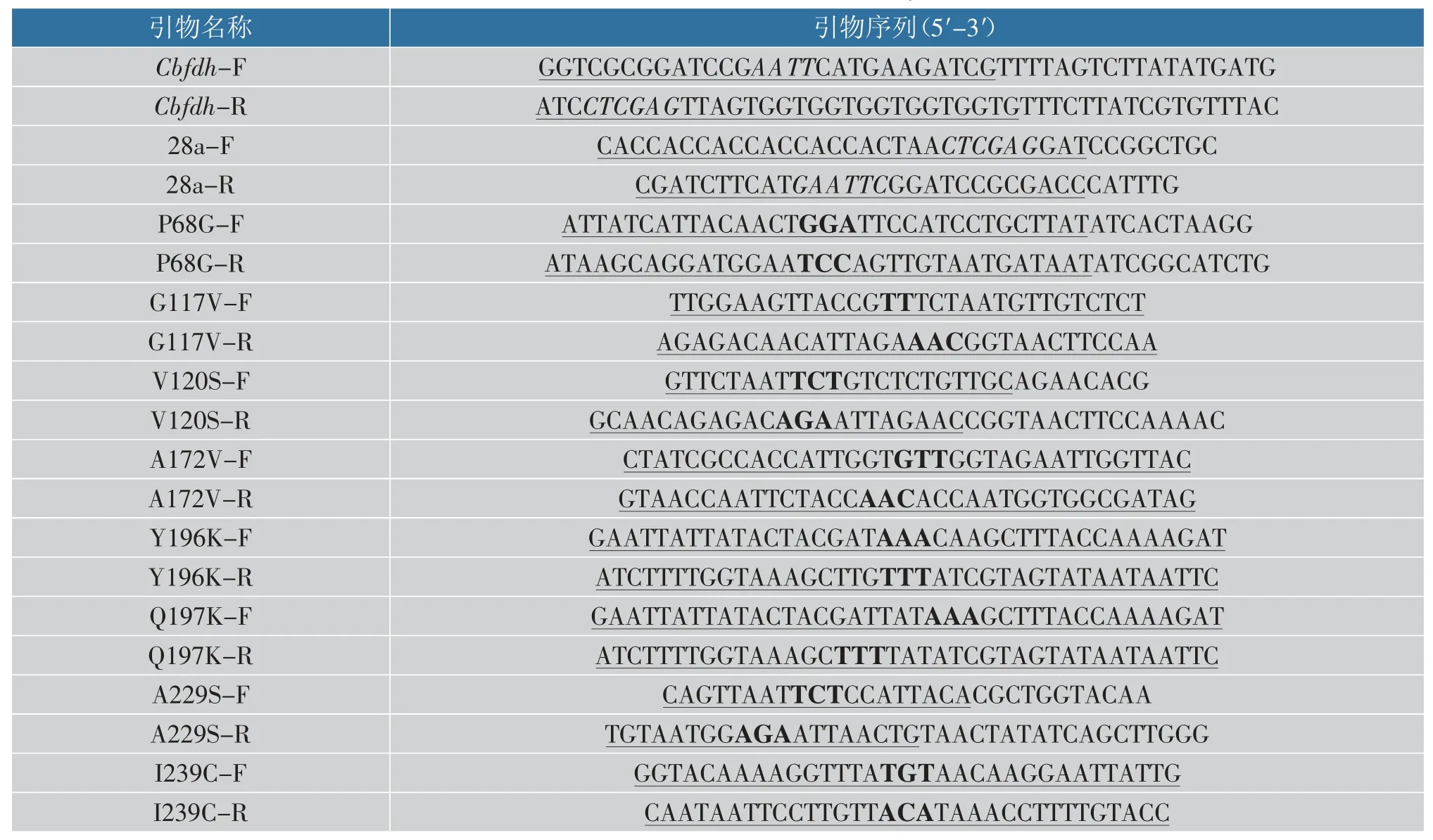
表1 本实验所用引物Table 1 Primers used in this study
1.2.2 重组酶的表达及纯化重组菌经平板活化,挑单克隆接种于含有50 mg/L 卡那抗生素的10 mL液态Luria-Bertani(LB)培养基中,37 ℃、200 r/min培养10 h。按接种体积分数1%转接至50 mL LB 培养基中,37 ℃、200 r/min 继续培养2 h,加入终浓度为0.8 mmol/L 的IPTG,16 ℃、180 r/min 诱导10 h。然后4 ℃、8 000 r/min 离心10 min 收集菌体, 细胞洗涤2 次后悬浮于0.05 mol/L PBS 缓冲液(pH 7.5)中,使用超声波破碎仪进行细胞破碎。 细胞破碎液10 000 r/min、4 ℃下离心10 min,去除沉淀,上清液即为粗酶液。
蛋白质纯化方法使用镍柱亲和层析法[19],粗酶液经0.22 μm 滤膜过滤后上样至His GraviTrap 柱,用M0 缓冲液 (0.02 mol/L Tris、0.5 mol/L NaCl,pH为7.40±0.05) 进行柱平衡, 然后用M300 缓冲液(0.02 mol/L Tris、0.5 mol/L NaCl、0.5 mol/L 咪唑,pH为7.40±0.05)进行梯度洗脱,洗脱梯度为20%、80%和100%。纯蛋白通过SDS-PAGE 凝胶电泳鉴定分析。
1.2.3 酶活及蛋白质浓度测定甲酸脱氢酶酶活测定采用紫外分光光度法, 反应溶液由0.05 mol/L PBS 缓冲液(pH 7.5)配制,包括167 mmol/L 甲酸钠和1.67 mmol/L NAD+溶液。 取1.48 mL 甲酸钠溶液置于石英比色皿, 依次加入80 μL NAD+溶液,10 μL 适当稀释后的纯酶液, 在30 ℃条件下启动反应并计时, 每30 s 记录OD340变化值。 根据不同浓度NADH 的OD340绘制标准曲线计算每分钟产生的NADH 量。 甲酸脱氢酶酶活力单位定义:每分钟消耗或生成1 μmol NADH 所需要的酶量。 蛋白质质量浓度测定使用Bradford 蛋白质测定试剂盒。
1.2.4 酶学性质分析最适反应温度测定: 用pH 7.5、0.5 mol/L 的PBS 缓冲液将纯酶稀释到适合浓度后加入到预热好的反应体系中反应, 按1.4 中方法计算比酶活,反应温度梯度设置为25、30、35、40、45、50、55、60、65、70 ℃。 初始酶活为100%,计算不同温度下突变体酶的相对比酶活。
最适反应pH 测定:将突变体纯酶用不同pH 缓冲液稀释到适合浓度后加入至预热好的相应pH 体系中反应,使用的缓冲液如下:磷酸氢二钠-柠檬酸盐缓冲液(pH 3.0~6.0),磷酸氢二钾-磷酸二氢钾缓冲液 (pH 6.0~9.0), 甘氨酸-氢氧化钠缓冲液(pH 9.0~12.0),缓冲液浓度均为20 mmol/L。 反应温度为最适温度。按初始比酶活为100%计算不同pH 下纯酶的相对比酶活。
热稳定性测定:将稀释后的纯酶分别在温度梯度为30、40、50、52、54、56、58、60、62、64、70 ℃的金属浴中保温20 min 后在最适反应条件下进行酶活测定, 以保温前最适反应温度下比酶活为100%计算相对比酶活,绘制相对酶活曲线。
pH 稳定性测定:用不同pH 的缓冲液将纯酶液分别稀释至相同倍数后,35 ℃孵育1 h 后取样测酶活,绘制相对酶活曲线。
1.2.5 突变点预测CbFDH 的三维结构模型文件(PDB ID:5dn9) 从RCSB 数据库获得。 利用HOTSPOT WIZARD v3.1 (https://loschmidt.chemi.muni.cz/hotspotwizard) 中的 FUNCTIONAL HOT SPOTS (对活性中心及底物通道附近高度可变残基的热点预测)和STABILITY HOT SPOTS(柔性残基对应的稳定性热点预测)两大功能板块对模型进行预测。
1.2.6 三维建模及结构分析利用SWISS-MODEL(https://swissmodel.expasy.org/)以CbFDH 三维结构模型文件(PDB ID:5dn9)为模板进行同源建模,利用PYMOL 软件对突变后蛋白质模型进行结构分析和图形制作。
2 结果与分析
2.1 突变点选择
利用HOTSPOT WIZARD v3.1 对CbFDH 的三维结构进行预测。 软件根据内置的Rosetta 和FoldX套件对蛋白质模板的热力学稳定性进行计算,在预测突变点的同时提供可靠的可供替换的氨基酸残基。 同时,根据2 个具有改造潜能的氨基酸残基位点,即P68 和Q197 用软件对其进行突变方案预测,最终选择预测突变位点P68G、Q197K、Y196K、V120S、A172V、G117V、A229S 进一步研究。
2.2 重组载体的构建表达及纯化
为实现大肠杆菌中CbFDH 的异源表达, 从携带Cbfdh基因的pUC19-Cbfdh质粒上扩增出Cbfdh基因片段,与线性质粒pET28a 连接并化转入E. coliBL21 中, 构建重组大肠杆菌BL21/pET28a-Cbfdh。SDS-PAGE 蛋白质凝胶电泳结果显示(见图1(a)),BL21/pET28a-Cbfdh重组菌的细胞破碎液上清和沉淀中均出现3.5×104~4.5×104明显加粗条带,与CbFDH 理论相对分子质量40 000 相符, 这表明CbFDH 在大肠杆菌中成功表达。
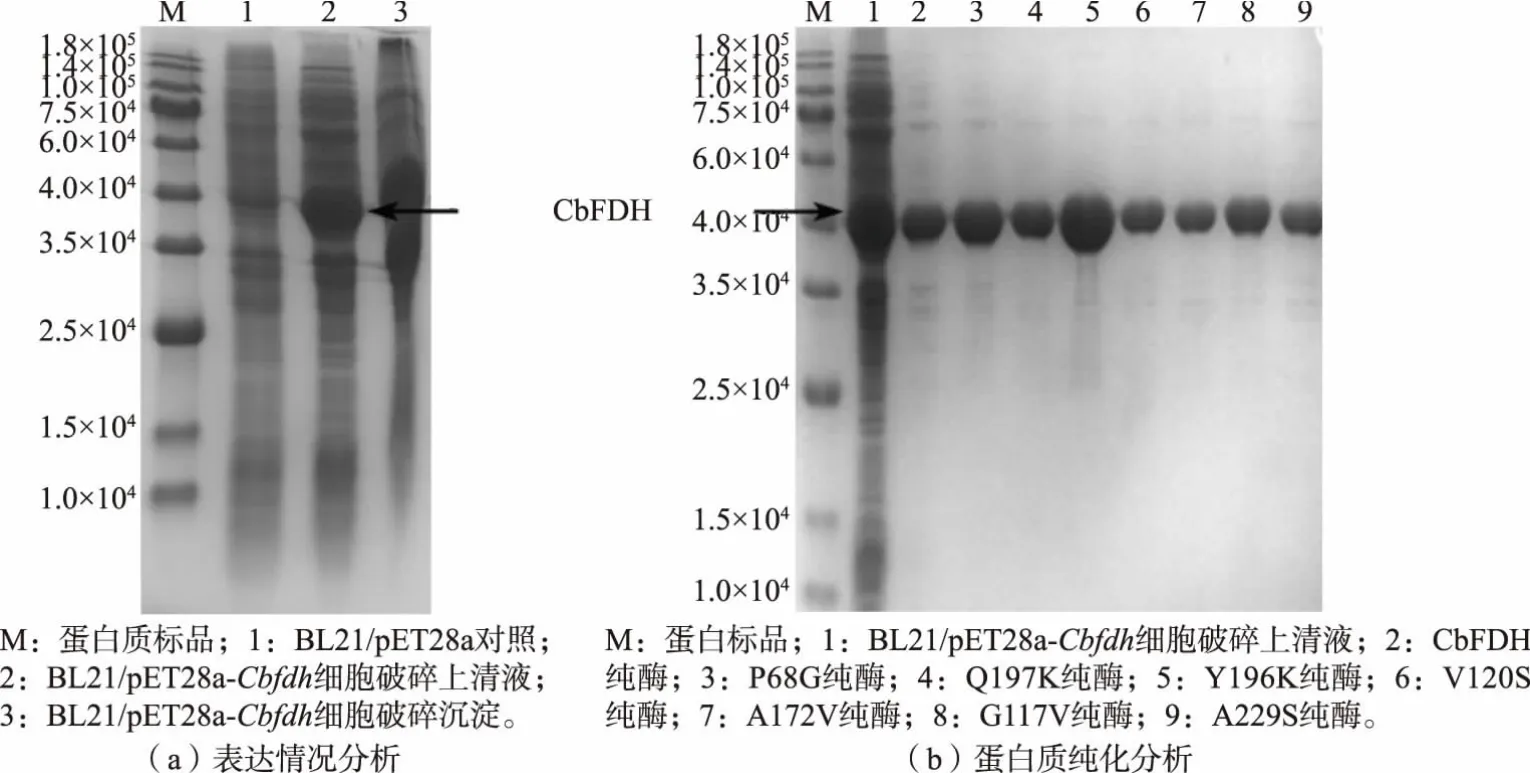
图1 甲酸脱氢酶表达及纯化情况SDS-PAGE 分析Fig. 1 SDS-PAGE analysis of FDHs expression and purification
为进一步探究CbFDH 的酶学性质, 将CbFDH和突变体酶分别进行了镍柱纯化。 纯酶SDS-PAGE分析如图1 (b) 所示。 条带1 为野生型BL21/pET28a-Cbfdh重组菌株细胞破碎上清液,纯化后纯酶蛋白质条带在40 000 左右,与理论蛋白质相对分子质量基本相符,突变体酶相对分子质量无明显变化。
2.3 酶活测定
将纯突变体酶用0.5 mol/L PBS 缓冲液(pH 7.5)作适当稀释,根据1.4 中方法测定酶活和蛋白质质量浓度, 计算比酶活。 如图2 所示,P68G 和Q197K 为正向突变体, 酶活分别为6.92 U/mg 和8.27 U/mg, 较野生型CbFDH 分别提高了11%和33%,其余突变体酶活均有明显下降。 其中,A229S突变体纯化后在SDS-PAGE 电泳分析中显示出单一且完整的条带, 但是以NAD+和甲酸钠为底物和辅底物进行酶活检测时没有活性。
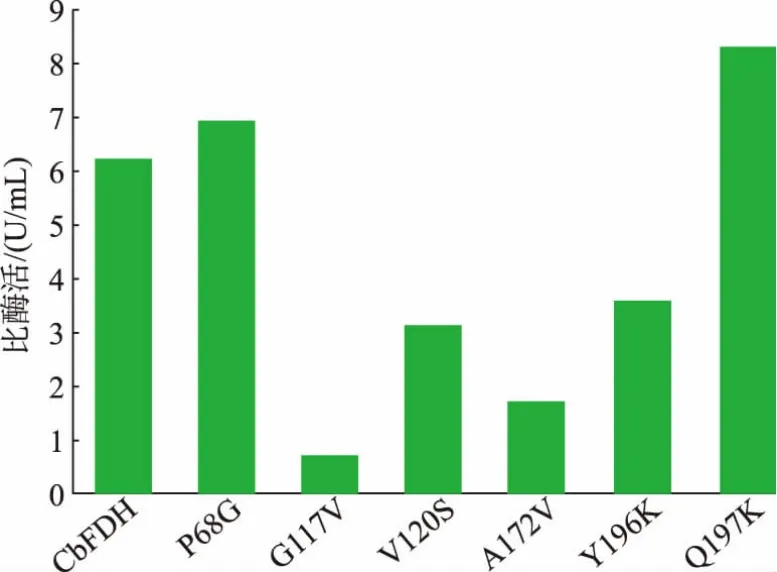
图2 突变体比酶活Fig. 2 Enzyme specific activity of mutants
2.4 酶学性质分析
根据1.2.4 中方法对不同突变体酶的酶学性质进行分析,结果如图3 所示。 由于G117V 和A172V突变体酶活过低导致测量误差过大,其酶学性质数据未展示。
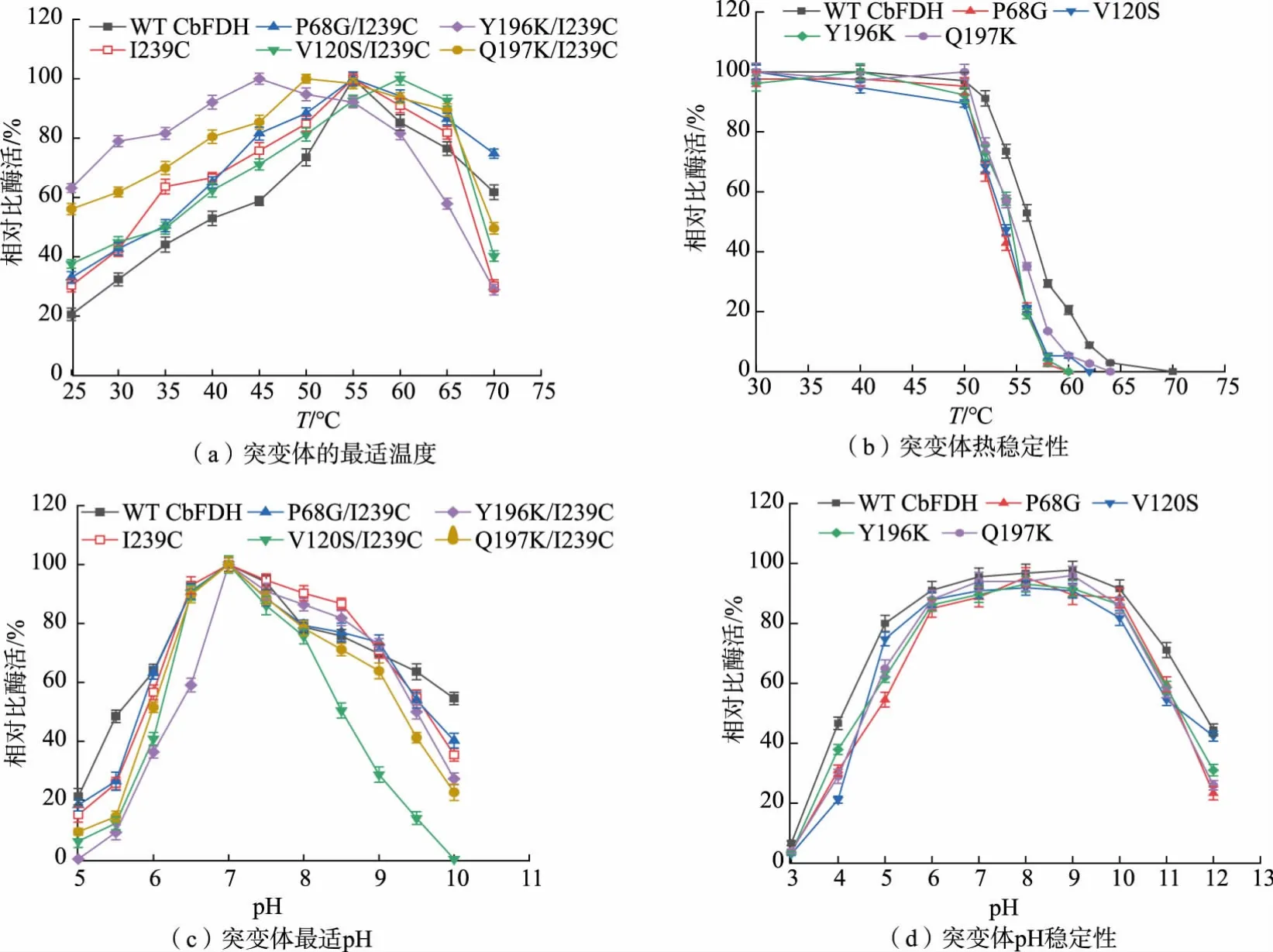
图3 突变体酶学性质Fig. 3 Enzymatic properties of mutants
突变体酶的最适温度如图3(a)所示,当温度为25~55 ℃时,野生型CbFDH 的酶活随着温度升高而不断增高;当温度为55 ℃时酶活最高;当温度高于55 ℃酶活不断降低。 因此CbFDH 最适温度为55 ℃,这一结果与戚云龙等结果一致[25]。 Y196K 和Q197K 突变体的最适温度分别降低为45、50 ℃,V120S 突变体上升至60 ℃, 其余突变体明显变化。如图3(b)所示突变体酶的热稳定性较亲本CbFDH均变差, 且随温度的升高而加快,55 ℃保温20 min后亲本酶活可保留近60%,而Q197K 仅残余50%,其余突变体酶活残余不足40%。
各突变体酶最适pH 如图3(c)所示,突变体与亲本CbFDH 最适pH 均为7。pH 稳定性测试如图3(d) 所示, 突变酶pH 稳定性相比于亲本无明显损失。 当pH<6.0 时,突变体酶活快速下降,但在pH 5孵育1 h 后酶活仍可保留50%以上, 说明突变体酶的耐酸性较好;当pH 在6~10 时,亲本和各突变体残余酶活均保留80%以上,说明突变体酶具有良好的pH 稳定性及强耐碱性。
2.5 结构分析
P68G 突变的氨基酸残基位于NAD+的底物结合口袋内,图4(a)、(b)、(c)可以看出,由于P68G 的突变使得原本位于氨基酸残基侧链的苯环被氢取代,这一变化减少了氨基酸残基侧链上苯环对甲酸盐底物分子进入结合口袋时的空间位阻,提高了活性中心和底物分子间的亲和力。 此外,P68G 突变后酶活的升高也可能是因为甘氨酸取代后该位点的疏水性增强, 有助于活性中心与NAD+的结合。Q197K 突变点的氨基酸残基侧链由酰胺基变为直链胺丁基,图4(d)和图4(e)显示197 位氨基酸残基位于底物结合口袋入口的一段环状无规则卷曲的loop 环上,这一突变增强了肽链的摆动性和酶的柔性,使得酶分子在反应中更易捕获相对分子质量较大的NAD+进入口袋,从而提高了突变体的酶活。

图4 单突变体酶蛋白三维结构Fig. 4 Three-dimensional structure of mutants
2.6 突变体稳定性优化
虽然P68G 和Q197K 突变体表现出比野生型CbFDH 更高的催化活性,但其热稳定性较野生型明显降低。 为进一步提高突变体酶的热稳定性,基于研究室前期工作[21],引入I239C 突变构建了P68G/I239C、Q197K/I239C 2 个组合突变株。 组合突变体酶均表现出比野生型更高的热稳定性(见图5),在60 ℃野生型CbFDH 和2 个单突变体迅速失活,而P68G/I239C 和Q197K/I239C 的热稳定性明显提高,3 min 时相对酶活仍可保持60%以上。
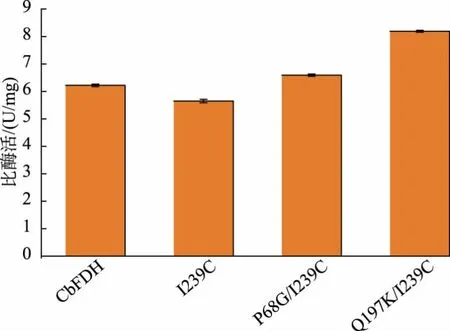
图5 组合突变体酶活Fig. 5 Enzymatic activity of combined mutants
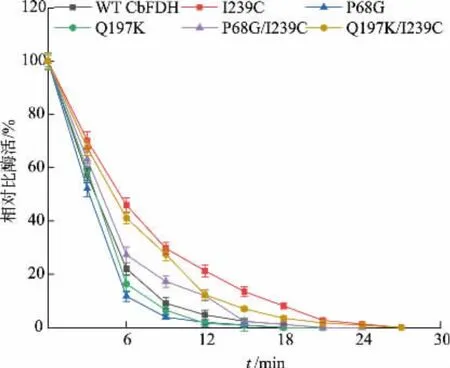
图6 组合突变体酶热稳定性Fig. 6 Thermal stability of combined mutants
尽管组合突变体热稳定性都显著增强,但其中Q197K/I239C 的比酶活较野生型CbFDH 提高了31%,较I239C 提高了45%,为8.15 U/mg;而P68G/I239C 酶活相对野生型CbFDH 提高了6%, 相较于单点突变株酶活提升有所下降。 为了解释这一现象,分析组合体酶蛋白的三维结构,如图7 所示。 野生型CbFDH 序列中仅包含C23 和C262 两个半胱氨酸残基, 其中C262 位于I239 位氨基酸残基附近,氨基酸残基I239 和C262 位于罗斯曼折叠基序的一段无规则卷曲中。 在突变体酶中构建二硫键I239C-C262, 降低了酶分子蛋白质结构的柔性,导致对NAD+亲和力减弱。 因此,组合体在稳定性提高的同时较单突变体的酶活有所降低,但同时一定程度上固定了活性中心与催化相关的氨基酸残基。
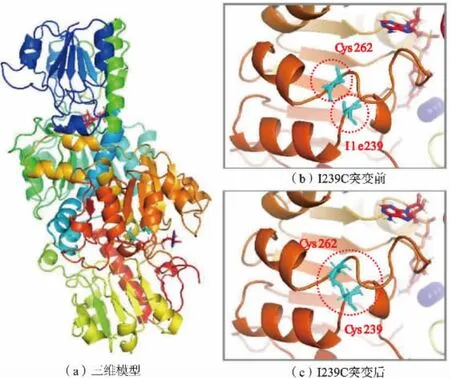
图7 组合突变体酶蛋白三维结构Fig. 7 Three-dimensional structure of combined mutants
3 结 语
作者为了获得性能优良的甲酸脱氢酶,首先在大肠杆菌中异源表达博伊丁假丝酵母来源的甲酸脱氢酶CbFDH,然后用HOTSPOT WIZARD v3.1 对CbFDH 进行模拟计算并构建了一系列突变体,测定其酶活并进行酶学性质分析,筛选出2 个酶活较高的突变体P68G、Q197K, 酶活分别较野生型提高了11%和33%。 这是因为P68G 突变后该位点氨基酸残基疏水性加强, 提高了底物口袋与NAD+的亲和力, 残基侧链对甲酸盐底物的空间位阻减小;而Q197K 增强了loop 环的摆动性和酶的柔性使得NAD+更容易进入底物口袋。然而,P68G、Q197K 这2点突变使酶的热稳定性降低,因此引入已报道能形成二硫键使FDH 热稳定性增强的I239C 突变,构建了P68G/I239C、Q197K/I239C 这2 个突变株。 经酶学性质测定,Q197K/I239C 突变体不仅保留了野生型CbFDH 较高的催化活性, 其热稳定性也得到了显著提高。 通过半理性设计对甲酸脱氢酶结构进行模拟、计算和预测以提高其酶活及热稳定性,简化了酶筛选的工作量,为今后甲酸脱氢酶及其他相关酶的改造提供了更高效的策略。

