二溴海因绿色合成工艺条件的探究
李伟光,李伟宪,李丽敏,李爱军*,陈波,高燕云,赵晓鹏,党邵杰,田良杰,董利波
(1.河北利仕化学科技有限公司,河北 邯郸 057550;2.河北鑫淘沅医药科技有限公司,河北 邯郸 057250)
1,3-二溴-5,5-二甲基海因简称二溴海因,分子式为C5H6Br2N2O2,是一种白色或淡黄色结晶固体,微溶于水,可溶于常用有机溶剂,包括乙醇、丙酮、三氯甲烷等[1]。具有活性溴含量高、贮存稳定且价格经济等优点。因其活性溴含量达到54%左右,可作为催化剂、氧化剂、溴化剂和消毒剂使用,被广泛应用于医药,农药及橡胶工业等产品的合成[2]。由于二溴海因在水溶液中能与水反应生成强氧化性的次溴酸,并以次溴酸的形式不断在水中释放出游离溴而起到杀菌作用,在二溴海因的存在下,可有效地对微生物的细胞壁、活性酶或其DNA产生破坏,导致微生物因氧化分解而失活,从而实现杀灭微生物的功能,可有效杀灭各种病菌、真菌、病毒、藻类及一些寄生虫等大多数微生物[3-6]。具有高效快速,光谱低毒及低残留,适应环境能力强,有效周期长,稳定性好,安全性高,配伍性好且廉价经济的先天优势,成为目前应用较为广泛的新型广谱杀菌剂[7-9]。有学者就采用1 mg/L的二溴海因消毒液对水中的细菌进行杀灭实验,结果发现,向水中加入消毒剂30 min可有效杀灭水中大肠杆菌,消毒1 h可完全消除游泳池水中的细菌,且不受水温、水中有机物含量及酸碱度的影响[10-11];二溴海因在水中除藻方面也得到了很好的应用,与次氯酸钠的除藻效果相当[12]。在较低浓度下6 mg/L,对海水中的不同种水藻样品进行灭杀,2 d后去除率可达到86%以上[13]。若将二溴海因结合其他产品一起使用,则会表现出更佳的除藻效果。有研究将二溴海因和活性炭配合使用,结果发现适宜浓度的活性炭和二溴海因除藻效果较好,且不影响其他植物的正常生长[14]。此外,由于二溴海因的分子结构中氮溴键具有较强的活泼性,使其成为十分优秀的溴化剂使用,可通过溴化反应、取代反应、加成反应和氧化反应等来制备化工和制药生产中关键中间体等高值化学品[15-16],如可用于芳香烃、烯烃、苄醇等化学物的溴化合成医药中间体等[17-19]。随着科技和化工医药的快速发展和人们生活水平的不断提升,二溴海因的应用范围也随之扩展,需求量快速地增加。因此,如何高效绿色地合成二溴海因成为目前工艺生产关注的重点。
早在1994年,我国学者就采用了二甲基海因溴碱法来合成二溴海因,采用二甲基海因、溴单质及氢氧化钠水溶液为原料,在12 ℃左右反应1.5 h,使二甲基海因的氮原子上的氢与溴发生取代反应得到二溴海因产物、溴化钠副产物和大量的水,目标产物的收率可达到88%[20]。在此基础上,通过进一步控制反应pH值、提高反应温度、改善氢氧化钠溶液用量等优化反应条件可进一步提高二溴海因产品的收率,且可降低废水量的产生,在一定程度上降低了生产成本,提高了效益[21]。
目前,二溴海因合成方法主要有5,5-二甲基海因溴化法、5,5-二甲基海因溴化氯化法、5,5-二甲基海因氯化法等三种方法[22-23]。其中,5,5-二甲基海因溴化法不使用氯气,但在合成过程中需用到溴素,由于溴素的易挥发导致溴素单耗高,其利用率仅50%,成本太高且毒性大,操作不便;5,5-二甲基海因溴化氯化法首先经过溴化、再氯化得到最终产品,该方法可使溴素得到充分利用,溴素单耗低,但是合成过程用到氯气,需要配置复杂的尾气处理装置,同样地,生产过程中易发生氯气泄露,造成危害;5,5-二甲基海因氯化法则采用全氯合成法,同样需要配置复杂的尾气处理装置,以尽可能地消除尾气污染,但很难满足国家对安全、环保的要求[24-25]。有学者报道,采用5,5-二甲基海因、硫酸、溴酸钾、氢溴酸为原料来合成二溴海因,在室温条件下反应1 h可制备得到二甲基海因,通过考察5,5-二甲基海因、硫酸、水的用量和溴酸钾与溴化氢的配比对反应的影响,得到优化生产条件,当采用0 ℃为析出温度时,二溴海因产品的收率达到较好的效果[26]。该方法避免了使用溴素、氯气等毒性较大的原料,在一定程度上简化了生产工艺、降低了尾气污染的发生和生产设备成本,可较好地提高生产效益。然而,该方法中采用的氢溴酸作为原料,在一定程度上仍存在污染风险和操作难度大的情况。因此,开发一种环境友好、操作简单、成本低廉且能清洁生产二溴海因的方法或工艺是推动其广泛应用的关键之举。
1 实验部分
1.1 仪器和试剂
试剂:溴酸钾(KBr)、溴化钠(NaBr)、硫酸(H2SO4)、5,5-二甲基海因(DMH),试剂均为分析纯。仪器:反应釜、WRR熔点测定仪(上海仪电物理光学仪器有限公司)。
1.2 反应原理
本文中二溴海因清洁合成方法是以二甲基海因、溴酸钾、溴化钠和硫酸为反应原料,在温和条件进行反应,其主要反应方程式如下所示。
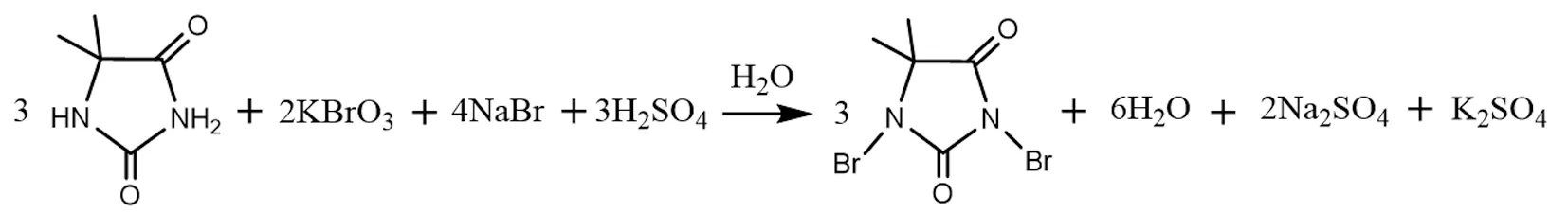
1.3 实验步骤
(1)在25 ℃及搅拌的条件下,将一定量的二甲基海因、溴酸钾、溴化钠溶解到一定量的水中。然后,向反应釜中滴加98%的硫酸,加完后在一定温度下搅拌反应3 h。
(2)反应结束后,将反应体系过滤、干燥,得到干燥的二溴海因产品,称重并按照下式计算二溴海因产品的收率(y)。
(1)
式中,mo和m1分别为二溴海因产品和理论二溴海因的质量(g)。
首先进行单因素实验,然后在单因素分析实验的基础上进行正交实验。5,5-二甲基海因的加人量0.5 mmoL,将溴酸钾、溴化钠、硫酸和水的加人量作为4个因素。每个因素选取3个水平进行正交实验,各因素及水平的取值如表1所示。

表1 正交实验数值表
2 结果与讨论
2.1 单因素实验
在本合成实验中,原料溴酸钾和溴化钠作为溴化试剂。在酸性条件下(H2SO4),原位氧化Br-生成溴, 溴取代二甲基海因分子中N-H上的H,得到目标产物1,3-二溴-5,5-二甲基海因,副产物主要为硫酸盐。由反应方程式的化学计量数关系可知,各个原料的理论反应量为:n(DMH)∶n(KBrO3)∶n(NaBr)∶n(H2SO4)=3∶2∶4∶3,首先,固定5,5-二甲基海因的用量为0.5 mmolL,在此基础上讨论其他各原料对反应产率的影响。
2.1.1 溴酸钾的用量对实验结果的影响
反应温度为25 ℃下,再加入水400 mL、DMH 64 g、溴化钠58.8 g,然后滴加硫酸11 g,加入溴酸钾反应时间3 h的条件下,考察不同溴酸钾的加人量对二溴海因产物收率的影响,由表2的结果可以看出,产品的收率随溴酸的加入有所升高,但升高幅度不大。在该反应中,溴酸钾作为氧化剂,溴酸钾、溴化钠在硫酸的作用下原位生成溴,若溴酸钾过少,则产生的溴源不足,影响反应收率。若溴酸钾过多,可能会进一步氧化产物二溴海因,产生其他副产物,降低产率,同时产生过量溴,还会使产品颜色加深,且易造成环境污染。

表2 溴酸钾用量对反映的影响
2.1.2 溴化钠的用量对实验结果的影响
表3是在反应温度为25 ℃,加入水400 mL、DMH 64 g、溴酸钾72.1 g、滴加硫酸11 g,加入溴化钠反应3 h的条件下,反应产物的收率随溴化钠的变化。随着溴化钠的增加,产物收率先增加然后趋于平衡。按化学反应式的计量比,n(溴化钾)∶n(溴化钠)=1∶2。当溴化钠用量较少时,产生的溴单质不足,使反应收率降低。

表3 溴化钠用量对反应的影响

表4 硫酸用量对反应的影响

表5 水用量对反应的影响
2.1.3 硫酸用量对实验结果的影响
加入水400 mL、DMH 64 g、溴化钠58.8 g、溴酸钾72.1 g,在反应温度为25 ℃下反应3 h,向反应中滴加硫酸,考察硫酸用量对反应的影响。由结果可知,目标产物的收率随硫酸的增加而增加。在反应中硫酸提供了一个酸性环境,以保证溴酸钾与溴化钠原位反应生成溴,若硫酸过少则该步反应难以顺利进行。若硫酸过量,二溴海因的溶解度会增大,降低收率,浪费原料。
2.1.4 水的用量对实验结果的影响
进一步考察了水的用量对反应影响,在25 ℃条件下加入DMH 64 g、溴化钠58.8 g、溴酸钾72.1 g及硫酸11 g,反应时间为3 h。结果发现,反应产物的收率随水的加入量基本无变化。一般情况下,适当增加水的用量会提高二溴海因在水中的溶解度,加快反应速率。若水量过少,则反应体系变得黏稠,反应不均匀,直接影响产品的纯度和颜色,导致目标产品的质量变差。因此,水的用量对目标产物的收率影响不大,但对反应过程具有一定的影响。
2.2 正交实验
关于水的用量,当采用350 mL导致反应体系后期物料较稠。用500 ml时产物收率相差无几,因此考虑到节能减排,水的用量采用400 mL比较适合,我们以下实验均用400 mL。
为确定关键影响因素对二溴海因收率的影响大小关系,设计正交实验以确定产品收率最佳工艺条件,正交实验结果见表6。由表中结果可知,各因素对二溴海因收率的影响大小顺序为:溴化钠>硫酸>溴酸钾,合成二溴海因的最佳条件为:64g5,5-二甲基海因、58.8 g溴酸钾、72.1 g溴化钠溶解到400 mL水中,滴加12 g 98%硫酸,在常温下搅拌反应3 h。

表6 正交实验结果表
通过以上分析可以发现,在各因素的影响下,溴化钠的影响最大,水的影响最小。获得了合成二溴海因的较优工艺:n(二甲基海因)∶n(溴酸钾)∶n(溴化钠)∶n(硫酸)=1∶0.86∶1.14∶0.24,在室温下搅拌反应3 h。在该优化条件下,二溴海因产物的收率可达到91%。对所得产品进行进一步分析,发现所得产品的有效溴含量为55.9%,纯度达到98.8%。该合成方法中采用溴化盐,绿色安全,是一种环境友好、操作简单、成本低廉且能清洁生产工艺。
3 结论
对二溴海因的合成工艺进行考察和优化,采用溴酸钾和溴化钠为产溴原料,环境友好。该合成方法得到的二溴海因产品不仅收率高,而且品质好,同时减少了溴的浪费,降低了生产成本,在很大程度上降低了对环境的污染。本合成技术绿色环保,操作方便,具有较好的经济效益和社会效益。

