铍矿浸出中和液室温循环沉淀工艺试验研究
苏玉成, 雷治武,2, 赵 旭, 郭昊童, 胡鄂明, 王红强, 胡 芳, 王清良
(1.南华大学 资源环境与安全工程学院, 湖南 衡阳 421001;2.东华理工大学 核资源与环境国家重点实验室, 江西 南昌 330013)
0 引言
铍是两性金属,既能溶于酸又能溶于碱[1-2]。目前,我国已探明的含铍矿石有30余种,其中仅有绿柱石(3BeO·Al2O3·6SiO2)、硅铍石(2BeO·SiO2)、金绿宝石(BeO·Al2O3)等几种具有经济价值[3-6]。铍可成为重要战略材料,应用于核工业、航空、电子工业、光学器件、机械制造等行业[7-10]。北京有色金属科学研究总院自1953年开始开发铍的提取冶金工艺,1958年我国建立了第一个铍冶炼厂——水口山第六冶炼厂[11],国内铍冶金技术不断开发并逐步完善。
目前,沉淀方法主要有缓冲法、均相沉淀法、气体沉淀剂法和点滴法。①缓冲法,是指将沉淀剂及被沉淀物溶液加入缓冲溶液中混合进行沉淀。由于缓冲溶液的作用沉淀物的过饱和度不大,有利于沉淀的长大,且易于实现连续操作[12]。②均相沉淀法,是指沉淀剂和被沉淀物同时存在于溶液中,但在一定条件下不发生作用,只有当条件改变时沉淀才会发生。该法既有利于沉淀的生长,又不需要大量的缓冲溶液。例如,加入尿素至待沉淀溶液中,由于尿素本身不能起沉淀剂作用,只有将溶液加热时尿素分解产生NH3,这时沉淀才得以发生。③气体沉淀剂法,该法所采用气体体积浓度相当低,例如用NH3作沉淀剂时需加空气稀释。加入气体沉淀剂后,造成溶液过饱和度较小,利于晶体长大,但沉淀费时[13]。上述3种方法还存在母液量大、有用成分损失过多、沉淀剂价格较贵、操作的可靠性差等缺点[14]。④点滴法,与气体沉淀剂法相似,是指将沉淀剂加入待沉淀溶液,加入足够的沉淀剂使沉淀完全。但有如下缺点:溶液过饱和度较大,晶核生成速度超过其成长速度,所得晶体颗粒尺寸小,可通过沉淀“老化”措施使情况有所改善;间歇操作,费时费力。
现有BeO生产方法大多采用中和液沉淀工艺,属点滴法,需加入氨水在煮沸条件下进行沉淀,在煮沸过程中氨水极易挥发,挥发出的氨水气体含有毒性铍化合物[15],不仅增加了氨水的消耗和热能消耗,还容易危害身体健康。基于此,本研究拟采用常温条件下循环沉淀的方式,研究中和液和氨水的加料顺序与体积变化的关系,以期为BeO的生产提供一种可行的绿色环保方法。
1 试验部分
1.1 试验试剂
试验所用中和液pH值为5.12,工业氨水浓度25%~28%,氢氧化钠为分析纯,这些材料均来自中国某铍业有限公司。其中,中和液为传统铍矿浸出液经中和初步除铝、铁等杂质后所得到的中和液,Be2+含量为42.045 g/L,Al3+含量为0.053 g/L,F-含量为1.302 g/L。
1.2 试验方法
1.2.1 常温循环沉淀试验
在2个烧杯中分别加入200 mL中和液,常温搅拌,加入氨水,调节pH值至7.5~8.0。
氢氧化铍沉淀析出,并持续搅拌30 min得到悬浊液,倒入量筒中,用少量的清水清洗烧杯中残余悬浊液并倒入量筒,静置8 h。随后取出上清液,将所留悬浊液沉淀(静置分层后下层部分,下文同此)放入烧杯,加入200 mL中和液,按上述方法进行循环沉淀,记录每次循环沉淀后悬浊液沉淀的体积;并在第2次循环沉淀过程中,对中和液和氨水加入悬浊液沉淀中的次序进行对比,分别对其次序进行编号(编号1为先加中和液再加氨水,编号2为先加氨水再加中和液),记录其对悬浊液体积变化的影响,并在先加中和液后加氨水的第6次循环沉淀时,每隔30 min记录悬浊液的体积变化。
1.2.2 常温循环沉淀扩大试验
取中和液500 mL,置于烧杯中,加入氨水,调节溶液pH值为7.5~8.0后持续搅拌30 min得到悬浊液,倒入量筒中,用少量的清水清洗烧杯中残余悬浊液并倒入量筒中,静置8 h。随后取出上清液,将所留悬浊液沉淀放入烧杯中,加入500 mL中和液,按上述方法进行循环沉淀并记录相关数据。分别在第10、15、20、25次沉淀结束并静置6~8 h后,取约50 mL悬浊液沉淀进行过滤,105 ℃烘干,分析悬浊液沉淀中BeO和F、Al含量。
1.3 试验原理与流程
氢氧化铍沉淀形成的基本原理[16]:铍矿石经与方解石或其他配料熔炼、酸化浸出后的一系列工序后,其中铁、镁、钙、氟、磷、硅等元素进入溶液,经过结晶离心、中和除铁除去以上元素,再进一步沉淀分离;用氨水调节pH值,使中和液中的硫酸铍发生沉淀反应并以氢氧化铍的固体形态析出,从而铍以氢氧化铍沉淀的形态从含铝、铁、钙、镁、钠、氟等离子的硫酸盐溶液中分离出来。主要化学反应式见式(1)。
BeSO4+2NH3·H2O=Be(OH)2↓+(NH4)2SO4
(1)
氢氧化铍沉淀形成工艺如图1所示。

图1 氢氧化铍沉淀形成流程
2 结果与讨论
2.1 氨水添加次序对循环沉淀效果的影响
工业上,沉淀快慢是影响生产效率的一个重要因素。在温度25 ℃、反应时间1 h、静置时间8 h的条件下,通过改变中和液与氨水添加顺序,研究其对循环沉淀效果的影响,试验结果如图2所示。

图2 氨水添加次序条件对循环沉淀的影响(编号1:先加中和液再加氨水;编号2:先加氨水再加中和液)
通过中和液与氨水添加次序条件验证,发现在前3次沉淀过程尚未稳定,编号1方式产生的沉淀悬浊液沉淀体积始终略低于编号2方式产生的悬浊液沉淀体积,在第4次沉淀过程趋于稳定后,编号1方式产沉淀悬浊液沉淀达到750 mL后开始稳定波动,编号2方式产沉淀悬浊液沉淀达到900 mL后开始稳定波动;编号1方式产生的沉淀悬浊液沉淀体积低于编号2方式产生的悬浊液沉淀体积。
水溶液中生成沉淀的过程是一种水-固相转化过程[14],对难溶物来说,往溶液中加入沉淀剂,离子浓度积大于其溶度积时,沉淀即产生。析出固体的过程可分为3个阶段进行:产生热力学不稳定或不平衡过饱和溶液;生成具有隐晶状态的晶核或晶体中心;晶体成长[14,17]。
在工业生产中,通常要求得到粗颗粒晶体,因此须减少晶核数量,即需降低溶液的过饱和度,这可通过降低第1次沉淀结晶前被沉淀离子在溶液中的实际浓度值或提高在该沉淀条件下被沉淀物质的溶解度来实现[14]。编号1:从第2次沉淀开始,由于中和液的酸性使溶液中的微小晶粒发生溶解,增大了溶液浓度,加入氨水进行搅拌,溶液中被沉淀物质继续在大晶粒上析出,促使晶体进一步长大。编号2:从第2次开始先加入氨水,溶液碱性增大,铍在pH值大于10.0时部分氢氧化铍发生了溶解形成铍酸钠,后加入酸性中和液使pH值降低,从而使溶液中溶解的铍以氢氧化铍的形式析出,继续生成更多的微小晶粒,造成晶体数量过多,沉淀体积增大,达不到粗晶体的效果。因此,编号1方式即先加中和液再加氨水,沉淀效率较好。
2.2 常温条件下循环沉淀观察沉降变化
在沉淀初始阶段,晶核在不断生成,随着沉淀次数增加,沉淀悬浊液体积逐渐稳定,观察先加中和液后加氨水的第6次循环沉淀悬浊液体积变化过程,如图3所示。
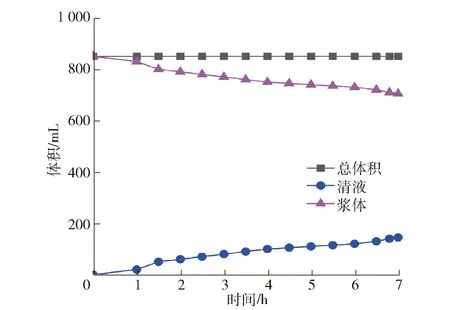
图3 常温中和液循环沉淀第6次悬浊液沉淀变化
图3中,随着时间的延长,总体积没有变化,沉淀悬浊液体积不断减小,即逐渐下沉堆积,从而清液体积不断增大,出现明显的固液分离。根据统计学观点,能量波动,是自发结晶过程中晶核形成的必要条件[14,17]。由图3可以看出,悬浊液沉淀的结晶变化是自发进行的;能量波动是由于体系内质点动能大小不均衡性造成的,动能低的质点在体系中聚集,引起体系局部微小体积内温度下降,从而满足体系形成临界晶核时对能量增加的需求。从热力学原则的角度来看,任何过程自动进行,将导致体系自由能减小[18-23]。在这种情况下,溶液中晶体的形成过程可以被解释为体系自发地寻求更低自由能状态的结果。沉淀结晶发生后,会有大小不同晶核生成,对临界半径的晶核(临界晶核)而言,当其尺寸增大时,体系自由能减小。
在生产过程中,粗颗粒晶体的形成有利于溶液与晶体分离、晶体的洗涤等后续工序的进行。
2.3 SEM表征分析
第25次沉淀产物(a~c)和第10次沉淀产物(d~f)的SEM图如图4所示。

图4 第25次沉淀(a~c)和第10次沉淀(d~f)的SEM图
通过对比图4(a)和(d)可知,第25次沉淀的氢氧化铍晶核较第10次沉淀的氢氧化铍晶核变大。在沉淀结晶最后阶段,系统达到液固溶解度平衡,晶体与界面处溶液达到平衡状态,即被沉淀物质的溶解度近似等于晶体界面处溶液的浓度,晶粒停止长大。工艺处理过程中,在适当温度下搅拌,系统的固液平衡状态破坏,再静置,以利于结晶粒子长大,即“老化”过程[14]。同一系统中,细小晶体的溶解度要远大于粗晶体的溶解度[24]。粗晶体在溶液中处于饱和状态,而微小晶体处于非饱和,即微晶溶解,促使溶液浓度增加,根据扩散作用[15],被沉淀物质继续在大粒晶体上析出,大粒晶体进一步长大。在下一次沉淀时,利用上一次悬浊液的沉淀作为晶种,微晶发生溶解,增大溶液浓度,粗晶体继续长大,不断重复此过程,细微晶粒溶解,同时粗大晶粒变大。由此得出,在第25次沉淀所产生的晶核质量远大于第10次沉淀所产生的晶核质量。
2.4 最佳条件扩大验证
2.4.1 中和液循环沉淀用氨水体积
在最佳条件25 ℃、反应1 h、静置8 h、每次氨水消耗量55~64 mL下,考察循环次数与加氨水体积之间的关系,如图5所示。
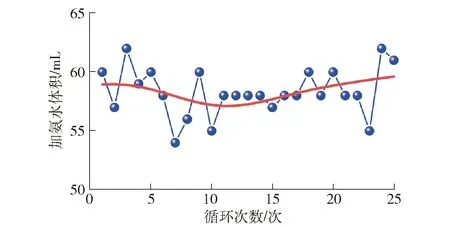
图5 25 ℃下中和液循环沉淀加入氨水体积变化曲线
由试验观察可知,在传统中和液煮沸沉淀过程中,中和液煮沸后,缓慢加入氨水,调节溶液pH值为7.5~8.0,消耗氨水270 mL,持续煮沸搅拌0.5 h后溶液pH值降至5.51,然后边搅拌边补加氨水 80 mL,直至溶液pH值为7.50,共消耗氨水350 mL。加热煮沸条件下,氨水极易挥发,氨水消耗量大。相比之下,常温中和液循环沉淀氨水消耗量减少了70%以上,不仅较大程度上节约了氨水用量,还降低了能耗并减少了加热设施的投入,很大程度上节约了成本。
2.4.2 循环次数对中和液循环沉淀悬浊液体积的影响
在最佳条件为25 ℃、反应1 h、静置8 h、循环沉淀25次时,进行扩大验证试验。如图6所示,从第3次循环沉淀开始,固液分离现象清晰可见,从第5次循环沉淀开始,悬浊液沉淀体积呈波动上升趋势,直至第10次后保持平稳波动。

图6 25 ℃中和液循环沉淀悬浊液变化曲线
2.4.3 产品分析与对比
对比煮沸与25 ℃条件下氢氧化铍中BeO和F、Al含量,见表1、表2。

表1 室温循环沉淀扩大试验沉淀物含量分析

表2 中和液煮沸沉淀含量分析
表2为工厂原有煮沸工艺所得Be(OH)2样品。通过对比表1和表2的数据,可以得出结论:在高温煮沸条件下与室温条件下,BeO和F的含量相当,并没有明显的差异,且室温条件下中和液循环沉淀的Al2O3含量低于传统煮沸中和液沉淀的方式,因此降低了杂质含量,减少了能源的消耗,并减少70%氨水用量和有毒气体的散发,进而降低了操作岗位的危险系数。
对室温条件下中和液循环沉淀产物与传统煮沸中和液沉淀产物进行SEM分析,如图7所示。

图7 本文工艺与现有工艺生产的沉淀产物SEM图
从图7可知,经过后续洗涤工艺后室温和煮沸2种条件下得到的沉淀产物形貌相近,均呈现分布均匀的大颗粒,抽滤后的沉淀产物的重量彼此接近。
3 结论
1)现有氢氧化铍生产工艺多以煮沸的方式添加氨水进行沉淀,增大氨水挥发程度,能耗大。为降低氨水挥发对操作人员的危害、减少能源消耗、节省加热设备的投入,本研究选择在室温下对中和液进行循环沉淀试验。
2)通过氨水调节pH值,使中和液中的硫酸铍以氢氧化铍的固体形态沉淀析出,以从含有铝、铁、钙、镁、钠、氟等离子的硫酸盐溶液中分离铍。本试验采用室温条件下循环沉淀,增加沉淀晶体粒度,在循环前期,沉淀效果和循环次数呈正相关,达到一定次数之后趋于稳定。
3)在最佳条件为室温25 ℃、反应1 h、静置8 h、循环25次时,所得氢氧化铍产品质量与市场上氢氧化铍产品BeO含量相当,且降低了杂质Al2O3含量,并减小了氨水的挥发,使氨水的消耗量减少了70%,还有效降低了铍中和液沉淀工序对人体的危害。该研究为之后铍中和液沉淀工序的改进提供了一定的理论支撑。

