丁酸通过激活G蛋白偶联受体41/43通路降低高血压大鼠血压
秦春迪 马雯 李圆 朱雅泉 李瑜 邹琳 张昕
摘要:目的 探討丁酸通过激活G蛋白偶联受体41/43(GPR41/43)通路降低高血压模型大鼠血压的机制。方法 75只雄性SD大鼠随机分为假手术组(15只)和造模组(60只),采用两肾一夹方法建立高血压大鼠模型,将成模鼠随机分为对照组(超纯水0.1 mL/kg)、丁酸高剂量组(220 mg/kg)、丁酸低剂量组(110 mg/kg)和缬沙坦组(30 mg/kg),每组15只,连续灌胃给药4周。分别在给药前后测量大鼠尾动脉收缩压(SBP)及心率(HR)。采用酶联免疫吸附试验(ELISA)检测大鼠血清中白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)及内皮型一氧化氮合酶(eNOS)含量;实时荧光定量PCR(qPCR)检测大鼠胸主动脉组织中IL-6、TNF-α、eNOS的mRNA表达水平。免疫组织化学染色检测大鼠胸主动脉GPR41/43表达量。结果 给药2周,对照组大鼠SBP较假手术组显著升高(P<0.05),丁酸高剂量组、丁酸低剂量组、缬沙坦组SBP较对照组降低,且丁酸高剂量组低于低剂量组(P<0.05)。给药4周,丁酸高剂量组较丁酸低剂量组SBP明显降低(P<0.05);给药前后各组大鼠HR差异均无统计学意义(P>0.05)。给药后丁酸高剂量组、丁酸低剂量组eNOS蛋白和mRNA表达量较对照组增加,IL-6、TNF-α蛋白及mRNA表达量均降低(P<0.05)。免疫组织化学染色显示,大鼠胸主动脉组织的GPR41/43表达较对照组增加,且高于缬沙坦组(P<0.05)。结论 丁酸对高血压大鼠有明显的降压作用,可能与激活GPR41/43通路增加血管舒张,抑制炎性因子表达有关。
关键词:丁酸盐类;高血压;受体,G-蛋白偶联;白细胞介素6;肿瘤坏死因子α;一氧化氮合酶Ⅲ型
中图分类号:R349.6文献标志码:ADOI:10.11958/20221713
Butyrate reduces blood pressure in hypertensive rats by activating the G protein-coupled
receptor 41/43 pathway
QIN Chundi, MA Wen, LI Yuan, ZHU Yaquan, LI Yu, ZOU Lin, ZHANG Xin
Department of Cardiology, the First Affiliated Hospital of Baotou Medical College, Inner Mongolia University of
Science and Technology, Baotou 014010, China
Corresponding Author E-mail: zhangxinwdq@sina.com
Abstract: Objective To investigate the mechanism of butyrate reducing blood pressure in hypertensive model rats by activating G protein-coupled receptor 41/43 (GPR41/43) pathway. Methods Seventy-five male SD rats were randomly divided into the sham operation group (n=15) and the model group (n=60). Hypertensive rat model was established by two kidneys and one clip method. Model rats were randomly divided into the control group (0.1 mL/kg ultra-pure water), the butyrate high-dose group (220 mg/kg), the butyrate low-dose group (110 mg/kg) and the valsartan group (30 mg/kg), with 15 rats in each group. Rats were given intervention by cntinuous gavage for 4 weeks. Caudal artery systolic blood pressure (SBP) and heart rate (HR) were measured before and after administration. The serum levels of interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α) and endothelial nitric oxide synthase (eNOS) were detected by enzyme-linked immunosorbent assay (ELISA). The mRNA expression levels of IL-6, TNF-α and eNOS in thoracic aorta were detected by real-time fluorescent quantitative PCR (qPCR). The expression of GPR41/43 in rat thoracic aorta was detected by immunohistochemistry. Results After 2 weeks of administration, SBP was significantly higher in the control group than that in the sham operation group (P<0.05). Values of SBP were significantly lower in the high dose butyrate group, the low dose butyrate group and the valsartan group than those in the control group, and SBP was significantly lower in the butyrate high dose group than that of the butyrate low dose group (P<0.05). After 4 weeks of administration, SBP was significantly lower in the high dose group than that in the low dose group (P<0.05). There were no significant differences in HR before and after administration between groups (P>0.05). After administration, the protein expression and mRNA expression of eNOS were increased in the butyrate high dose group and the butyrate low dose group compared with those of the control group, and the protein expression and mRNA expression of IL-6 and TNF-α were decreased (P<0.05). Immunohistochemistry showed that the expression of GPR41/43 in rat thoracic aorta tissue was increased compared with that of the control group, and which was higher than that in the valsartan group (P<0.05). Conclusion Butyrate has a significant antihypertensive effect on hypertensive rats, which may be related to the activation of GPR41/43 pathway to increase vasodilation and inhibit expression of inflammatory factors..
Key words: butyrates; hypertension; receptors, G-protein-coupled; interleukin-6; tumor necrosis factor-alpha; nitric oxide synthase type Ⅲ
高血压是以体循环动脉压升高为特征的心血管疾病,可伴随心脏、大脑、肾脏等重要靶器官损伤,其发病机制仍未完全明确。有研究表明,肠道菌群参与了高血压和多种慢性疾病的发生与发展,调整肠道菌群可能成为降压治疗新的干预方向[1]。丁酸是一种短链脂肪酸(short-chain fatty acids,SCFAs),由肠道中未消化的碳水化合物经厌氧细菌发酵产生,能够进入血液循环[2]。SCFAs通过作用于G蛋白偶联受体(Gprotein-coupled receptors,GPCRs)参与血压的调节,主要作用包括抗炎、免疫调节、影响肾素分泌、介导血管舒张等。目前研究报道了丁酸的降压作用[3],但其降压机制尚未阐明。本研究采用两肾一夹(two-kidney-one-clip,2K1C)方法建立高血压大鼠模型,观察丁酸是否通过激活GPR41/43通路抑制炎性因子,减轻血管内皮功能损伤,从而降低血压。
1 材料与方法
1.1 实验动物 SPF级6周龄健康雄性SD大鼠75只,体质量(180±10)g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0011。在内蒙古科技大学包头医学院转化医学中心适应性饲养1周,饲养期间大鼠自由摄食、饮水,光照周期12 h/12 h。
1.2 主要试剂与仪器 丁酸钠(货号V900464-25G)购自美国Sigma公司;缬沙坦(货号H20040217)购自北京诺华制药有限公司;肿瘤坏死因子α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(货号XFR31543)、白细胞介素6(IL-6)ELISA试剂盒(货号XFR30277)、内皮型一氧化氮合酶(eNOS)ELISA试剂盒(货号XFR30939)购自上海信帆生物科技有限公司;兔抗鼠GPR41抗体(一抗,货号AF9075)购自美国Affinity公司;兔抗鼠GPR43抗体(一抗,货号bs-13536R)购自北京博奥森生物技术有限公司;SYBR Green PCR试剂盒(货号#K0223)购自美国Thermo Fisher Scientific公司;逆转录试剂盒(货号#K1622)购自美国Fermentas公司。本实验所用引物均由上海信帆生物科技有限公司合成。BP-300A大鼠无创血压测量系统(成都泰盟),ABI-7300荧光定量PCR检测仪(美国ABI公司),RT-6100酶标仪(深圳雷杜生命科学股份有限公司),CX41正置显微镜(日本OLYMPUS公司),D5100数码相机(日本NIKON公司)。
1.3 方法
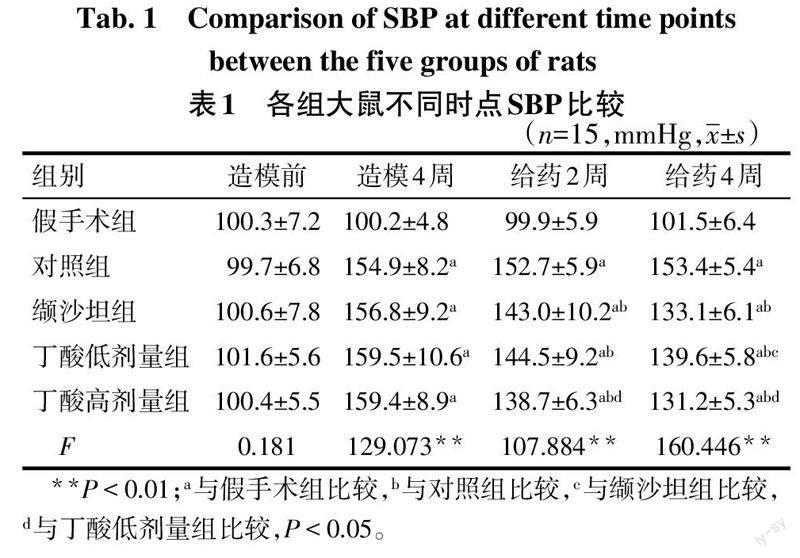
1.3.1 高血压动物模型构建 将大鼠采用随机数字表法进行分组,15只为假手术组,其余60只为造模组,采用2K1C方法建立高血压模型。大鼠术前12 h禁食水,腹腔注射2%戊巴比妥钠(1.5 mL/kg)麻醉。剪毛,皮肤碘酊消毒后,取腹正中线开口,使用玻璃分针游离左肾动脉,采用内径为0.2 mm的银夹套于左肾动脉造成肾动脉狭窄。回纳肾脏后关腹、缝合,腹腔注射1次青霉素5万U预防感染。假手术组只游离左肾动脉,其余处理相同。术后4周大鼠尾动脉收缩压(SBP)较术前上升30 mmHg(1 mmHg=0.133 kPa)视为高血压模型建立成功[4]。
1.3.2 分组及给药 将60只成模鼠随机分为对照组、丁酸高剂量组、丁酸低剂量组和缬沙坦组,每组15只。丁酸高、低剂量组分别给予丁酸钠220 mg/kg和110 mg/kg灌胃,缬沙坦组给予缬沙坦30 mg/kg灌胃,对照组及假手术组给予超纯水(0.1 mL/kg)灌胃,每日1次,连续干预4周。
1.3.3 SBP及心率(HR)测量 利用动物无创血压测量仪对各组大鼠自术前至末次给药每周测量尾动脉的SBP和HR。预热血压测量机器后,将加压套置于鼠尾根部,传感器贴紧鼠尾。待大鼠脉搏稳定后,连续测量3次,每次间隔不少于1 min,记录并计算SBP和HR平均值。
1.3.4 大鼠血清及胸主动脉标本留取 末次给药12 h后,使用2%戊巴比妥钠(1.5 mL/kg)腹腔注射麻醉大鼠。麻醉后剪毛,取5 mL腹主动脉血置于采血管,3 000 r/min离心10 min后,取血清于-80 ℃保存。处死大鼠,剪下胸主动脉,用生理盐水灌洗胸主动脉至腔内无残余血液。将其二等分,置于-80 ℃冰箱保存或4%多聚甲醛固定,用于定量PCR(qPCR)及免疫組织化学(IHC)染色。
1.3.5 ELISA检测大鼠血清中eNOS、IL-6、TNF-α表达 取1 mL大鼠血清,按ELISA试剂盒说明书步骤检测大鼠血清中eNOS、IL-6、TNF-α蛋白表达水平。每组15个样本进行实验。
1.3.6 qPCR检测eNOS、IL-6、TNF-α mRNA表达 取大鼠胸主动脉组织,提取组织总RNA。按反转录试剂盒说明书合成cDNA后进行扩增。采集荧光信号40个循环。eNOS引物:上游5′-CTTTCGGAAGGCGTTTGAC-3′,下游5′-AACTC TTGTGCTGCTCAGG-3′;IL-6引物:上游5′-CACCAG GAACGAAAGTCAAC-3′,下游5′-CAGTGGCTGTCAACAA CATC-3′;TNF-α引物:上游5′-TGGCGTGTTCATCCGTTC-3′,下游5′-CTACTTCAGCGTCTCGTGTG-3′;内参GAPDH引物:上游5′-GTCGGTGTGAACGGATTTG-3′,下游5′-TCCCATTCTCAGCCTTGAC-3′。目的基因的相对表达水平用2-ΔΔCt表示。每组取5个样本进行实验。
1.3.7 IHC染色检测大鼠胸主动脉组织中GPR41/43的表达情况 取4%多聚甲醛固定的胸主动脉标本,每组5个,梯度乙醇脱水,石蜡包埋后切片。常规脱蜡,水化后抗原修复,加3%H2O2阻断内源性过氧化物酶,湿盒孵育,用PBS清洗,弃去PBS,加非免疫、正常羊血清封闭非特异性抗原,37 ℃湿盒孵育30 min,PBS清洗后分别滴加抗体GPR41或GPR43(一抗),4 ℃孵育过夜。PBS清洗后加广谱二抗,37 ℃孵育60 min,PBS洗清3次,DAB显色,苏木素复染,脱水、透明后中性树胶封片。每张切片随机读取3个视野,使用Image Pro Plus 6.0测量阳性染色面积(A)和积分光密度(IOD),计算平均光密度(MOD),MOD=IOD/A。
1.4 统计学方法 采用SPSS 26.0软件进行数据分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
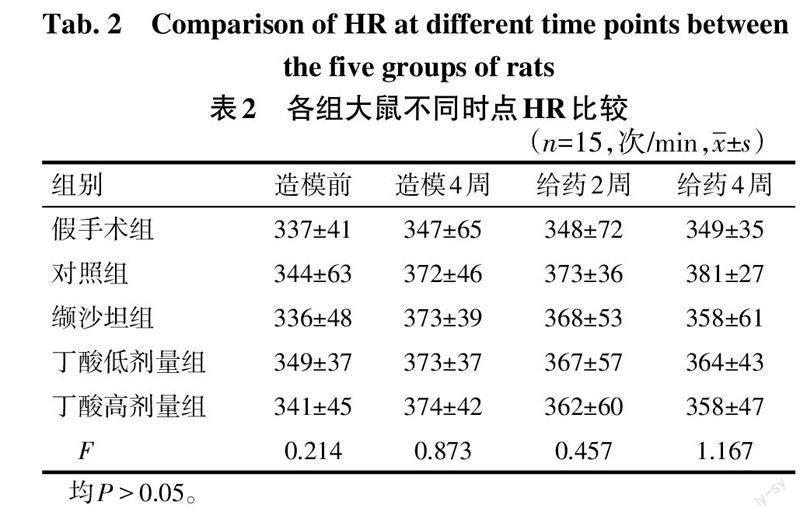
2.1 各组大鼠SBP和HR比较 造模前各组大鼠SBP差异均无统计学意义(P>0.05);造模4周,所有成模鼠SBP较假手术组均升高(P<0.05);给药2周,缬沙坦组,丁酸高、低剂量组SBP较对照组降低,且丁酸高剂量组低于低剂量组(P<0.05),丁酸高、低剂量组与缬沙坦组差异无统计学意义(P>0.05)。给药4周,丁酸高剂量组SBP低于低剂量组(P<0.05),与缬沙坦组差异无统计学意义(P>0.05)。见表1。给药前后各组大鼠HR差异均无统计学意义(P>0.05)。见表2。
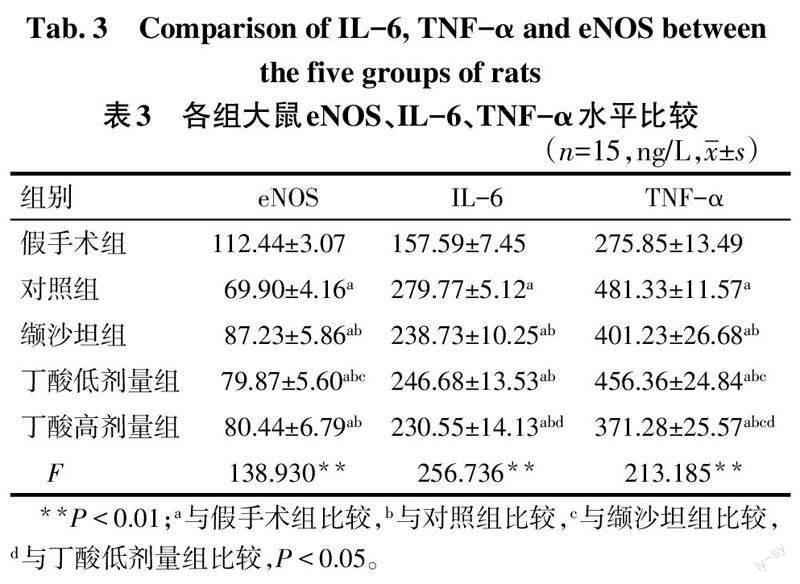
2.2 各组大鼠eNOS、IL-6、TNF-α水平比较 与对照组相比,缬沙坦组及丁酸高、低剂量组eNOS表达水平均增加(P<0.05);丁酸高剂量组与低剂量组、缬沙坦组差异无统计学意义(P>0.05),但丁酸低剂量组低于缬沙坦组(P<0.05)。与对照组相比,丁酸高、低剂量及缬沙坦组IL-6、TNF-α表达水平均降低(P<0.05);丁酸高、低剂量组与缬沙坦组IL-6水平比较差异无统计学意义(P>0.05),但丁酸高剂量组低于低剂量组(P<0.05)。丁酸高剂量组TNF-α水平低于低剂量组及缬沙坦组,丁酸低剂量组高于缬沙坦组(P<0.05)。见表3。
2.3 各组大鼠eNOS、IL-6、TNF-α mRNA相对表达量比较 各组大鼠胸主动脉组织eNOS、IL-6、TNF-α mRNA相对表达量的比较变化与血清蛋白检测结果一致。见表4。
2.4 各组大鼠胸主动脉GPR41、GPR43表达量的比较 IHC染色显示,对照组与假手术组相比,GPR41表达量差异无统计学意义(P>0.05);与假手术组及对照组相比,丁酸高、低剂量组及缬沙坦组均升高,且丁酸高、低剂量组均高于缬沙坦组(P<0.05)。假手术组、对照組及缬沙坦组GPR43表达量差异无统计学意义(P>0.05);丁酸高、低剂量组均高于假手术组、对照组及缬沙坦组,且丁酸高剂量组高于低剂量组(P<0.05)。见图1、表5。
3 讨论
丁酸是重要的SCFAs组成成分,与乙酸、丙酸共占肠道菌群生成的SCFAs的80%。Onyszkiewicz等[5]发现,丁酸盐可穿过肠道-血管屏障进人血液,通过作用GPR41/43对肠系膜动脉产生血管舒张作用。本研究通过2K1C方法建立高血压大鼠模型,探讨丁酸对高血压大鼠降压作用机制。
3.1 丁酸具有明显的降血压及保护血管内皮功能效果 有研究表明,与正常血压人群相比,高血压患者血液中丁酸水平降低,而粪便SCFAs水平升高,补充SCFAs治疗可降低血压[6]。血管内皮舒张因子是体内血压调节重要的因子之一,包括一氧化氮(NO)、前列腺素、内皮衍生的超极化因子等[7]。eNOS促进血管内皮细胞产生NO促进血管扩张,从而影响血管内皮功能,主要表现为对血管内皮细胞分泌舒张血管物质及血管内皮通透性的影响[8]。Jani?等[9]研究表明,沙坦类降血压药物可以通过增加一氧化氮合酶的表达量从而降低大鼠血压。本研究证实丁酸可以提升高血压大鼠血管eNOS表达量来舒张血管,其降低血压效应与缬沙坦相当。
3.2 丁酸通过抗炎作用保护血管内皮功能 研究发现,炎症可以导致各种因素(如糖尿病和低血脂)下内皮细胞激活而引发高血压[10]。反之,高血压也会使血管内皮细胞激活,导致炎症反应,进一步引起高血压加剧,形成恶性循环。C反应蛋白、IL-6及TNF-α均与高血压发生呈正相关[11]。IL-6是由细胞分泌的多功能炎性细胞因子,可以调节免疫应答和炎症反应。血管内皮细胞和血管平滑肌细胞均可分泌IL-6,它可促进血管平滑肌细胞增殖、分化及动脉硬化发生[12]。TNF-α与IL-6相似,是由巨噬细胞分泌的炎性细胞因子。TNF-α通过直接的细胞毒性作用破坏血管内皮细胞结构和功能的完整性,导致内皮功能障碍,从而使血管壁增厚、管腔狭窄、外周阻力增高,因此降低TNF-α对于降低血压极为重要[13]。本研究表明,丁酸可以降低炎性因子TNF-α和IL-6 mRNA和蛋白的表达,效果与缬沙坦相当。Silveira-Nunes等[14]研究表明,SCFAs能够抑制激活的核因子(NF)-κB与免疫细胞的结合,从而阻止炎症反应和抑制TNF-α和IL-6产生。本研究结果表明,丁酸很可能是通过激活GPR41和GPR43来降低血管炎症,产生降压作用。但也有文献报道激活GPR41和GPR43可以促使肥大细胞释放炎性因子[15-16]。不排除不同模型环境中有不同的作用,有待于进一步研究。
3.3 丁酸通过作用GPR41/43通路增加血管舒张作用 GPCRs是跨细胞膜传递信号,转导并介导人体生理所需的大量细胞反应最大和最多样的超家族跨膜受体。GPR41主要分布于血管内皮,SCFAs作用于GPR41可能产生血管舒张作用。GPR43分布广泛,SCFAs与其作用具有诱导抗炎、修复功能。GPR41/43的激活可以产生血管舒张作用,进而降低血压[17]。有文献表明,丁酸可以改变GPR41/43核心启动子区域甲基化率和染色质压缩程度,通过影响表观遗传从而改变GPR41/43基因转录水平,进而影响GPR41/43蛋白表达[18]。Natarajan等[19]发现,GPR41基因敲除小鼠的血压明显高于未敲除该受体的小鼠,且收缩压升高更为明显,敲除该基因后会出现主动脉增厚、血管胶原蛋白增加,从而导致血管纤维化而引发高血压。本研究表明,丁酸干预后大鼠主动脉血管内皮细胞GPR41/43抗原表达明显增加,可能由于丁酸吸收入血导致GPR41/43的激活,从而产生对血管的舒张作用,降低血压。
总之,丁酸可以激活GPR41/43通路,增加eNOS的释放,导致血管舒张,同时降低血管炎性因子TNF-α和IL-6表达,减轻对血管内皮功能及结构的损伤,最终达到降低血压、保护血管内皮的作用。
参考文献
[1] JIN M,QIAN Z,YIN J,et al. The role of intestinal microbiota in cardiovascular disease[J]. J Cell Mol Med,2019,23(4):2343-2350. doi:10.1111/jcmm.14195.
[2] 李翠茹,彭买姣,谭周进. 肠道菌群相关短链脂肪酸的研究进展[J]. 世界华人消化杂志,2022,30(13):562-570. LI C R,PENG M J,TAN Z J. Progress in research of intestinal microbiota related short chain fatty acids[J]. World Chinese Journal of Digestology,2022,30(13):562-570. doi:10.11569/wcjd.v30.i13.562.
[3] WANG L,ZHU Q,LU A,et al. Sodium butyrate suppresses angiotensin II-induced hypertension by inhibition of renal (pro)renin receptor and intrarenal renin-angiotensin system[J]. J Hypertens,2017,35(9):1899-1908. doi:10.1097/HJH.0000000000001378.
[4] 闫宇涵,王占黎,胡海,等. 基于气相色谱-飞行时间质谱联用技术的肾性高血压大鼠模型粪便代谢组学分析[J]. 实用心脑肺血管病杂志,2021,29(7):92-96. YAN Y H,WANG Z L,HU H,et al. Fecal metabonomics in renal hypertensive rats based on gas chromatography-time-of-flight mass spectrometry technology[J]. Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2021,29(7):92-96. doi:10.12114/j.issn.1008-5971.2021.00.151.
[5] ONYSZKIEWICZ M,GAWRYS-KOPCZYNSKA M,KONOPELSKI P,et al. Butyric acid,a gut bacteria metabolite,lowers arterial blood pressure via colon-vagus nerve signaling and GPR41/43 receptors[J]. Pflugers Archiv,2019,471(11/12)1441-1453. doi:10.1007/s00424-019-02322-y.
[6] KIM S,GOEL R,KUMAR A,et al. Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure[J]. Clin Sci(Lond),2018,132(6):701-718. doi:10.1042/CS20180087.
[7] 李景文,龍村. 血管内皮的收缩和舒张因子研究进展[J]. 中国体外循环杂志,2004,2(1):61-63,48. LI J W,LONG C. Research progress on contractile and diastolic factors of vascular endothelium[J]. Chin J ECC,2004,2(1):61-63,48. doi:10.13498/j.cnki.chin.j.ecc.2004.01.026.
[8] KUMAR G,DEY S K,KUNDU S. Functional implications of vascular endothelium in regulation of endothelial nitric oxide synthesis to control blood pressure and cardiac functions [J]. Life Sci,2020,259:118377. doi:10.1016/j.lfs.2020.118377.
[9] JANI? M,LUNDER M,ZUPAN J,et al. The low-dose atorvastatin and valsartan combination effectively protects the arterial wall from atherogenic diet-induced impairment in the guinea pig[J]. Eur J Pharmacol,2014,743:31-36. doi:10.1016/j.ejphar.2014.09.027.
[10] 徐嘉欣,殷立平. 炎症在高血压肾损害中的研究进展[J]. 中国处方药,2022,20(4):189-191. XU J X,YIN L P. Research progress of inflammation in hypertensive renal damage[J]. Journal of China Prescription Drug,2022,20(4):189-191.
[11] 傅为武,李旷怡,张英俭,等. 高血压炎症反应与血压达标及动脉硬化相关性[J]. 中医学报,2022,37(6):1185-1191. FU W W,LI K Y,ZHANG Y J,et al. Research progress on relationship between hypertensive inflammatory response,blood pressure reaching standard and arteriosclerosis[J]. Acta Chinese Medicine,2022,37(6):1185-1191. doi:10.16368/j.issn.1674-8999.2022.06.218.
[12] 陳亮,刘晓华,宋明慧,等. 高血压病患者血清白细胞介素-6的变化与临床意义[J]. 中国医药指南,2016,14(21):134-135. CHEN L,LIU X H,SONG M H,et al. Changes and clinical significance of serum interleukin-6 in patients with hypertension[J]. Guide of China Medicine,2016,14(21):134-135. doi:10.15912/j.cnki.gocm.2016.21.116.
[13] 王青梅,冯玉宝,李永玲,等. 降压治疗对原发性高血压患者血压及血清IL-6、TNF-α季节性变异的影响[J]. 中华临床医师杂志(电子版),2015,9(23):4325-4330. WANG Q M,FENG Y B,LI Y L,et al. Impact of antihypertension on seasonal variability of blood pressure,serum IL-6,TNF-α levels in essential hypertension[J]. Chin J Clinicians(Electronic Edition),2015,9(23):4325-4330. doi:10.3877/cma.j.issn.1674-0785.2015.23.014.
[14] SILVEIRA-NUNES G,DURSO D F,DE OLIVEIRA JR L R A,et al. Hypertension is associated with intestinal microbiota dysbiosis and inflammation in a Brazilian population[J]. Front Pharmacol,2020,11:258. doi:10.3389/fphar.2020.00258.
[15] 陈华青,刘明耀. G蛋白偶联受体及其信号转导在免疫与炎症中的作用[J]. 现代免疫学,2009,29(6):441-446. CHEN H Q,LIU M Y. G protein-coupled receptors and their signal transduction in immunity and inflammation[J]. Current Immunology,2009,29(6):441-446.
[16] 魏钰倩,苏文星,季江,等. G蛋白偶联受体在肥大细胞激活中的作用研究进展[J]. 中国皮肤性病学杂志,2021,35(5):565-569. WEI Y Q,SU W X,JI J,et al. Research progress on the role of G protein-coupled receptors in mast cell activation[J]. Chin J Derm Venereol,2021,35(5):565-569. doi:10.13735/j.cjdv.1001-7089.202007034.
[17] 杜红霞,肖光旭,杜晓鹂,等. G蛋白偶联受体在血压调节中的新作用[J]. 中国中药杂志,2021,46(1):6-14. DU H X,XIAO G X,DU X L,et al. New effect of G-protein coupled receptors on blood pressure regulation[J]. China Journal of Chinese Materia Medica,2021,46(1):6-14. doi:10.19540/j.cnki.cjcmm.20200930.601.
[18] 张欢敏,汪艳,常广军,等. 高精料对奶山羊盲肠中SCFAs-GPR41/43介导的炎症反应的影响[J]. 畜牧与兽医,2018,50(2):61-66. ZHANG H M,WANG Y,CHANG G J,et al. Effect of high-concentrate diet on the inflammatory response mediated by short-chain fatty acids-GPR41/43 in cecum of lactating goats[J]. Animal Husbandry & Veterinary Medicine,2018,50(2):61-66.
[19] NATARAJAN N,HORI D,FLAVAHAN S,et al. Microbial short chain fatty acid metabolites lower blood pressure via endothelial G protein-coupled receptor 41[J]. Physiol Genomics,2016,48(11):826-834. doi:10.1152/physiolgenomics.00089.2016.
(2022-10-27收稿 2023-01-31修回)
(本文编辑 李鹏)

