金丝桃苷抑制鼻咽癌细胞生物学行为的分子机制研究
葛塬 马佐鹏 王延华

摘要:目的 探讨金丝桃苷对鼻咽癌细胞增殖、迁移和侵袭等生物学行为的影响和機制。方法 采用10、20及40 mg/L金丝桃苷的培养液孵育SUNE1细胞,依次记为低、中、高剂量组;将长链非编码RNA(lncRNA)配对盒基因8反义RNA 1(PAX8-AS1)过表达或敲低质粒、miR-494-3p模拟物及其阴性对照分别转染至40 mg/L金丝桃苷处理的SUNE1细胞,采用CCK-8实验、平板克隆实验、Transwell实验检测SUNE1细胞活力、克隆形成以及迁移和侵袭。蛋白质印记法分析基质金属蛋白酶(MMP)-2和MMP-9蛋白表达。实时荧光定量聚合酶链反应(RT-qPCR)检测lncRNA PAX8-AS1和miR-494-3p表达。双荧光素酶报告实验分析lncRNA PAX8-AS1和miR-494-3p靶向关系。结果 低、中、高剂量金丝桃苷降低SUNE1细胞活力、迁移数和侵袭数,下调MMP-2蛋白、MMP-9蛋白以及miR-494-3p表达水平,上调lncRNA PAX8-AS1表达水平(P<0.05)。lncRNA PAX8-AS1靶向负调控miR-494-3p表达。过表达lncRNA PAX8-AS1增强40 mg/L金丝桃苷对SUNE1细胞活力、迁移、侵袭以及MMP-2、MMP-9蛋白表达的抑制作用(P<0.05)。敲低lncRNA PAX8-AS1和过表达miR-494-3p均减弱40 mg/L金丝桃苷对SUNE1细胞活力、迁移、侵袭以及MMP-2、MMP-9蛋白表达的抑制作用(P<0.05)。结论 金丝桃苷可能通过上调lncRNA PAX8-AS1/miR-494-3p轴来抑制鼻咽癌细胞增殖、迁移和侵袭。
关键词:鼻咽肿瘤;药理作用分子作用机制;基因,肿瘤抑制;细胞增殖;肿瘤侵润;金丝桃苷;lncRNA PAX8-AS1;miR-494-3p
中图分类号:R739.6 文献标志码:A DOI:10.11958/20220805
Molecular mechanism of hyperoside inhibiting the biological behavior of
nasopharyngeal carcinoma cells
GE Yuan, MA Zuopeng, WANG Yanhua
Department of Otolaryngology, Qinghai Red Cross Hospital, Xining 810001, China
Abstract: Objective To investigate the effect and mechanism of hyperoside on the biological behavior such as cell proliferation, migration and invasion of nasopharyngeal carcinoma cells. Methods SUNE1 cells were incubated with hyperin medium of 10 mg/L, 20 mg/L and 40 mg/L, and cells were divided into the low, the medium and the high dose groups. The lncRNA PAX8-AS1 overexpression or knockdown plasmid and miR-494-3p mimic were transfected into 40 mg/L hypericin-treated SUNE1 cells respectively. The activity, clonal formation, migration and invasion of SUNE1 cells were detected by CCK-8 assays, plate cloning experiment and Transwell assays. Western blot assay was used to analyze the expression of matrix metalloproteinase (MMP) -2 and MMP-9 proteins. Real-time quantitative polymerase chain reaction (RT-qPCR) was used to detect the expression of long non-coding RNA (lncRNA) paired-box gene 8 antisense RNA 1 (PAX8-AS1) and miR-494-3p. Dual luciferase report experiment and RT-qPCR were used to determine the targeting relationship between lncRNA PAX8-AS1 and miR-494-3p. Results Low, medium and high dose-hyperoside significantly reduced the cell viability, migration number and invasion number of SUNE1 cells, and down-regulated expression levels of MMP-2 protein, MMP-9 protein and miR-494-3p, and up-regulated the expression level of lncRNA PAX8-AS1 (P<0.05). lncRNA PAX8-AS1 negatively regulated miR-494-3p expression. lncRNA PAX8-AS1 overexpression significantly enhanced inhibitory effects of 40 mg/L hyperoside on SUNE1 cell viability, migration and invasion, and MMP-2 and MMP-9 protein expression (P<0.05). Knockdown of lncRNA PAX8-AS1 and overexpression of miR-494-3p significantly reduced inhibitory effects of 40 mg/L hyperoside on SUNE1 cell viability, migration, invasion and MMP-2 and MMP-9 protein expression (P<0.05). Conclusion Hyperoside may inhibit the proliferation and migration, and invasion of nasopharyngeal carcinoma cells by up-regulating the lncRNA PAX8-AS1 /miR-494-3p axis.
Key words: nasopharyngeal neoplasms; molecular mechanisms of pharmacological action; genes, tumor suppressor; cell proliferation; neoplasm invasiveness; hyperoside; lncRNA PAX8-AS1;miR-494-3p
鼻咽癌是我国华南地区最常见的头颈部恶性肿瘤。目前,放射疗法是提高鼻咽癌局部控制率的首选方法,但由于远端转移率高,多数患者的治疗效果较差。近年来,天然产物在癌症治疗中的独特作用受到重视。金丝桃苷是一种植物源性槲皮素3d-半乳糖苷,具有抗炎、抗氧化和血管保护作用[1]。有研究证实,金丝桃苷通过调控细胞自噬、凋亡、增殖、分化,在肝癌、乳腺癌等多种肿瘤中发挥抗癌作用[2-3]。然而,金丝桃苷在鼻咽癌中的作用及分子机制尚不清楚。长链非编码RNA(lncRNA)和微小RNA(miRNA)是非编码RNA的重要組成部分,lncRNA可通过靶向miRNA参与肿瘤细胞增殖、转移等过程,这可能是肿瘤治疗的潜在靶点[4]。研究显示,槲皮素联合金丝桃苷可通过下调致癌因子miR-27a的表达水平,从而对肾癌细胞发挥抗癌活性[5]。lncRNA配对盒基因8反义RNA 1(PAX8-AS1)是一种抑癌因子,上调其表达可有效抑制鼻咽癌细胞的增殖和侵袭[6]。miR-494-3p在鼻咽癌中表达水平上调,并促进鼻咽癌进展[7]。笔者前期预实验发现,lncRNA PAX8-AS1与miR-494-3p存在结合位点,且金丝桃苷处理可改变鼻咽癌细胞中lncRNA PAX8-AS1和miR-494-3p的表达水平。本研究旨在为金丝桃苷在鼻咽癌治疗中的进一步应用提供实验依据。
1 材料与方法
1.1 材料 人鼻咽癌SUNE1细胞购自美国菌种保藏中心;空载体质粒(pcDNA)、lncRNA PAX8-AS1过表达质粒(pcDNA-lncRNA PAX8-AS1)、小干扰RNA阴性对照(si-NC)、lncRNA PAX8-AS1的小干扰RNA(si-lncRNA PAX8-AS1)、miR-494-3p模拟物(mimics)、miRNA模拟物阴性对照(miR-NC)、荧光素酶报告质粒购自上海生工生物工程有限公司;金丝桃苷(纯度94.9%)购自中国食品药品检定研究院;Lipofectamine 2000购自美国Thermo Fisher公司;细胞计数试剂盒(CCK-8)购自福州飞净生物公司;Transwell小室购自美国Corning公司;TRIzol试剂、双荧光素酶活性检测试剂盒购自北京百奥莱博生物公司;放射免疫沉淀测定(RIPA)裂解液、山羊抗兔IgG二抗、基质金属蛋白酶(MMP)-2兔源多克隆抗体、MMP-9兔源多克隆抗体、β-肌动蛋白(β-actin)兔源单克隆抗体购自上海碧云天生物公司;miRNA逆转录试剂盒、miRNA分析试剂盒购自美国GeneCopoeia公司;SYBR Premix Ex TaqTM试剂盒、PrimeScript逆转录试剂盒购自宝生物工程(大连)有限公司。
1.2 研究方法
1.2.1 细胞培养和分组 SUNE1细胞在含10%胎牛血清的DMEM培养基中,置于5% CO2的37 ℃培养箱培养,当细胞密度达到80%~90%时按照1∶3比例传代。将对数生长期的SUNE1细胞接种至6孔板(2×105个/孔),用Lipofectamine 2000将pcDNA、pcDNA-lncRNA PAX8-AS1、si-NC、si-lncRNA PAX8-AS1、miR-NC、miR-494-3p mimics分别转染SUNE1细胞,收集转染48 h细胞。实时荧光定量聚合酶链反应(RT-qPCR)检测lncRNA PAX8-AS1或miR-494-3p表达,验证转染效果合格后再进行后续实验。依据参考文献[8]和前期预实验结果,分别用10 mg/L(低剂量组)、20 mg/L(中剂量组)、40 mg/L(高剂量组)金丝桃苷的培养液孵育SUNE1细胞48 h;正常培养的SUNE1细胞记为正常对照(NC)组;转染pcDNA、pcDNA-lncRNA PAX8-AS1、si-NC、si-lncRNA PAX8-AS1的SUNE1细胞依次记为pcDNA组、pcDNA-lncRNA PAX8-AS1组、si-NC组、si-lncRNA PAX8-AS1组;SUNE1细胞用含40 mg/L金丝桃苷的培养液干预后分别转染pcDNA(pcDNA+高剂量组)、pcDNA-lncRNA PAX8-AS1(pcDNA-lncRNA PAX8-AS1+高剂量组)、si-NC(si-NC+高剂量组)、si-lncRNA PAX8-AS1(si-lncRNA PAX8-AS1+高剂量组)、miR-NC(miR-NC+高剂量组)、miR-494-3p mimics(miR-494-3p+高剂量组)。
1.2.2 CCK-8法检测各组SUNE1细胞活力 细胞按照3×103个/孔的密度接种于96孔板,待SUNE1细胞贴壁生长后,按照实验分组进行处理,将96孔板置于37 ℃、5% CO2中培养48 h,更换为正常培养液,每孔加入10 ?L CCK-8试剂,再孵育2 h,酶标仪检测450 nm波长处光密度(OD)值。每组设置3个平行孔,实验独立重复3次。
1.2.3 平板克隆实验检测SUNE1细胞克隆能力 胰酶消化各组SUNE1细胞,制成单细胞悬液。细胞计数后将200个细胞接种于直径为60 mm培养皿中,使细胞分散均匀,培养2~3周,出现肉眼可见克隆时,弃去培养液,磷酸盐缓冲液(PBS)浸洗2次。甲醇固定15 min,弃甲醇后空气干燥5 min。用0.1%结晶紫染液染色20 min,流水缓慢洗去染液,空气干燥10 min。显微镜下记录细胞克隆数(>50个细胞为1个克隆)。每组设置3个平行孔,实验独立重复3次。
1.2.4 Transwell实验检测各组细胞迁移和侵袭 迁移实验用未包被基质胶的Transwell小室,侵袭实验用包被基质胶涂层的Transwell小室。收集各组SUNE1细胞,用无血清培养基制备单细胞悬液。上室加200 μL细胞悬液,下室加500 μL含10%胎牛血清的培养液,培养24 h,去除Transwell小室膜表面的未穿膜细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色20 min。倒置显微镜下观察各组细胞穿膜情况,以随机读取的5个视野细胞数的平均值表示SUNE1细胞迁移或侵袭数量。每组设置3个平行,实验独立重复3次。
1.2.5 Western blot法检测各组SUNE1细胞中MMP-2和MMP-9蛋白表达 用RIPA缓冲液裂解各组SUNE1细胞,4 ℃、12 000 r/min离心5 min收集上清液。蛋白定量后,每组取等量(40 ?g)蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,参数设定为电压100 V、时间90 min;湿法转移蛋白到硝酸纤维素(NC)膜上,参数设定为电流300 mA、时间20 min。室温下用5%脱脂奶粉封闭NC膜2 h,4 ℃下用MMP-2(1∶1 000)、MMP-9(1∶1 000)、β-actin(1∶2 000)一抗孵育NC膜过夜;室温加IgG二抗(1∶1 000)孵育NC膜1 h。加入化学发光试剂显影。以Quantity One v4.6.6软件测定目的蛋白条带和内参β-actin条带的灰度值表示其相对表达量。每组设置3个平行,实验独立重复3次。
1.2.6 RT-qPCR检测lncRNA PAX8-AS1和miR-494-3p表达 TRIzol试剂抽提上述各组SUNE1细胞的总RNA。按照miRNA逆转录试剂盒、miRNA分析试剂盒说明书检测miR-494-3p表达。反应体系(20 ?L):cDNA 5 ?L,上下游引物各0.1 ?L,SYBR GREEN 10 ?L,ddH2O 4.8 ?L。反应条件:95 ℃ 30 s(预变性);95 ℃ 5 s(变性),60 ℃ 34 s(退火),40个循环。β-actin为lncRNA PAX8-AS1的内参,U6为miR-494-3p的内参。miR-494-3p:上游5'-GGGTGAAACACACACGGGAA-3',下游5'-GGCAGGTCCGAGGT-3';PAX8-AS1:上游5'-CTTCTGATTGCCCAAGCCCT-3',下游5'-TGCTTGACTACAGAGCACCC-3'。按照PrimeScript逆转录试剂盒、SYBR Premix Ex TaqTM试剂盒说明书检测lncRNA PAX8-AS1表达。2-ΔΔCt法分析lncRNA PAX8-AS1和miR-494-3p相对表达量。每组设置3个平行,实验独立重复3次。
1.2.7 双荧光素酶报告实验 采用starbase网站(http://starbase.sysu.edu.cn/index.php)在线数据库预测lncRNA PAX8-AS1与miR-494-3p的结合位点。将SUNE1细胞接种于24孔板,用Lipofectamine 2000将miR-494-3p mimics、miR-NC分别与含有lncRNA PAX8-AS1野生序列(结合位点:AUGUUUC)或突变序列(结合位点:CCAGGAA)的pRL-TK荧光素酶报告质粒共转染50%融合SUNE1细胞。孵育48 h后,用双荧光素酶活性检测试剂盒测定SUNE1细胞的萤火虫和海肾荧光素酶活性,以两者的比值表示相对荧光素酶活性。每组设置3个平行,实验独立重复3次。
1.3 统计学方法 采用GraphPad Prism 8进行统计分析。符合正态分布的计量数据以x±s表示。2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 低、中、高剂量金丝桃苷对SUNE1细胞的影响
2.1.1 SUNE1细胞增殖能力 与NC组比较,金丝桃苷低、中、高剂量组SUNE1细胞OD450、细胞克隆数依次降低(P<0.05),见表1、图1。
2.1.2 SUNE1细胞迁移和侵袭能力及MMP-2和MMP-9表达水平比较 与NC组比较,金丝桃苷低、中、高剂量组SUNE1细胞迁移、侵袭数量,MMP-2和MMP-9蛋白表达依次降低(P<0.05),见图2、3,表2。
2.1.3 SUNE1细胞中lncRNA PAX8-AS1和miR-494-3p表达 与NC组比较,金丝桃苷低、中、高剂量组SUNE1细胞中lncRNA PAX8-AS1表达水平依次升高,miR-494-3p表达水平依次降低(P<0.05),见表3。
2.2 lncRNA PAX8-AS1可调控miR-494-3p的表达 starbase在线数据库预测显示,miR-494-3p与lncRNA PAX8-AS1序列间存在特异性结合位点,见图4。与miR-NC组比较,miR-494-3p mimics组WT-lncRNA PAX8-AS1相对荧光素酶活性降低(P<0.05),而MUT-lncRNA PAX8-AS1相对荧光素酶活性差异无统计学意义,见表4。与pcDNA组比较,pcDNA-lncRNA PAX8-AS1组SUNE1细胞中lncRNA PAX8-AS1表达水平升高,miR-494-3p表达水平降低(P<0.05);與si-NC组比较,si-lncRNA PAX8-AS1组SUNE1细胞中lncRNA PAX8-AS1表达水平降低,miR-494-3p表达水平升高(P<0.05),见表5。
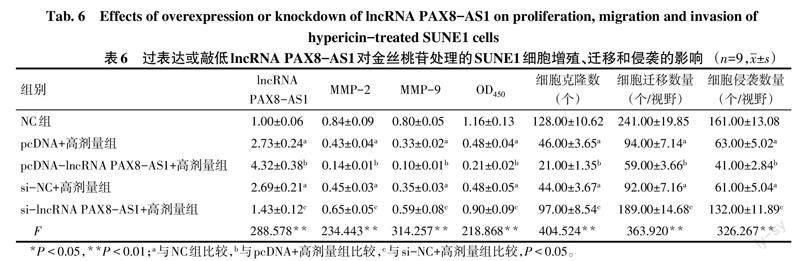
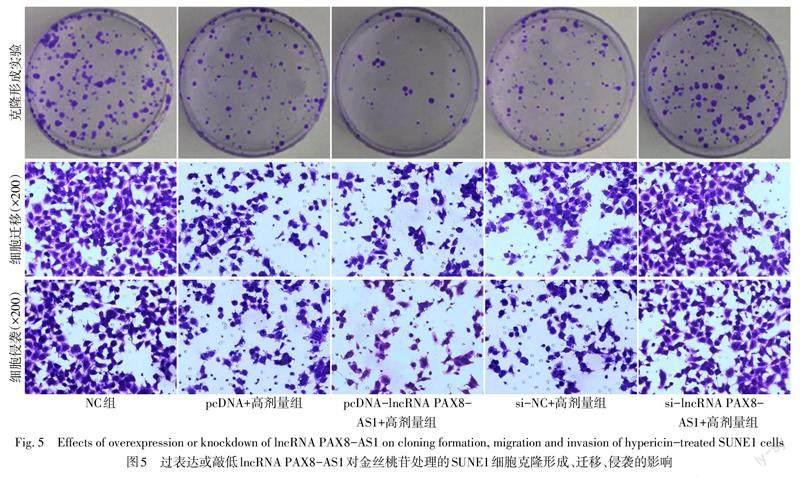
2.3 lncRNA PAX8-AS1表达水平对金丝桃苷处理的SUNE1细胞的影响 与NC组比较,pcDNA+高剂量组、si-NC+高剂量组lncRNA PAX8-AS1表达水平升高,MMP-2、MMP-9蛋白表达水平降低,OD450、细胞克隆数、细胞迁移数量、细胞侵袭数量下降(P<0.05);与pcDNA+高剂量组比较,pcDNA-lncRNA PAX8-AS1+高剂量组lncRNA PAX8-AS1表达水平升高,MMP-2、MMP-9蛋白表达水平降低,细胞克隆数、OD450、细胞迁移数量、细胞侵袭数量下降(P<0.05);与si-NC+高剂量组比较,si-lncRNA PAX8-AS1+高剂量组lncRNA PAX8-AS1表达水平降低,MMP-2、MMP-9蛋白表达水平升高,细胞克隆数、OD450、细胞迁移数量、细胞侵袭数量升高(P<0.05)。见表6,图5、6。
2.4 上調miR-494-3p对金丝桃苷处理的SUNE1细胞增殖、迁移和侵袭能力的影响 与miR-NC+高剂量组比较,miR-494-3p+高剂量组SUNE1细胞miR-494-3p、MMP-2、MMP-9表达水平以及细胞克隆数、OD450、细胞迁移数量、细胞侵袭数量升高(P<0.05)。见表7,图7、8。
3 讨论
随着放疗技术的进步,鼻咽癌局部复发率明显降低,但其高度侵袭性和转移性仍是其治疗失败的主要原因。因此,寻找有效抑制鼻咽癌细胞转移的药物有助于提高鼻咽癌患者生存率。金丝桃苷已被证实在多种人类肿瘤或异种移植模型中具有抗癌活性,是潜在抗肿瘤候选药物。研究发现,金丝桃苷可明显抑制皮肤癌细胞的增殖[9]。金丝桃苷通过激活Bax/caspase-3轴和抑制核因子κB(NF-κB)信号通路诱导乳腺癌细胞凋亡[10]。金丝桃苷还可通过抑制Wnt/β-catenin信号通路,从而抑制胃癌肿瘤生长[11]。本研究结果显示,不同剂量金丝桃苷处理后SUNE1细胞活力、克隆形成数、迁移数量、侵袭数量均降低,高剂量组效果更明显。MMP-2和MMP-9是降解基底膜和细胞外基质的关键酶,可降解或破坏肿瘤细胞表面细胞外基质中的Ⅳ、Ⅴ型胶原或明胶,从而使肿瘤细胞沿着受损的基膜向周围组织浸润,引起肿瘤的侵袭和转移[12]。本研究结果显示,不同剂量金丝桃苷处理后SUNE1细胞中MMP-2和MMP-9蛋白表达水平依次下降,这与金丝桃苷的抗迁移和抗侵袭作用一致,表明金丝桃苷可通过降低相关蛋白表达来抑制SUNE1细胞的迁移和侵袭作用。以上研究提示,金丝桃苷可能通过抑制SUNE1细胞增殖、迁移和侵袭,从而抑制鼻咽癌进展。
近年来,多项研究证实,非编码RNA可作为金丝桃苷的下游因子介导癌细胞的生物学功能[13-14]。研究显示,金丝桃苷可下调lncRNA结肠癌相关转录本1表达,从而抑制表皮生长因子受体(EGFR)T790M突变的非小细胞肺癌细胞增殖并诱导其凋亡,抑制体内移植瘤的生长[15]。金丝桃苷和槲皮素通过下调miR-21表达,抑制前列腺癌细胞的生长和转移[16]。黄芩素可通过激活lncRNA PAX8-AS1亚型(PAX8-AS1-N),抑制乳腺癌细胞活力和周期进程[17]。miR-494-3p是鼻咽癌、子宫内膜癌、肺癌进展的促进因子,下调miR-494-3p表达可抑制肿瘤细胞的恶性增殖和转移能力,减缓肿瘤进展[18-19]。本研究结果显示,不同剂量金丝桃苷均可明显上调SUNE1细胞中lncRNA PAX8-AS1表达水平,下调miR-494-3p表达水平,表明金丝桃苷在SUNE1细胞中可促进lncRNA PAX8-AS1表达并抑制miR-494-3p表达,提示lncRNA PAX8-AS1、miR-494-3p可能在SUNE1细胞中分别起抑癌和促癌作用;另外miR-494-3p的表达受到lncRNA PAX8-AS1负调控,证实了两者的靶向调控作用,提示lncRNA PAX8-AS1/miR-494-3p轴可能介导金丝桃苷在鼻咽癌中的抗癌作用。深入研究表明,过表达lncRNA PAX8-AS1可提高金丝桃苷对鼻咽癌细胞增殖、迁移、侵袭,抑制MMP-2、MMP-9蛋白表达;而敲低lncRNA PAX8-AS1和过表达miR-494-3p则逆转金丝桃苷对鼻咽癌细胞增殖、迁移、侵袭以及MMP-2、MMP-9蛋白表达的影响,进一步证实金丝桃苷至少部分通过激活lncRNA PAX8-AS1/miR-494-3p轴,从而在鼻咽癌进展中发挥了抗癌活性。由于敲低lncRNA PAX8-AS1和过表达miR-494-3p并未完全逆转金丝桃苷的抗鼻咽癌作用,故笔者推测可能有其他lncRNA或miRNA参与金丝桃苷的抗鼻咽癌过程。
综上所述,金丝桃苷可能通过上调lncRNA PAX8-AS1/ miR-494-3p轴活性,从而抑制鼻咽癌细胞增殖、迁移和侵袭,其有望成为一种潜在预防和抑制鼻咽癌转移的药物。
参考文献
[1] 杨诗婷,王晓倩,廖广辉. 金丝桃苷的药理作用机制研究进展[J]. 中国现代应用药学,2018,35(6):947-951. YANG S T,WANG X Q,LIAO G H. Advances in pharmacological effects of hyperoside[J]. Chin J Mod Appl Pharm,2018,35(6):947-951. doi:10.13748/j.cnki.issn1007-7693.2018.06.036.
[2] WEI S,SUN Y,WANG L,et al. Hyperoside suppresses BMP-7-dependent PI3K/AKT pathway in human hepatocellular carcinoma cells[J]. Ann Transl Med,2021,9(15):1233-1244. doi:10.21037/atm-21-2980.
[3] QIU J,ZHANG T,ZHU X,et al. Hyperoside induces breast cancer cells apoptosis via ROS-mediated NF-κB signaling pathway[J]. Int J Mol Sci,2019,21(1):131-145. doi:10.3390/ijms21010131.
[4] XUE F,CHENG Y,XU L,et al. LncRNA NEAT1/miR-129/Bcl-2 signaling axis contributes to HDAC inhibitor tolerance in nasopharyngeal cancer[J]. Aging (Albany NY),2020,12(14):14174-14188. doi:10.18632/aging.103427.
[5] LI W,LIU M,XU Y F,et al. Combination of quercetin and hyperoside has anticancer effects on renal cancer cells through inhibition of oncogenic microRNA-27a[J]. Oncol Rep,2014,31(1):117-124. doi:10.3892/or.2013.2811.
[6] 侯彬,黄维平,尹中普,等. lncRNA PAX8-AS1对鼻咽癌细胞的增殖和侵袭的影响及作用机制[J]. 广东医学,2020,41(15):1533-1537. HOU B,HUANG W P,YIN Z P,et al. Effects of lncRNA PAX8-AS1 on proliferation and invasion of nasopharyngeal carcinoma cells and its mechanism of action[J]. Guangdong Med J,2020,41(15):1533-1537. doi:10.13820/j.cnki.gdyx.20200375.
[7] HE H,LIAO X,YANG Q,et al. MicroRNA-494-3p promotes cell growth, migration, and invasion of nasopharyngeal carcinoma by targeting Sox7[J]. Technol Cancer Res Treat,2018,17(1):1533-1543. doi:10.1177/1533033818809993.
[8] 徐里,赵川,张延武. 金丝桃苷对卵巢癌细胞增殖、凋亡、迁移以及侵袭的影响[J]. 中成药,2018,40(3):702-706. XU L,ZHAO C,ZHANG Y W. Effect of hyperoside on proliferation, apoptosis, migration and invasion of ovarian cancer cells[J]. Chin Trad Pat Med,2018,40(3):702-706. doi:10.3969/j.issn.1001-1528.2018.03.040.
[9] KONG Y,SUN W,WU P. Hyperoside exerts potent anticancer activity in skin cancer[J]. Front Biosci(Landmark Ed),2020,25(3):463-479. doi:10.2741/4814.
[10] QIU J,ZHANG T,ZHU X,et al. Hyperoside induces breast cancer cells apoptosis via ROS-Mediated NF-κB signaling pathway[J]. Int J Mol Sci,2019,21(1):131-141. doi:10.3390/ijms21010131.
[11] PING M H. Hyperin controls the development and therapy of gastric cancer via regulating Wnt/β-Catenin signaling[J]. Cancer Manag Res,2020,12(1):11773-11782. doi:10.2147/CMAR.S270544.
[12] LU W X,GAN G S,YANG B. Knockdown of USP9X reverses cisplatin resistance by decreasing β-catenin expression in nasopharyngeal carcinoma cells[J]. Neoplasma,2021,68(4):810-822. doi:10.4149/neo_2021_201227N1410.
[13] ZHOU J,ZHANG S,SUN X,et al. Hyperoside ameliorates diabetic nephropathy induced by STZ via targeting the miR-499-5p/APC axis[J]. J Pharmacol Sci,2021,146(1):10-20. doi:10.1016/j.jphs.2021.02.005.
[14] LI J P,LIAO X H,XIANG Y,et al. Hyperoside and let-7a-5p synergistically inhibits lung cancer cell proliferation via inducing G1/S phase arrest[J]. Gene,2018,679(1):232-240. doi:10.1016/j.gene.2018.09.011.
[15] HU Z,ZHAO P,XU H. Hyperoside exhibits anticancer activity in non?small cell lung cancer cells with T790M mutations by upregulating FoxO1 via CCAT1[J]. Oncol Rep,2020,43(2):617-624. doi:10.3892/or.2019.7440.
[16] YANG F Q,LIU M,LI W,et al. Combination of quercetin and hyperoside inhibits prostate cancer cell growth and metastasis via regulation of microRNA-21[J]. Mol Med Rep,2015,11(2):1085-1092. doi:10.3892/mmr.2014.2813.
[17] YU X,CAO Y,TANG L,et al. Baicalein inhibits breast cancer growth via activating a novel isoform of the long noncoding RNA PAX8-AS1-N[J]. J Cell Biochem,2018,119(8):6842-6856. doi:10.1002/jcb.26881.
[18] ZHU L,WANG X,WANG T,et al. miR-494-3p promotes the progression of endometrial cancer by regulating the PTEN/PI3K/AKT pathway[J]. Mol Med Rep,2019,19(1):581-588. doi:10.3892/mmr.2018.9649.
[19] WU C,YANG J,LI R,et al. LncRNA WT1-AS/miR-494-3p regulates cell proliferation, apoptosis, migration and invasion via PTEN/PI3K/AKT signaling pathway in non-small cell lung cancer[J]. Onco Targets Ther,2021,14(1):891-904. doi:10.2147/OTT.S278233.
(2022-05-23收稿 2022-08-26修回)
(本文編辑 陆荣展)

