二甲双胍对弥漫大B细胞淋巴瘤细胞的抑制作用及机制探讨
谭春莲 李晓红 夏国栋 张志红 李晓明
摘要:目的 探討二甲双胍对人弥漫大B细胞淋巴瘤(DLBCL)U2932细胞的抑制作用及其相关机制。方法 采用不同浓度二甲双胍作用于体外培养的U2932细胞,分为对照组(0 mmol/L)和二甲双胍实验组(分别为5、10、20、40 mmol/L),分别培养24、48、72 h。通过CCK-8法检测细胞增殖活性改变;流式细胞术检测细胞周期分布及凋亡情况;Western blot检测AMP活化蛋白激酶(AMPK)、细胞周期蛋白D1(CyclinD1)、自噬及凋亡等通路相关蛋白的表达水平。结果 经二甲双胍处理后的U2932细胞存活率较对照组明显下降(P<0.05)。5、10和20 mmol/L二甲双胍组G0/G1期细胞比例均较对照组增加(P<0.05)。20 mmol/L二甲双胍组24 h、48 h、72 h的细胞凋亡比例较对照组增加(P<0.05)。与对照组相比,5、10和20 mmol/L二甲双胍组磷酸化AMP活化蛋白激酶α亚基(p-AMPKα)、P53、B淋巴细胞瘤-2基因(Bcl-2)关联X蛋白(Bax)、活化的胱天蛋白酶3(Cleaved Caspase-3)、微管相关蛋白l轻链3B亚基(LC3B)蛋白表达水平增加,细胞自噬蛋白Beclin1表达水平仅部分增加,Bcl-2、磷酸化蛋白激酶B(p-AKT)、CyclinD1蛋白表达水平降低(P<0.05)。结论 二甲双胍能够激活AMPK、凋亡及自噬通路,抑制U2932细胞增殖,促进其凋亡。
关键词:二甲双胍;淋巴瘤,大B细胞,弥漫性;AMP活化蛋白激酶类;细胞凋亡;细胞增殖;自噬;信号通路
中图分类号:R733.41文献标志码:ADOI:10.11958/20220684
Inhibitory effect and mechanism of metformin on diffuse large B-cell lymphoma cells
TAN ChunlianLI Xiaohong XIA Guodong ZHANG Zhihong LI Xiaoming
1 Health Management Center, 2 Department of General Medicine, 3 Department of Hematology, the Affiliated Hospital of Southwest Medical University, Luzhou 646000, China
Corresponding Author E-mail: zhihonglily@126.com
Abstract: Objective To investigate the inhibitory effect and related mechanism of metformin on human diffuse large B-cell lymphoma (DLBCL) U2932 cells. Methods U2932 cells cultured in vitro were treated with different concentrations of metformin, and cells were divided into the control group (0 mmol/L) and the metformin experimental groups (5, 10, 20 and 40 mmol/L). Cells were cultured for 24 h, 48 h and 72 h, respectively. Changes of cell proliferation activity were detected by CCK-8 assay. Cell cycle distribution and apoptosis were detected by flow cytometry. Expression levels of AMPK, CyclinD1, autophagy and apoptosis pathway-related proteins were detected by Western blot assay. Results The proliferation activity of U2932 cells treated with metformin was significantly lower than that of the control group (P<0.05). Compared with the control group, the percentage of cells in G0/G1 phase treated with 5, 10, 20 mmol/L metformin and the apoptosis rate of U2932 cells treated with 20 mmol/L metformin for 24 h, 48 h and 72 h were significantly increased (P<0.05). Western blot assay showed that 5, 10, 20 mmol/L metformin could up-regulate the expression of p-AMPKα, P53, Bax, Cleaved Caspase-3, LC3B proteins, but Beclin1 only partially increased, and down-regulate the expression levels of Bcl-2, p-AKT, CyclinD1 proteins in U2932 cells (P<0.05). Conclusion Metformin can activate AMPK, apoptosis and autophagy pathways, inhibit the proliferation of U2932 cells, and promote their apoptosis.
Key words: metformin; lymphoma, large B-cell, diffuse; AMP-activated protein kinases; apoptosis; cell proliferation; autophagy; signaling pathway
淋巴瘤起源于淋巴结和淋巴组织。其发生大多与免疫应答过程中淋巴细胞增殖分化产生的某种免疫细胞恶变有关,是免疫系统的恶性肿瘤。按组织病理学分类可分为霍奇金淋巴瘤(Hodgkin lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)。NHL易早期发生远处转移,患者预后明显差于HL。弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是一种遗传复杂且异质性很强的侵袭性NHL,也是我国人群最常见的淋巴瘤类型,约占所有淋巴瘤的33.27%,其发病率呈逐年上升趋势[1]。DLBCL具有多种临床和病理特征,容易出现预后不良和频繁复发,治疗极具挑战性[2]。AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)及磷脂酰肌醇-3-激酶/蛋白激酶B/雷帕霉素靶蛋白(phosphatidylinositol-3-kinase/protein kinase B/the mammalian target of rapamycin,PI3K/AKT/mTOR)信号通路在细胞自噬与凋亡过程中起着关键作用。有研究认为,二甲双胍可通过激活AMPK及抑制PI3K/AKT/mTOR信号通路发挥抗肿瘤效应 [3]。但关于二甲双胍对DLBCL的作用机制却鲜有报道。本研究以人DLBCL细胞系U2932为实验对象,初步探究二甲双胍对DLBCL细胞生物学特性的影响,以期揭示二甲双胍对DLBCL是否具有潜在治疗作用。
1 材料与方法
1.1 实验细胞 人弥漫大B细胞淋巴瘤细胞系U2932细胞株购自南京科佰生物科技有限公司。
1.2 主要试剂与仪器 盐酸二甲双胍标准品(北京索莱宝科技有限公司);胎牛血清、RPMI1640无血清培养基(美国Gibco公司);CCK-8试剂盒(日本同仁化学研究所);青霉素-链霉素溶液、细胞周期检测试剂盒、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);Annexin V-FITC/PI细胞凋亡检测试剂盒、流式细胞仪(美国Becton Dickinson公司);兔抗人β-肌动蛋白(β-actin)抗体、兔抗人磷酸化AMPKα亚基(p-AMPKα)抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自美国Cell Signaling Technology公司;兔抗人细胞自噬蛋白Beclin1、微管相关蛋白l轻链3B亚基(LC3B)抗体购自英国Abcam公司;兔抗人磷酸化蛋白激酶B(p-AKT)、细胞周期蛋白D1(CyclinD1)、P53、活化的胱天蛋白酶3(Cleaved Caspase-3)、B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2关联X蛋白(Bax)抗体均购自杭州华安生物技术有限公司;酶标测定仪(美国Thermo公司);蛋白凝胶电泳仪、垂直电泳槽、小型Trans-Blot转印槽、凝胶成像分析系统(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 细胞培养 U2932为悬浮细胞,采用含100 U/mL青霉素、100 mg/L链霉素和10%胎牛血清的RPMI-1640培养基,放至37 ℃、5%CO2孵化箱内恒温培养。
1.3.2 CCK-8法检测细胞增殖活性 取生长状态良好的U2932细胞,按(3~5)×105/mL的细胞密度接种至96孔板中培养,分别使用5、10、20、40 mmol/L二甲双胍处理细胞,分别为5、10、20、40 mmol/L组,另设置对照组(二甲双胍0 mmol/L)和空白组(不含二甲双胍及细胞),每组5个复孔。分别培养24、48、72 h后添加10 μL CCK-8试剂,避光孵育3.5 h后检测450 nm波长处光密度(OD),并计算半数抑制浓度(IC50)和细胞存活率,细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%,实验重复3次。
1.3.3 流式细胞术检测细胞周期 在6孔板中接种对照组、5 mmol/L组、10 mmol/L组和20 mmol/L组细胞(1×106个/孔),培养48 h后转至离心管,PBS洗涤后乙醇固定过夜,750 r/min离心5 min,PBS洗涤,加入PI染色30 min后,流式细胞仪检测细胞周期,实验重复3次。
1.3.4 流式细胞术检测细胞凋亡 将对照组及IC50组(本实验选用20 mmol/L)细胞接种至6孔板(1×106个/孔),培养24、48、72 h后,750 r/min离心5 min,PBS洗涤2次,加入Binding Buffer(200 μL)重悬,添加5 μL被FITC荧光素标记的Annexin V及5 μL的碘化丙啶(PI)混匀,避光孵育15 min,流式细胞仪检测细胞凋亡情况,实验重复3次。
1.3.5 Western blot检测细胞蛋白表达水平 将已培养至对数生长期的U2932细胞接种至对照组、5 mmol/L组、10 mmol/L组和20 mmol/L组培养瓶(2×106個/瓶),经培养48 h后提取各组细胞总蛋白,12 000 r/min离心10 min,弃细胞碎片,BCA法测定蛋白质浓度。各组取约15 μg蛋白,通过SDS-PAGE分离,转至PVDF膜,常温封闭1 h,加入兔抗p-AMPKα、p-AKT、CyclinD1、P53、Cleaved Caspase-3、Bcl-2、Bax、LC3B、Beclin1抗体(1︰1 000),置于4 ℃摇床过夜。次日漂洗3次后加入HRP标记的山羊抗兔二抗IgG(1︰1 000)室温孵育1 h,洗膜后加ECL试剂显色,置于凝胶成像仪中观察并拍照,以β-actin作为内参,使用Image J软件对条带进行定量分析。蛋白相对表达量=目标蛋白灰度值/内参蛋白灰度值,实验重复3次。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析,Graphpad Prism 8.0软件作图。符合正态分布的计量资料以均数±标准差(x ±s)表示,两组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
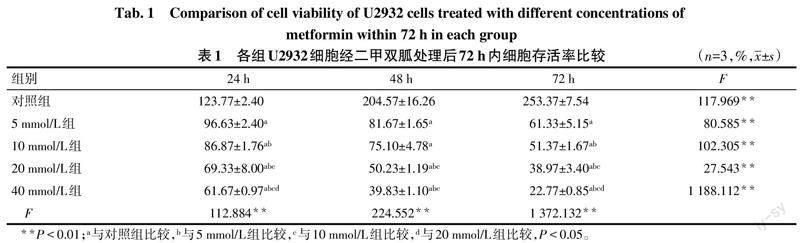
2.1 二甲双胍对U2932细胞增殖活性的影响 与对照组相比,经二甲双胍处理后的U2932细胞存活率在72 h内明显下降(P<0.05),见表1。24 h、48 h 和72 h的IC50分别为48.514、19.423、12.715 mmol/L。
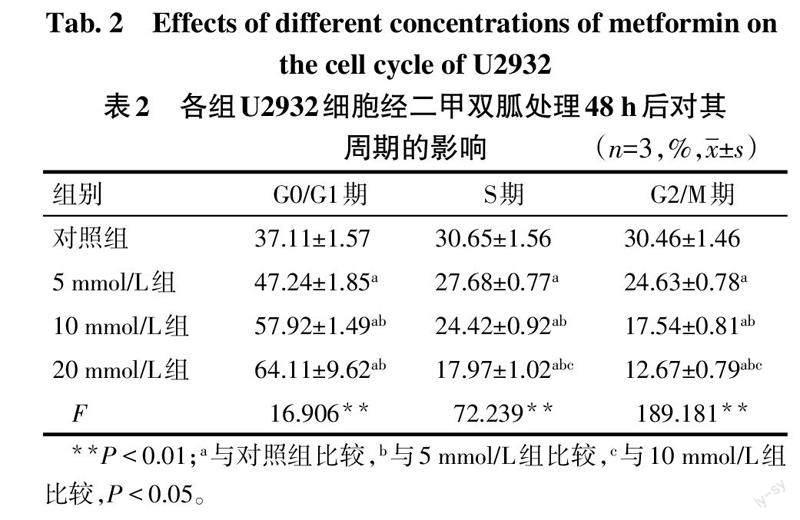
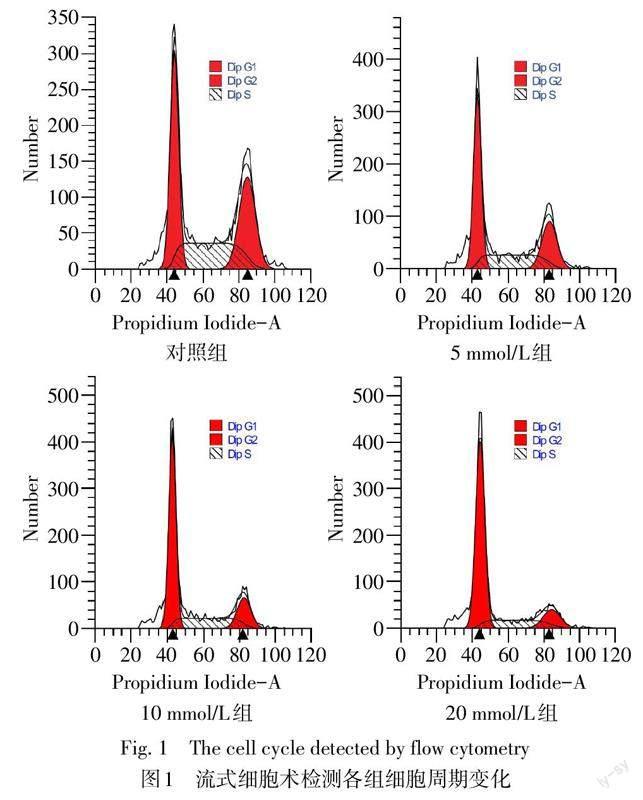
2.2 二甲双胍对U2932细胞周期的影响 与对照组相比,5 mmol/L、10 mmol/L和20 mmol/L二甲双胍处理U2932细胞48 h后,G0/G1期细胞百分比增加,S期、G2/M期细胞百分比降低(P<0.05),10 mmol/L组和20 mmol/L组G0/G1期细胞百分比差异无统计学意义(P>0.05),见表2、图1。
2.3 二甲双胍对U2932细胞凋亡的影响 与对照组相比,20 mmol/L二甲双胍处理后的U2932细胞凋亡比例在24 h(28.06%±4.85% vs. 8.95%±1.54%,t=4.251)、48 h(37.16%±1.79% vs. 11.73%±2.08%,t=5.404)及72 h(57.07%±0.91% vs. 16.44%±2.27%,t=3.299)升高(n=3,均P<0.01),见图2。
2.4 二甲双胍对U2932细胞AMPK、AKT、CyclinD1以及P53通路蛋白表达的影响 与对照组相比,5 mmol/L、10 mmol/L和20 mmol/L二甲双胍组p-AMPKα、P53蛋白表达水平增加,p-AKT、CyclinD1蛋白表达水平降低(P<0.05);10 mmol/L组和20 mmol/L组P53蛋白表达差异无统计学意义(P>0.05),见图3、表3。
2.5 二甲双胍对U2932细胞凋亡、自噬相关蛋白表达的影响 与对照组相比,5 mmol/L、10 mmol/L和20 mmol/L二甲双胍组Cleaved Caspase-3、Bax及LC3B蛋白表达水平增加,Bcl-2蛋白表达水平降低(P<0.05);10 mmol/L组和20 mmol/L组Beclin1蛋白表达水平较对照组增加(P<0.05),5 mmol/L组未见显著变化(P>0.05),见图4、表4。
3 讨论
DLBCL是临床中十分常见的淋巴瘤类型,其分子生物学特征及个体预后差异很大,约有1/3的患者无法治愈,存在复发、难治的普遍现象[2]。二甲双胍是临床广泛使用的口服降糖药物,近年来在抗肿瘤领域报道颇多,其机制较为复杂,包括调控多级代谢通路、抑制肿瘤细胞增殖、诱导细胞发生自噬与凋亡等[4]。而目前其对DLBCL的作用机制尚未阐明,因此拟通過必要的研究探讨,以寻求新的治疗方式及干预药物。
3.1 二甲双胍在肿瘤防治中的研究 近年来研究表明,二甲双胍不仅作为降糖药物来使用,其在肿瘤防治方面的作用已逐渐被流行病学研究和荟萃分析证实,包括乳腺癌[5]、前列腺癌[6]及胰腺癌[7]等。在血液系统肿瘤中也有类似的结论,二甲双胍可降低2型糖尿病患者罹患NHL的风险[8],还可改善新诊断的DLBCL和滤泡性淋巴瘤患者的临床预后[9]。陈惠丽等[10]的体外研究也证实二甲双胍可抑制白血病细胞增殖,诱导自噬与凋亡。而AMPK、AKT/mTOR等信号通路可能是其作用机制之一[11]。本研究结果显示二甲双胍能抑制U2932细胞的生长和增殖,阻滞细胞周期,与Xiong等[12]得出的二甲双胍抑制肿瘤细胞增殖结果相似。
3.2 二甲双胍对DLBCL的作用机制探讨 目前多数研究领域认为AMPK作为一种肿瘤抑制激酶,同时也是二甲双胍发挥抗肿瘤作用的关键靶分子。而PI3K/AKT/mTOR是AMPK重要的下游信号通路,在人类肿瘤细胞中往往是失控的,导致肿瘤细胞的快速增殖。二甲双胍可通过抑制PI3K/AKT/mTOR信号通路降低人子宫内膜癌细胞增殖[13],在甲状腺癌细胞株中也发现类似的作用[14]。此外,Zhang等[15]研究认为AKT的过度磷酸化可诱导肝癌的发生,而二甲双胍可下调p-AKT的表达,降低AKT转染细胞Cyclin D1的表达,从而减轻脂质沉积,缓解动物肝脏的脂肪变性,对AKT诱导的肝细胞肿瘤有治疗作用。而p53是一种抑癌基因,与肿瘤的发生发展密切相关。最新研究证实APR-246(恢复突变型p53活性的化合物)可诱导DLBCL细胞发生自噬,抑制其增长[16]。还有研究表明,二甲双胍能增强Bcl-2抑制剂的促凋亡作用,并发挥协同抗淋巴瘤效应[17]。本研究发现,不同浓度二甲双胍干预U2932细胞48 h后p-AMPK蛋白表达逐渐增强,同时p-AKT表达逐渐减弱,表明二甲双胍发挥抗肿瘤效应可能与激活AMPK及抑制AKT信号通路有关。其次,二甲双胍可下调Cyclin D1、上调P53蛋白的表达,参与细胞增殖与细胞周期的调控。此外,与对照组相比,5、10和20 mmol/L二甲双胍组的Bax、Cleaved Caspase-3及LC3B蛋白表达水平逐渐增加、Bcl-2蛋白表达水平逐渐降低,推测可能与细胞发生凋亡和自噬有关。但5 mmol/L二甲双胍组与对照组的Beclin1蛋白表达水平无显著差异,可能与高浓度二甲双胍更容易诱导肿瘤细胞发生自噬或其他机制有关。
综上所述,二甲双胍在体外有显著抑制U2932细胞增殖的作用,其抗肿瘤效应可能与激活AMPK信号通路,诱导细胞发生自噬与凋亡有关。本研究为了解二甲双胍对DLBCL的作用机制提供了参考,有助于寻找治疗DLBCL的潜在有效药物,但仍需体内实验进一步验证。
参考文献
[1] COCCARO N,ANELLI L,ZAGARIA A,et al. Molecular complexity of diffuse large B-cell lymphoma:Can it be a roadmap for precision medicine?[J]. Cancers,2020,12(1):185. doi:10.3390/cancers12010185.
[2] LIU M K,SUN X J,GAO X D,et al. Methylation alterations and advance of treatment in lymphoma[J]. Front Biosci(Landmark Ed),2021,26(9):602-613. doi:10.52586/4970.
[3] MA T,TIAN X,ZHANG B,et al. Low-dose metformin targets the lysosomal AMPK pathway through PEN2[J]. Nature,2022,603(7899):159-165. doi:10.1038/s41586-022-04431-8.
[4] SAENGBOONMEE C,SANLUNG T,WONGKHAM S. Repurposing metformin for cancer treatment:A great challenge of a promising drug[J]. Anticancer Res,2021,41(12):5913-5918. doi:10.21873/anticanres.15410.
[5] YANG J,ZHOU Y,XIE S,et al. Metformin induces ferroptosis by inhibiting UFMylation of SLC7A11 in breast cancer[J]. J Exp Clin Cancer Res,2021,40(1):206. doi:10.1186/s13046-021-02012-7.
[6] CADEDDU G,HERV?S-MOR?N A,MART?N-MART?N M,et al. Metformin and statins:A possible role in high-risk prostate cancer[J]. Rep Pract Oncol Radiother,2020,25(2):163-167. doi:10.1016/j.rpor.2019.12.027.
[7] EIBL G,ROZENGURT E. Metformin:Review of epidemiology and mechanisms of action in pancreatic cancer[J]. Cancer Metastasis Rev,2021,40(3):865-878. doi:10.1007/s10555-021-09977-z.
[8] TSENG C H. Metformin is associated with a lower risk of non-Hodgkin lymphoma in patients with type 2 diabetes[J]. Diabetes Metab,2019,45(5):458-464. doi:10.1016/j.diabet.2019.05.002.
[9] WANG Y,MAURER M J,LARSON M C,et al. Impact of metformin use on the outcomes of newly diagnosed diffuse large B-cell lymphoma and follicular lymphoma[J]. Br J Haematol,2019,186(6):820-828. doi:10.1111/bjh.15997.
[10] 陳惠丽,马平,陈艳丽,等. 二甲双胍对K562细胞增殖、凋亡及糖酵解的影响[J]. 中国实验血液学杂志,2019,27(5):1387-1394. CHEN H L,MA P,CHEN Y L,et al. Effect of metformin on proliferation capacity,apoptosis and glycolysis in K562 cells[J]. Journal of Experimental Hematology,2019,27(5):1387-1394. doi:10.19746/j.cnki.issn.1009-2137.2019.05.006.
[11] VISNJIC D,DEMBITZ V,LALIC H. The role of AMPK/mTOR modulators in the therapy of acute myeloid leukemia[J]. Curr Med Chem,2019,26(12):2208-2229. doi:10.2174/0929867325666180117105522.
[12] XIONG Z S,GONG S F,SI W,et al. Effect of metformin on cell proliferation,apoptosis,migration and invasion in A172 glioma cells and its mechanisms[J]. Mol Med Rep,2019,20(2):887-894. doi:10.3892/mmr.2019.10369.
[13] ZHAO Y,SUN H,FENG M,et al. Metformin is associated with reduced cell proliferation in human endometrial cancer by inbibiting PI3K/AKT/mTOR signaling[J]. Gynecol Endocrinol,2018,34(5):428-432. doi:10.1080/09513590.2017.1409714.
[14] NOZHAT Z,MOHAMMADI-YEGANEH S,AZIZI F,et al. Effects of metformin on the PI3K/AKT/FOXO1 pathway in anaplastic thyroid cancer cell lines[J]. Daru,2018,26(2):93-103. doi:10.1007/s40199-018-0208-2.
[15] ZHANG C,HU J,SHENG L,et al. Metformin delays AKT/c-Met-driven hepatocarcinogenesis by regulating signaling pathways for de novo lipogenesis and ATP generation[J]. Toxicol Appl Pharmacol,2019,365:51-60. doi:10.1016/j.taap.2019.01.004.
[16] HONG Y,REN T,WANG X,et al. APR-246 triggers ferritinophagy and ferroptosis of diffuse large B-cell lymphoma cells with distinct TP53 mutations [J]. Leukemia,2022,36(9):2269-2280. doi:10.1038/s41375-022-01634-w.
[17] CHUKKAPALLI V,GORDON L I,VENUGOPAL P,et al. Metabolic changes associated with metformin potentiates Bcl-2 inhibitor,Venetoclax,and CDK9 inhibitor,BAY1143572 and reduces viability of lymphoma cells[J]. Oncotarget,2018,9(30):21166-21181. doi:10.18632/oncotarget.24989.
(2022-06-20收稿 2022-11-15修回)
(本文編辑 李鹏)

