肌少症与退行性腰椎管狭窄症腰椎后路融合内固定术疗效的相关性
鲁崇高,贾杰,拾一方,寇红伟,尚国伟,尚春风,陈松峰,刘宏建
(1.巩义市人民医院 骨科,河南 郑州 451200;2.郑州大学第一附属医院 骨科,河南 郑州 450000)
随着我国人口老龄化程度的加剧,退行性腰椎管狭窄症(degenerative lumbar spinal stenosis,DLSS)的发病率逐年上升,已成为脊柱外科最常见的疾病之一。DLSS患者主要表现为神经源性间歇性跛行,腰臀部及下肢疼痛、麻木,部分中老年DLSS患者的病情可随年龄增长逐渐加重,严重影响了中老年人的生活质量、工作效率和身心健康[1]。肌少症是一种与年龄增长相关的骨骼肌肌肉减少和肌肉力量下降并伴随身体功能减退的综合征[2]。腰椎椎旁肌在维持躯干的正常姿势、保持关节稳定、保护椎间盘和椎小关节等方面发挥着重要作用。有研究指出,腰椎间盘退变常伴随着腰椎脊柱旁肌萎缩和腰椎疾病的发生[3]。本研究通过分析合并肌少症DLSS患者的预后,探究肌少症与接受后路融合内固定术的DLSS患者临床疗效的相关性,为临床个体化治疗方案的制定提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2019年1月至2021年12月在郑州大学第一附属医院骨科住院并接受手术治疗的DLSS患者的临床资料。纳入标准:(1)诊断为DLSS,有明确手术指征;(2)年龄≥50岁;(3)接受腰椎后路减压椎体间融合术(posterior lumbar interbody fusion,PLIF),融合节段≤3个节段;(4)术前腰椎MRI影像学及实验室检查资料完整;(5)随访时间≥12个月。排除标准:(1)术前腰椎退变性侧凸>20°;(2)合并脊柱创伤、感染、结核、肿瘤、强直性脊柱炎;(3)翻修手术;(4)合并先天性脊柱畸形、椎管闭合不全等其他先天性脊柱脊髓疾病;(5)合并其他循环、呼吸、泌尿系统等重要器官功能障碍。本研究最终共纳入122例符合条件的DLSS患者。本研究经医院医学伦理委员会批准。所有参与者均已签署知情同意书,授权其临床信息与影像学资料匿名用于医学研究。
1.2 影像学测量指标
对所有患者术前1周腰椎MRI磁共振图像进行分析,通过连续层面分析腰椎椎旁骨骼肌质量,用以评估全身肌少症。使用imageJ软件,勾勒划定第3腰椎(L3)水平周围肌肉轮廓,包括腰大肌、竖脊肌和多裂肌,并计算3块骨骼肌横截面积总值(cm2)。将每位患者该面积值与其身高的平方(m2)相除进行标准化处理,获得L3水平的骨骼肌指数(skeletal muscle index,SMI)。根据既往文献报道方法[4]并行性别区分,以SMI<27.4 cm2·m-2(男性)和 SMI<23.3 cm2·m-2(女性)作为诊断阈值,将所有患者分为肌少症组和非肌少症组。
1.3 观察指标
(1)视觉模拟评分法(visual analogue score,VAS)评分标准是使用尺子分为10等份,0是不疼,1~3是轻度疼痛,4~6是中度疼痛,7~10是重度疼痛[5]。(2)Oswestry功能障碍指数(Oswestry disability index,ODI)评分是一种自评问卷,用于腰背痛患者的病情评估。问卷包含10个条目,每个条目最低得分为0分,最高得分为5分,计算累计得分,分数越高表示功能障碍程度越重[6]。(3)分别于术前1周、术后3个月、术后6个月及术后12个月评估并记录每个患者的腰腿疼痛VAS评分,用ODI评分系统评估并记录每个患者的腰部功能。
1.4 统计学分析

2 结果
2.1 一般资料
122例DLSS患者年龄50~78岁,平均(61.72±7.15)岁,体重指数(body mass index,BMI)(25.25±4.51)kg·m-2,SMI为(21.82±6.29)cm2·m-2,其中男性SMI为(23.90±5.26)cm2·m-2,女性SMI为(18.06±6.49)cm2·m-2。与非肌少症组患者相比,肌少症组患者年龄更大,BMI更低(P<0.05),见表1。根据患者年龄、性别、BMI、受累节段和是否骨质疏松情况进行倾向评分匹配,匹配后两组各有24例患者纳入对比,两组患者在一般情况差异无统计学意义(P>0.05),见表2。
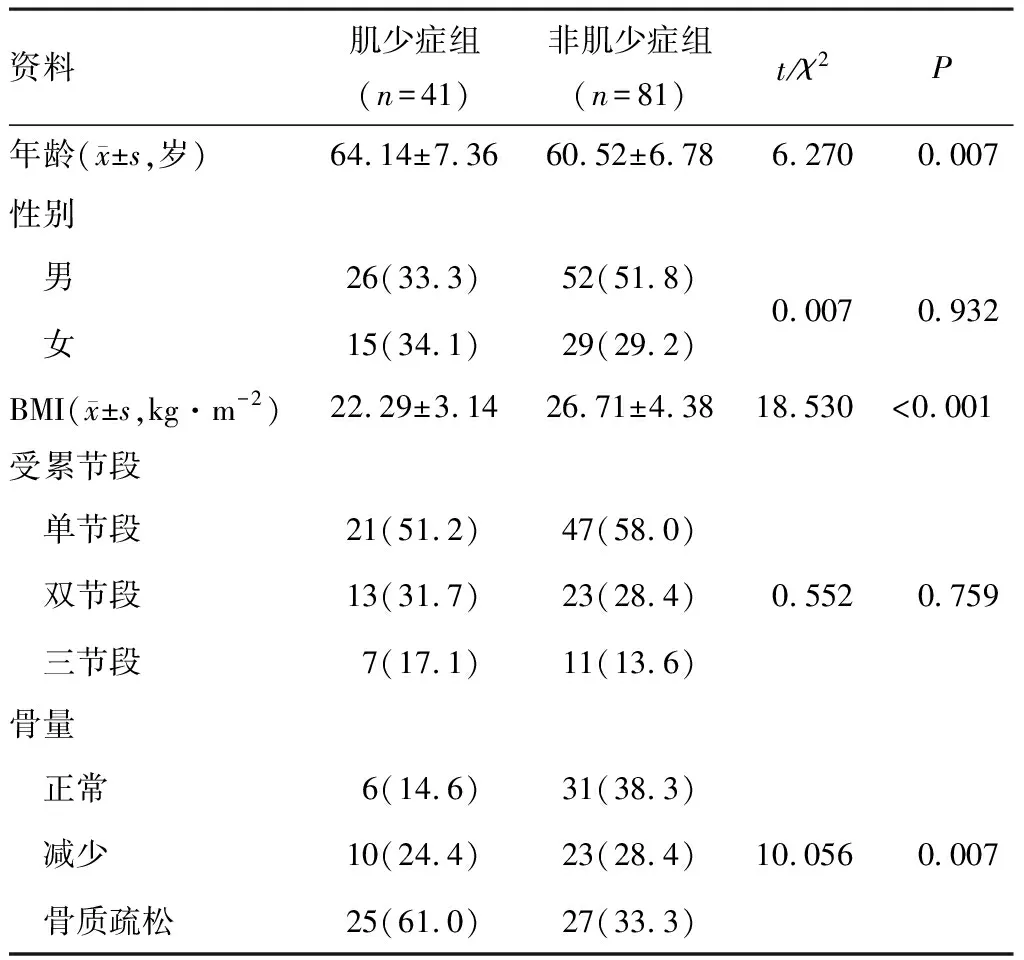
表1 肌少症组与非肌少症组DLSS患者一般情况对比
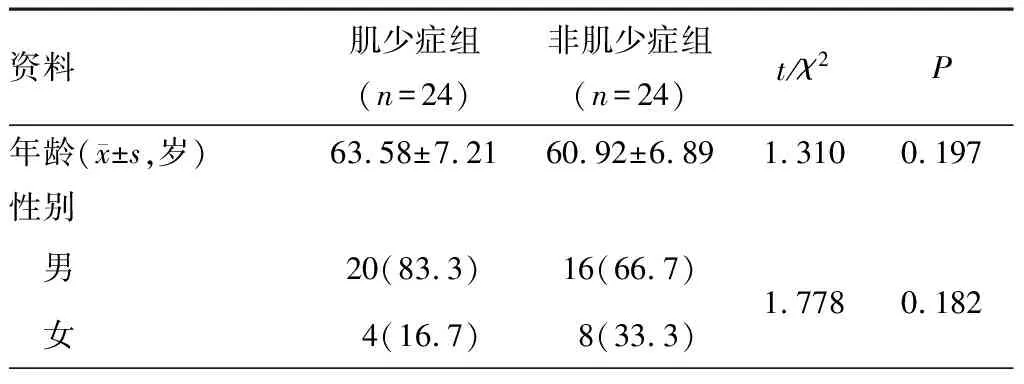
表2 倾向评分匹配后肌少症组与非肌少症组DLSS患者一般情况对比
2.2 VAS和ODI评分
全组患者术中、术后均无严重并发症发生,所有患者均获至少12个月随访。根据匹配后两组患者特征进行分析。术后3个月,非肌少症组患者VAS和ODI评分低于肌少症组(P<0.05);术后6个月及术后12个月两组VAS和ODI评分差异无统计学意义(P>0.05)。见表3。
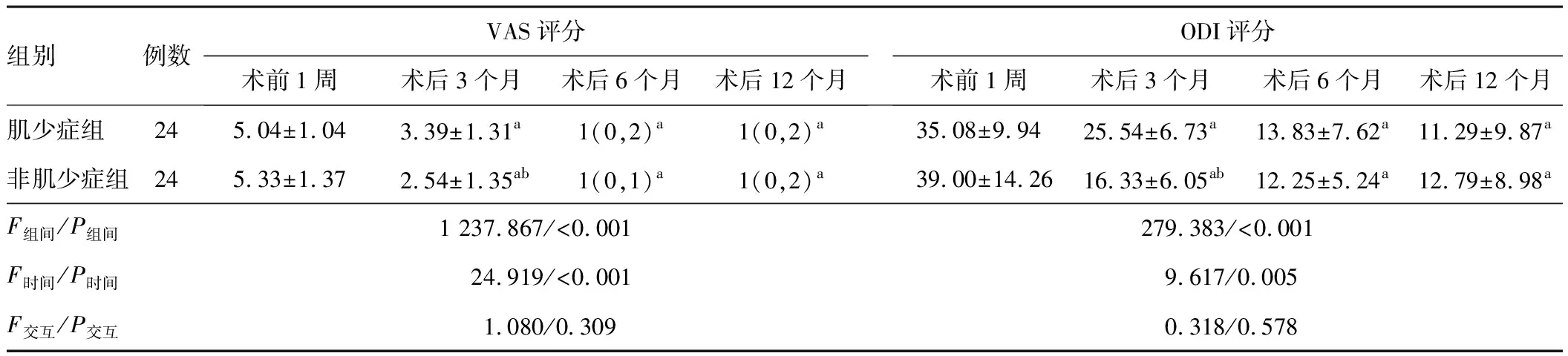
表3 肌少症组和非肌少症组DLSS患者术后临床疗效对比/分
2.3 术前SMI与术后3个月VAS和ODI评分改善率的相关性
线性回归结果显示,术前全组患者SMI与术后3个月VAS和ODI改善率之间存在相关性(P<0.05)。见图1。
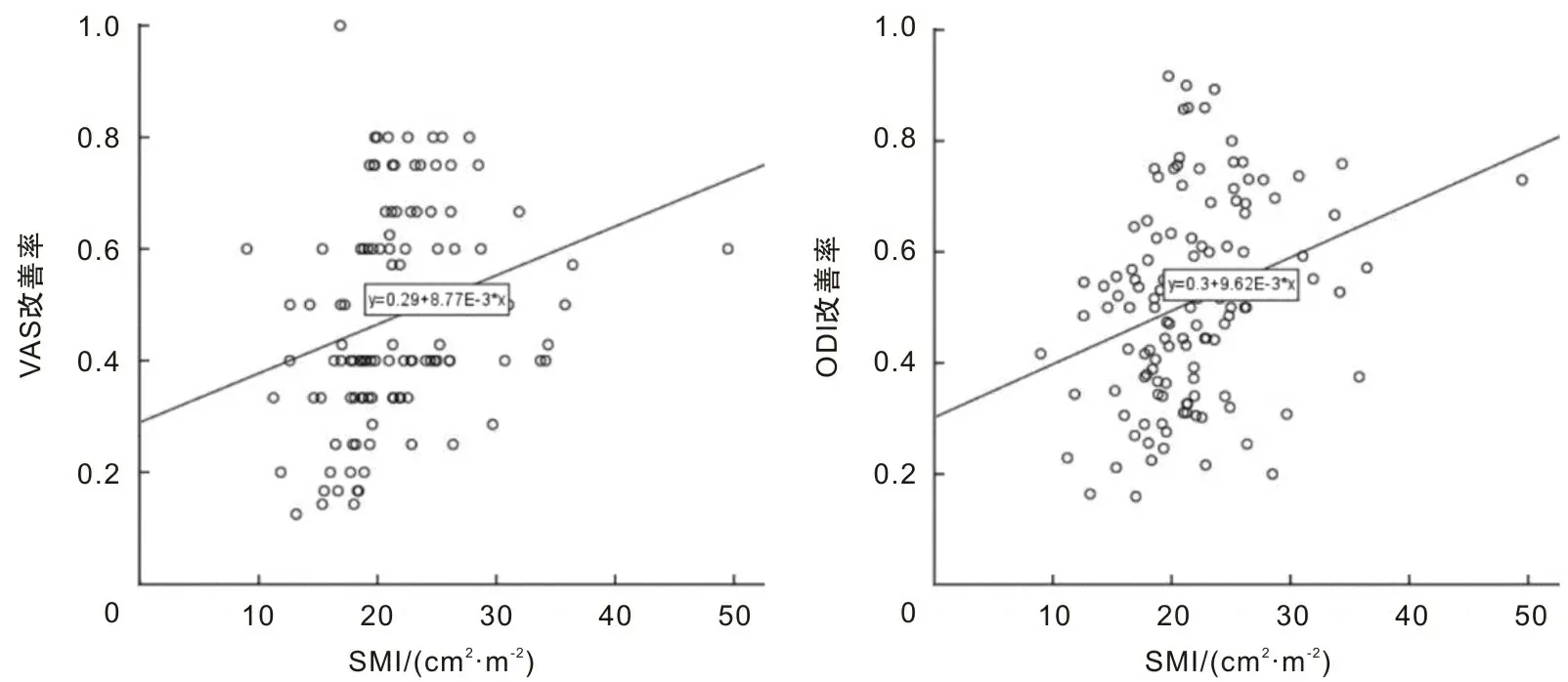
图1 术前SMI与术后3个月临床观察指标改善率的相关性
3 讨论
椎旁肌在稳定腰椎方面发挥了重要作用[7-9],椎旁肌退变可通过影响脊柱力学特性从而加速椎间盘退变[10]。外科手术是治疗DLSS的重要手段,对DLSS患者术前椎旁肌质量进行评估,可能有利于更好地指导脊柱外科医生制定更合理的个体化治疗方案。
MRI和CT是脊柱外科手术患者术前的常规检查,也被多项研究证实为无创评估骨骼肌质量的“金标准”[11]。国内有文献通过腰椎CT测定L3水平总肌肉横断面面积判定肌少症,结果显示接受后路融合手术的非肌少症DLSS患者短期症状改善优于肌少症组患者[12]。肌肉质量减少和脂肪浸润同为骨骼肌退变的重要特征,由于MRI具有良好的软组织分辨率,相较于CT能更好地区分肌肉和脂肪[13],因此本研究收集患者术前腰椎MRI进行椎旁肌质量测量,能更好反映客观实际。
肌少症和骨质疏松常同时发生,在老龄人群中广泛存在,被称为“活动障碍综合征”[14],本研究发现与非肌少症组患者相比,肌少症组患者发生骨质疏松症比率更高,这与既往研究结果[15-16]一致,其可能原因为肌量下降加速骨质疏松症的发生发展,而骨骼强度降低也会促使肌肉形态的萎缩和功能退化。这提示脊柱外科医生对有DLSS的中老人患者合并有肌少症或骨质疏松症一种疾病时,应警惕另一种可能同时存在。
肌少症对腰椎退行性疾病手术效果有影响目前存在争议。Li等[17]通过对69例接受单节段微创融合手术的腰椎退行性疾病患者回顾性分析,发现合并肌少症者的术后ODI评分、ODI改善率均较非肌少症者差。而Toyoda等[18]通过对130例因腰椎退行性疾病行微创减压手术的患者临床资料进行分析,结果显示肌少症并未显著影响术后日本骨科协会评分、疼痛 VAS 评分及 JOA 改善率。其原因除肌少症诊断标准不统一、研究对象和手术方式差异外,与肌少症相关性极强的患者年龄、BMI等因素也可能对结果造成影响。本研究采用倾向评分匹配的统计方法平衡两组患者一般资料,结果显示肌少症组患者术后早期症状改善情况更好,且椎旁肌指数与术后症状改善率存在相关性。首先,在传统腰椎后路开放手术中,术者往往需对椎旁肌进行剥离并造成肌肉损伤,肌少症患者椎旁肌体积较小同时合并有肌肉合成不足因素,椎旁肌损伤需要更长时间恢复[19]。其次,腰椎失状位失衡是导致腰痛等症状持续存在的重要原因,有研究显示,椎旁肌萎缩对脊柱序列有重要影响[20],术前椎旁肌质量减少与术后骨盆倾斜角增大有相关性[21],患者的术前肌少症状态可通过影响腰椎失状位参数而间接导致术后症状持续存在。因此,需择期接受手术的肌少症患者可在围手术期进行早期干预,并在术后制定个体化治疗方案和康复锻炼计划,这对提高腰椎手术疗效可能有积极意义。
4 结论
接受腰椎后路融合内固定手术的合并肌少症的DLSS患者术后早期手术疗效较非肌少症患者差。对肌少症患者行早期筛查并积极干预,可能有利于提高手术临床疗效。本研究样本量较小,同时单中心和回顾性研究设计导致可能有混杂因素和偏倚出现,且未能观察到术后肌肉质量动态变化与疗效对比,后续还需多中心大样本进一步验证。

