淫羊藿及其制剂主要化学成分与肝损伤作用研究进展
张 悦,王佳艺,刘慧敏,殷宏庆,宋丽丽,李遇伯
淫羊藿及其制剂主要化学成分与肝损伤作用研究进展
张 悦,王佳艺,刘慧敏,殷宏庆,宋丽丽*,李遇伯*
天津中医药大学中药学院,天津 301617
近年来,由中药或中药复方制剂引发的肝损伤问题频发。淫羊藿及其复方制剂壮骨关节丸、仙灵骨葆胶囊被发现具有引起肝损伤的风险,通过对淫羊藿及其2种制剂的化学成分进行归纳总结,以淫羊藿及其复方制剂的肝毒性研究为中心,深度剖析淫羊藿相关肝毒性形成原因及风险因素,为科学评价淫羊藿及其制剂的安全性,实现淫羊藿毒性的全面防控奠定理论基础,保证淫羊藿临床用药的安全性。
淫羊藿;制剂;肝损伤;壮骨关节丸;仙灵骨葆胶囊;2″-鼠李糖基淫羊藿次苷II;宝藿苷I;宝藿苷II;箭藿苷A;淫羊藿素;淫羊藿次苷I
淫羊藿是一种多基原中药材,始载于《神农本草经》[1],《中国药典》2020年版规定淫羊藿是小檗科植物淫羊藿Maxim.、箭叶淫羊藿(Sieb. et Zucc.) Maxim.、柔毛淫羊藿Maxim.或朝鲜淫羊藿Nakai的干燥叶[2],可用于治疗类风湿关节炎、骨质疏松等疾病[3-4]。
近年来,有关淫羊藿及其复方制剂致肝损伤或引起不良反应的报道逐年增多。2016年国家药品监督管理局发布“警惕仙灵骨葆口服制剂引起的肝损伤风险”信息通报,由仙灵骨葆胶囊引起的不良反应中,肝胆系统损害占比最高[5]。此外,国家中心病例报告数据库分析提示,含淫羊藿药材的复方制剂壮骨关节丸与肝损伤的关联性较强,主要表现为胆汁瘀积型肝炎[6]。本文通过查阅国内外相关文献,对淫羊藿及其2种制剂的化学成分及肝损伤研究进行全面归纳总结,为淫羊藿及其相关制剂的安全性研究提供参考,同时为其临床安全用药提供思路和支持。
1 淫羊藿及其制剂化学成分
1.1 淫羊藿中主要的活性成分
黄酮类成分是淫羊藿的主要活性成分[7],《中国药典》2020年版以朝藿定A、朝藿定B、朝藿定C和淫羊藿苷4种成分的总含量作为质量控制标准[2]。淫羊藿中黄酮类化合物主要可以分为2类:(1)含有异戊烯基取代的黄酮类成分,其中A环中C-8位为简单异戊烯基取代是最常见的类型;(2)不含异戊烯基取代的黄酮类成分。近年来从淫羊藿中分离得到黄酮类化学成分见表1和图1。
最新的研究表明,多糖也是淫羊藿活性物质基础的主要组分之一[8]。淫羊藿多糖作为一种复合型多糖,主要由果糖、甘露糖、核糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖等单糖组成,具有抗肿瘤、抗病毒、延缓衰老和调节免疫等多种药理作用[9]。
1.2 含淫羊藿制剂的化学成分
淫羊藿作为临床常用的骨伤科用药,目前已被开发成上百种中药制剂。近年来,大量实验研究及临床报道发现,含有淫羊藿药材的壮骨关节丸及仙灵骨葆胶囊2种复方制剂可引发肝损伤[18-19]。仙灵骨葆胶囊以淫羊藿苷、丹酚酸B、补骨脂素、川续断皂苷VI、毛蕊花糖苷和知母皂苷BII作为含量测定的指标成分[20-21]。壮骨关节丸多以柚皮苷、淫羊藿苷、补骨脂素、异补骨脂素、槲皮素等多种化合物作为代表性成分[22-23]。中药复方由多种中药组成,化学成分的种类和数量也十分复杂[24-25]。《中国药典》2020年版收录含淫羊藿的中药复方制剂共54种,通过对该类制剂中主要化学成分进行归纳总结,为含淫羊藿的中药复方制剂的质量控制和药效物质基础研究奠定基础,见表2。

表1 淫羊藿中黄酮类化学成分

图1 淫羊藿中黄酮类成分母核结构
2 淫羊藿及其制剂致肝毒性研究
2.1 淫羊藿致肝毒性研究
2.1.1 淫羊藿致肝毒性的潜在毒性成分 当前对淫羊藿毒性成分的研究集中于黄酮类成分,但由于淫羊藿中黄酮类成分种类繁多,同一化合物可对应多种毒性机制,不同化合物亦可对应同一类型机制,因此通过对淫羊藿中可能具有潜在致毒作用的化学成分及其作用机制进行归纳总结。在淫羊藿中共发现6种具有肝毒性或可导致特异性肝损伤的黄酮类成分,见图2。
由毒性成分所引发的肝损伤机制可分为3类,(1)通过增加氧化应激和细胞凋亡而引发的肝损伤,主要包括2″-鼠李糖基淫羊藿次苷II、宝藿苷I、宝藿苷II、箭藿苷A、淫羊藿素和淫羊藿次苷I[26-28];(2)基于免疫应激模型,由淫羊藿次苷I和淫羊藿次苷II通过特异性增强ATP和nigericin介导的NOD样受体家族的吡啶结构域3(NOD-like receptor family pyrin domain-containing protein 3,NLRP3)炎症小体活化引发的特异性肝损伤[29-30];(3)宝藿苷I通过靶向雌激素受体α抑制法尼醇X受体介导的信号通路,导致胆汁酸的积累,进而导致肝损伤[31]。

表2 《中国药典》2020年版收录的含淫羊藿中药制剂及其主要化学成分
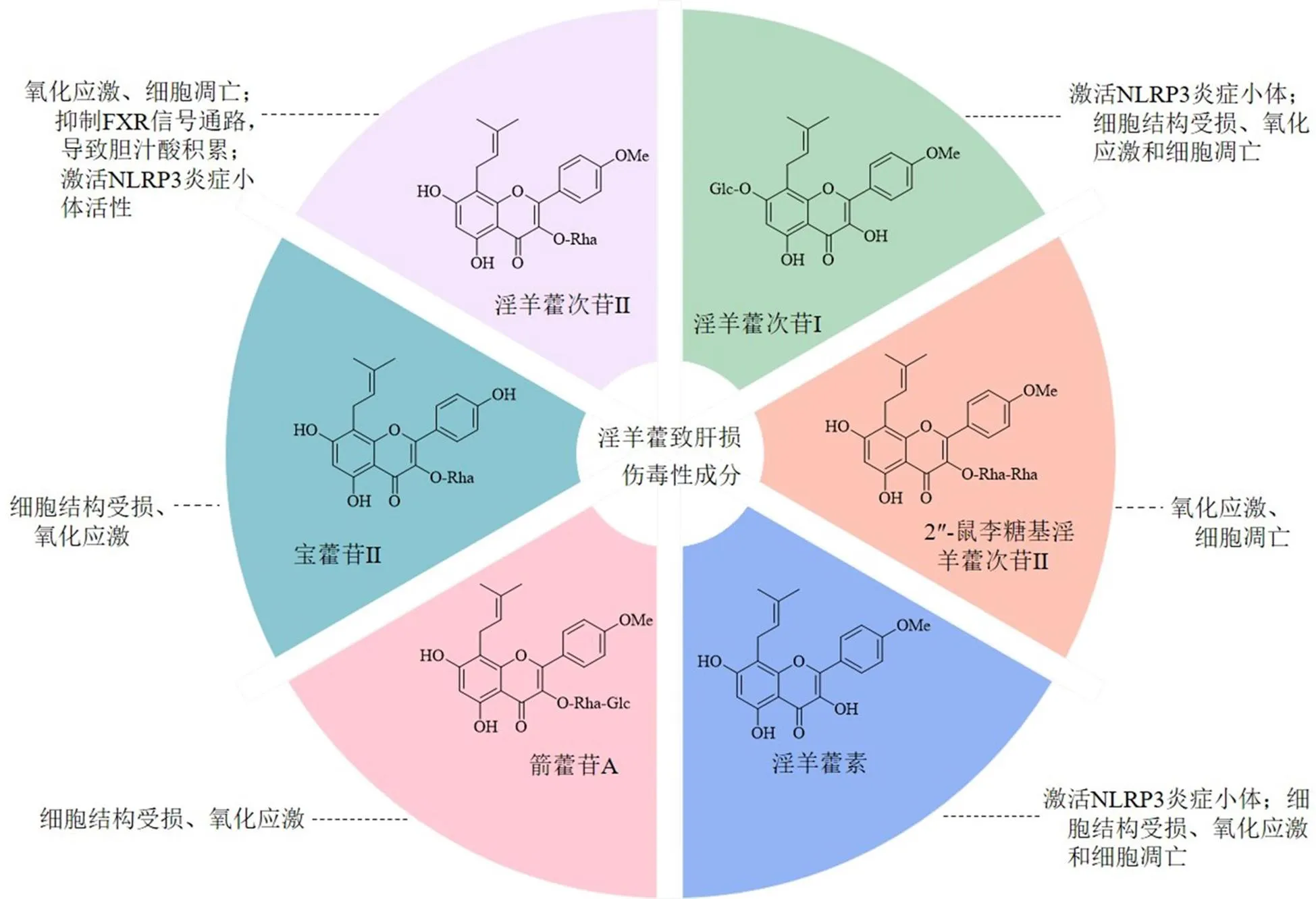
图2 淫羊藿肝毒性物质基础及其作用机制
2.1.2 淫羊藿致肝毒性“量-毒”关系研究 根据药物作用机制,可将药物性肝损伤分为2类:固有型和特异质肝损伤。固有型肝损伤与服药时间和剂量密切相关,而特异质型肝损伤包括免疫特异质和遗传特异质2种[32]。
已有大量研究对淫羊藿的给药剂量、用药时间与肝脏损伤间的关系进行研究,为更好的明确淫羊藿安全用药剂量。李冬梅等[33]通过对淫羊藿总黄酮进行安全性评价,发现小鼠口服淫羊藿总黄酮最大耐受量为36 g/kg。王琴等[34]为评价淫羊藿不同提取物的长期毒性,分别设置淫羊藿醇提物和水提物不同剂量组,给药8周后,小鼠的脏器系数、血常规指标、血清生化指标均显著降低,提示长时间给予大剂量淫羊藿提取物对小鼠有一定的不良反应。Zhao等[35]发现淫羊藿长期给药导致胆汁淤积性肝损伤,其作用机制与胆汁酸代谢和运输受到破坏有关。张林等[36]采用均匀设计结合多元回归分析方法,考察与淫羊藿潜在毒性密切相关多个因素(基原、剂量、疗程等),发现朝鲜淫羊藿和巫山淫羊藿肝毒性较强,淫羊藿对大鼠肝脏毒性随着剂量增加和疗程延长而增强。
随着研究的深入,有部分研究发现淫羊藿及其制剂可诱发免疫特异质肝损伤。Gao等[37]以脂多糖诱导的免疫应激模型大鼠和正常大鼠为研究对象,给予淫羊藿后,脂多糖诱导的免疫应激模型大鼠丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平显著升高,肝脏组织病理切片表现出更严重的肝细胞局灶性坏死和广泛炎症细胞浸润,课题组前期通过检测大鼠血浆中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6等炎症因子水平,发现脂多糖可以诱导大鼠体内炎症因子水平升高,表明非肝毒性剂量的脂多糖引发的轻微炎症反应,降低了淫羊藿致的肝毒性阈值,导致炎症细胞浸润和肝细胞凋亡增加。淫羊藿中的淫羊藿次苷I及淫羊藿次苷II已被证明可通过增强NLRP3炎症小体活化,诱导特异质肝毒性[29,38]。
2.2 含淫羊藿药材的复方制剂致肝毒性研究
2.2.1 壮骨关节丸致肝毒性 壮骨关节丸由淫羊藿、补骨脂、狗脊、独活、骨碎补、续断等12味中药组成[2],临床上可用来治疗风湿骨病,防治骨质疏松[39]。由壮骨关节丸引起的不良反应中,以肝损害病例报道数量最多[40-42],多发于老年人,患者肝脏生化指标ALT、AST、谷氨酰氨基转移酶等显著升高,且相应的病理改变主要是胆汁瘀积[43-45]。
郭胜亚等[46]基于斑马鱼评价壮骨关节丸的肝脏毒性,结果表明壮骨关节丸导致斑马鱼卵黄囊吸收延迟,诱发斑马鱼肝脏毒性。时克等[47]用斑马鱼毒/效同步法评价壮骨关节丸对健康鱼和骨质疏松模型鱼的毒性作用,结果显示,壮骨关节丸对模型斑马鱼的毒性更强。
根据壮骨关节丸的组方特点,结合文献研究及临床病例,唐进法等[48-49]通过免疫应激模型阐明了壮骨关节丸所导致的肝损伤为特异性肝损伤,-鸟氨酸、肌苷等9种代谢物可作为壮骨关节丸致特异质肝损伤易感生物标志物,涉及亚油酸代谢、花生四烯酸代谢等多条代谢通路。荆生龙等[50]以正常大鼠、骨性关节炎及肾虚型骨性关节炎大鼠为研究对象,发现壮骨关节丸引发的肝损伤与疾病的症候类型相关。
2.2.2 仙灵骨葆胶囊致肝毒性 继壮骨关节丸可引起特异质肝损伤报道后,国家药品监督管理局发布了仙灵骨葆胶囊引起肝损伤的通告。据统计,2004—2016年共有不良反应报告2665例,主要包括肝胆系统、胃肠道系统等多系统损害[5],临床表现为肝功能指标异常、呕吐、皮疹、恶心等[51]。目前已有多家医院报道了由仙灵骨葆引起的肝损伤[52-55]。章轶立等[56]对仙灵骨葆胶囊临床应用的安全性进行评估,发现仙灵骨葆胶囊引发肝损伤及其他不良反应与药物成分、不规范用药和联合用药有关。
研究发现,长期服用仙灵骨葆胶囊可引发肝损伤。丁海虎等[57]以仙灵骨葆不同剂量ig于大鼠2周,病理切片显示仙灵骨葆可呈剂量相关性损伤大鼠肝细胞,肝细胞排列紊乱且有炎性浸润。丁雁南等[58]连续ig仙灵骨葆药物27周于小鼠,发现小鼠肝组织炎细胞浸润,出现肝损伤现象。以上动物实验证明,仙灵骨葆胶囊对大鼠或小鼠均具有一定的肝损伤作用。
黄迎等[59]基于免疫应激模型,对仙灵骨葆处方进行拆方实验研究,分为仙灵骨葆全方组、淫羊藿和补骨脂组联用、全方剩余药味组,结果发现,淫羊藿和补骨脂是引起肝损伤的相关药味,全方的肝损伤严重程度弱于淫羊藿和补骨脂联用组,方中的其他4味药具有减轻淫羊藿和补骨脂所致肝损伤作用,其中与丹参的配伍减毒效果最好。Wu等[60]认为仙灵骨葆引起免疫特异性肝损伤的机制与脂质代谢、细胞凋亡和氧化应激相关蛋白的表达有关。吴文晓[61]以氧化应激为中心,从免疫应激、活性氧化酶、药肝酶的角度研究脂多糖联合仙灵骨葆致肝损伤的作用机制,结果表明脂多糖协同仙灵骨葆诱发肝脏内产生大量自由基,发生蛋白硝基化、脂质过氧化,导致肝细胞凋亡和坏死。
3 淫羊藿及其制剂致肝毒性机制
多项研究证明,淫羊藿、壮骨关节丸和仙灵骨葆胶囊长时间大量给药后,可引发肝损伤[34,57,62-63],其相关的毒性机制可能与胆汁酸代谢受阻、肝细胞凋亡及铁死亡、细胞结构受损,氧化应激增加等生物学过程相关[35,64]。并且有多项研究表明,淫羊藿中黄酮类成分朝藿定C的代谢产物为箭藿苷C,箭藿苷C的动态增加与淫羊藿毒性产生密切相关[65-66]。除固有毒性成分引发肝损伤外,以激活NLRP3炎症小体活性的淫羊藿次苷I和淫羊藿次苷II还可以诱发特异质肝损伤。研究表明,脂多糖可刺激机体产生免疫反应,在免疫激活的状态下,淫羊藿次苷I和淫羊藿次苷II可促进NLRP3炎症小体活化,导致促炎因子的释放、细胞焦亡的发生,从而诱发特异质肝损伤[59-60,67-68]。
为减少肝损伤事件的发生,使淫羊藿及其制剂更合理、更安全的应用于临床,进一步对以上2种形式的肝损伤进行总结,见图3。首先需要警惕由长期、大剂量用药造成的固有肝毒性。其次,处于免疫应激状态下的患者,为淫羊藿及其制剂致肝毒性的主要易感人群,此类患者应尽量避免使用淫羊藿及其制剂,降低特异质肝毒性发生的风险。
4 结语与展望
目前由淫羊藿及其制剂所引发的肝损伤问题已经引起了广泛关注,随着研究的深入,大量的文献就毒性成分及其作用机制进行论述。然而值得注意的是,在可能引发肝损伤的潜在毒性成分中,有些毒性成分的作用机制尚不明确,以箭藿苷B为例,目前的研究表明,箭藿苷B可导致斑马鱼胚胎卵黄囊肿胀和吸收延迟,存在发育毒性,并且在低浓度的条件下仍可引起成年斑马鱼细胞坏死,中度水肿及轻度空泡改变[69],但是对于其毒性作用的机制还未有研究进行详细的阐明。由淫羊藿制剂引发的肝毒性问题,前期研究主要集中于作用机制的阐释,但更为重要的是,临床应用的复方制剂,具有成分多样、有效炮制、中药配伍等特点,因此为确保临床用药安全,对含淫羊藿药材的其他制剂进行二次评价意义重大。

图3 淫羊藿及其复方制剂引起肝损伤推断图
近年来,特异质肝损伤发生的概率逐步上升,由中药引起的相关肝损伤问题也备受关注[70]。由于不良反应的发生与药物本身毒性、患者机体状态、用药周期、疗程等多种因素相关,使得毒性形成的机制更为复杂[71-72]。作为潜在毒性中药,在应用淫羊藿及复方制剂时,一方面应警惕淫羊藿的潜在肝毒性问题,另一方面要加强服药期间肝脏功能指标的监测力度,建立系统的临床评价机制,确保用药安全性和有效性。同时建议相关部门加快建立更加科学合理的中药安全性评价方法,为其临床安全用药及含淫羊藿的中药新药研发提供有益借鉴。
利益冲突 所有作者均声明不存在利益冲突
[1]许婷, 黄萌萌, 李瑞云, 等. 多基原淫羊藿不同部位质量评价研究 [J]. 中草药, 2020, 51(1): 190-196.
[2]中国药典 [S]. 一部. 2020: 340.
[3]李远栋, 王世坤, 杨东元, 等. 淫羊藿苷防治膝骨性关节炎作用机制的研究进展 [J]. 中草药, 2023, 54(8): 2652-2658.
[4]乔韬, 许栋, 陈昳冰, 等. 基于文献计量的淫羊藿苷研究热点和未来趋势分析 [J]. 中草药, 2021, 52(23): 7293-7301.
[5]国家药品监督管理局. 药品不良反应信息通报(第72期) 警惕仙灵骨葆口服制剂引起的肝损伤风险[EB/OL]. [2016-12-08]. https://www.nmpa.gov.cn/xxgk/ yjjsh/ypblfytb/20161208170501622.html.
[6]国家药品监督管理局. 药品不良反应信息通报(第16期) 警惕壮骨关节丸引起的肝损害[EB/OL]. [2008-08-09].https://www.nmpa.gov.cn/xxgk/yjjsh/ypblfytb/ 20080809162301345.html
[7]Lu Y, Luo Q L, Jia X B,. Multidisciplinary strategies to enhance therapeutic effects of flavonoids from: Integration of herbal medicine, enzyme engineering, and nanotechnology [J]., 2023, 13(3): 239-254.
[8]李畅. 淫羊藿多糖对其难溶性黄酮苷的增溶作用及机制初探 [D]. 南京: 南京中医药大学, 2022.
[9]陈亮, 郝梦超, 安超娜, 等. 淫羊藿多糖提取工艺及其药理活性研究进展 [J]. 江苏调味副食品, 2023, 40(1): 5-8.
[10]马文娟, 姚广哲, 贾琪, 等. UPLC-Q-TOF-MS/MS法定性分析淫羊藿中的化学成分 [J]. 中药材, 2019, 42(7): 1554-1559.
[11]孟宁, 孔凯, 李师翁. 淫羊藿属植物化学成分及药理活性研究进展 [J]. 西北植物学报, 2010, 30(5): 1063-1073.
[12]吕磊, 张海, 赵亮, 等. RRLC-TOF/MS快速鉴别中药淫羊藿中43种化学成分 [J]. 第二军医大学学报, 2011, 32(3): 306-310.
[13]于雪娥, 秦建平, 李家春, 等. 基于UPLC/Q-TOF- MS/MS技术快速分析淫羊藿总黄酮胶囊中的化学成分 [J]. 中国中药杂志, 2016, 41(24): 4587-4597.
[14]栗金柳. 反相二维色谱分离制备淫羊藿黄酮化学成分研究 [D]. 大连: 大连工业大学, 2019.
[15]李明雨, 孙娥, 徐凤娟, 等. 基于UPLC-Q/TOF-MS分析淫羊藿炮制前后黄酮组分的变化规律 [J]. 中草药, 2020, 51(11): 2900-2907.
[16]韩笋. 不同品种淫羊藿药材质量综合评价 [D]. 上海: 华东理工大学, 2012.
[17]甘井山, 马艳, 王宗艳, 等. 淫羊藿中化学成分的UPLC/Q-TOF-MS分析 [J]. 现代药物与临床, 2014, 29(4): 349-352.
[18]熊殷, 吴嘉瑞, 张程亮. 壮骨关节丸致肝损伤的研究进展 [J]. 中南药学, 2019, 17(12): 2084-2087.
[19]杜倩, 王哲, 运乃茹, 等. 仙灵骨葆胶囊致不良反应185例文献分析 [J]. 中国药房, 2017, 28(27): 3785-3787.
[20]黄春跃, 周靖, 欧阳丹薇, 等. 基于HILIC技术的仙灵骨葆胶囊中间体及成品HPLC-ELSD指纹图谱 [J]. 中国医药工业杂志, 2020, 51(1): 108-112.
[21]姚志红, 郑远茹, 周先强, 等. 基于HPLC-UVD-ELSD指纹图谱结合主要代表成分同时定量的仙灵骨葆整体质控研究 [J]. 中国药学杂志, 2018, 53(17): 1504-1510.
[22]孙秀川. HPLC测定壮骨关节丸中柚皮苷的含量 [J]. 内蒙古医学杂志, 2014, 46(4): 463-464.
[23]颜冬梅, 王跃飞, 刘亚男, 等. 紫外波长切换高效液相色谱法同时测定壮骨关节丸中7种有效成分的含量 [J]. 药物分析杂志, 2010, 30(4): 637-640.
[24]Meng N, LYU Y, Zhang X Y,. The exciting and magical journey of components from compound formulae to where they fight [J]., 2022, 2(4): 240-252.
[25]Liu C X. Quality study needs innovation [J]., 2021, 13(1): 1.
[26]Zhang L, Wang T, Zhao B S,. Effect of 2″-- rhamnosyl icariside II, baohuoside I and baohuoside II in herba epimedii on cytotoxicity indices in HL-7702 and HepG2 cells [J]., 2019, 24(7): 1263.
[27]Zhang L, Xu A L, Yang S,.screening and toxic mechanism exploring of leading components with potential hepatotoxicity ofextracts [J]., 2020, 62: 104660.
[28]赵祯, 王俏蕾, 杜金法, 等. 整合“谱-毒” 关系和网络毒理学发现淫羊藿致肝损伤的潜在毒性成分 [A]// 中国毒理学会第十次全国毒理学大会论文集 [C]. 合肥: 中国毒理学会, 2023: 1.
[29]Gao Y, Xu G, Ma L,. Icariside I specifically facilitates ATP or nigericin-induced NLRP3 inflammasome activation and causes idiosyncratic hepatotoxicity [J]., 2021, 19(1): 13.
[30]张龙. 靶向炎症小体的淫羊藿炮制减毒的质量评价研究 [D]. 太原: 山西中医药大学, 2021.
[31]Zhao Z, Yang L L, Wang Q L,. Baohuoside I inhibits FXR signaling pathway to interfere with bile acid homeostasis via targeting ER α degradation [J]., 2023, 39(4): 1215-1235.
[32]杨燕, 葛斐林, 黄倩, 等. 中药相关肝损伤的风险因素 [J]. 临床肝胆病杂志, 2022, 38(5): 1183-1187.
[33]李冬梅, 尹晓飞, 蔡大伟. 淫羊藿总黄酮急性毒性试验研究 [J]. 中国药师, 2007, 10(10): 1011-1012.
[34]王琴, 张盼阳, 袁晓美, 等. 淫羊藿不同提取物的小鼠长期毒性研究 [J]. 中国药物警戒, 2018, 15(2): 65-69.
[35]Zhao J Q, Zhao Z, Zhang C,. Long-term oral administration ofinduced cholestasis in mice by interfering with bile acid transport [J]., 2022, 293: 115254.
[36]张林, 张晶璇, 范琼尹, 等. 均匀设计结合多元回归分析用于淫羊藿对大鼠肝毒性的影响 [J]. 中国实验方剂学杂志, 2018, 24(6): 189-197.
[37]Gao Y, Wang Z L, Tang J F,. New incompatible pair of TCM:combined withinduces idiosyncratic hepatotoxicity under immunological stress conditions [J]., 2020, 14(1): 68-80.
[38]Wang Z L, Xu G, Wang H B,. Icariside Ⅱ, a main compound in, induces idiosyncratic hepatotoxicity by enhancing NLRP3 inflammasome activation [J]., 2020, 10(9): 1619-1633.
[39]宋蕾, 袁晓美, 毕亚男, 等. 壮骨关节丸对去势所致雌性小鼠骨质疏松的治疗作用 [J]. 时珍国医国药, 2020, 31(2): 307-310.
[40]宋晓静. 壮骨关节丸致肝损害一例 [J]. 中外医疗, 2009, 28(18): 181.
[41]江晓静, 葛娅, 靳桂敏. 壮骨关节丸致药物性肝损害1例 [J]. 中国医院药学杂志, 1994, 14(5): 1431.
[42]邓培媛, 蔡皓东, 程经华, 等. 壮骨关节丸致肝损害30例报告 [J]. 中国新药杂志, 1996, 5(3): 212-214.
[43]孙功惠, 尹宏怡. 壮骨关节丸致肝内胆汁瘀滞1例 [J]. 安徽中医学院学报, 1995, 14(1): 45.
[44]刘丽萍, 刘峰群. 口服壮骨关节丸发现肝内胆汁郁积型肝损害3例 [J]. 新药与临床, 1995, 14(2): 120.
[45]刘丽萍. 壮骨关节丸引起药物性肝内胆汁淤积型肝炎1例 [J]. 药学情报通讯, 1993, 11(1): 28.
[46]郭胜亚, 朱晓宇, 廖文瀚, 等. 斑马鱼模型评价5种中药肝脏毒性 [J]. 实验动物科学, 2016, 33(5): 21-27.
[47]时克, 王茉, 景莉君, 等. 基于斑马鱼毒/效同步评价的壮骨关节丸促骨骼发育作用与初步安全性研究 [J]. 中国现代应用药学, 2019, 36(2): 164-167.
[48]唐进法, 王晓艳, 杨伟, 等. 基于统计建模的壮骨关节丸诱发特异质肝损伤相关易感性细胞因子分析 [J]. 药学学报, 2018, 53(4): 574-584.
[49]唐进法, 王晓艳, 李伟霞, 等. 基于相关可视化的壮骨关节丸特异质肝损伤与27种细胞因子的相关性分析 [J]. 中草药, 2018, 49(7): 1624-1633.
[50]荆生龙, 徐彭, 赵宏艳, 等. 壮骨关节丸对肾虚型骨性关节炎大鼠脏器系数及总胆红素的影响 [J]. 中国中医基础医学杂志, 2012, 18(10): 1087-1089.
[51]高欢欢, 章轶立, 谢雁鸣, 等. 仙灵骨葆口服制剂的不良反应信号挖掘研究 [J]. 中国药物警戒, 2020, 17(5): 284-289.
[52]朱春雾, 王海南, 张亚蕾, 等. 仙灵骨葆胶囊导致肝损伤 [J]. 肝脏, 2018, 23(12): 1090-1093.
[53]欧阳燕婷, 何杏仪, 陈丽敏, 等. 仙灵骨葆胶囊使用后肝功能异常的相关影响因素分析 [J]. 医学理论与实践, 2022, 35(5): 851-853.
[54]杨毅恒, 周艳莉. 仙灵骨葆胶囊致肝功能异常2例 [J]. 药物不良反应杂志, 2007, 9(3): 214-215.
[55]杨良芹, 彭官良. 仙灵骨葆胶囊致重度肝损害1例 [J]. 中国药物警戒, 2013, 10(1): 62.
[56]章轶立, 廖星, 刘福梅, 等. 仙灵骨葆胶囊上市后用药安全性系统评价 [J]. 中国中药杂志, 2017, 42(15): 2845-2856.
[57]丁海虎, 倪虹, 王元元, 等. 仙灵骨葆胶囊对大鼠肝损伤的作用及机制研究 [J]. 牡丹江医学院学报, 2021, 42(4): 12-15.
[58]丁雁南, 马红红, 石富国, 等. 仙灵骨葆单独及与奥美拉唑联合应用的肝毒性研究 [J]. 遵义医学院学报, 2019, 42(3): 265-271.
[59]黄迎, 刘亚蕾, 马润然, 等. 仙灵骨葆相关肝损伤的临床病例分析及拆方实验研究 [J]. 药学学报, 2021, 56(1): 266-273.
[60]Wu W X, Wang T, Sun B,. Xian-Ling-Gu-Bao induced inflammatory stress rat liver injury: Inflammatory and oxidative stress playing important roles [J]., 2019, 239: 111910.
[61]吴文晓. 仙灵骨葆致大鼠药物性肝损伤及机制研究 [D]. 北京: 北京协和医学院, 2019.
[62]陈颖, 王茉, 景莉君, 等. 基于斑马鱼模型筛选壮骨关节丸毒性药味高效筛选 [J]. 世界科学技术—中医药现代化, 2017, 19(1): 133-141.
[63]隋海霞, 高芃, 徐海滨. 淫羊藿水提取物的食用安全性研究 [J]. 癌变·畸变·突变, 2006, 18(6): 439-442.
[64]Li P, Zhang L, Guo Z J,.nakai–induced liver injury—A mechanistic study using untargeted metabolomics [J]., 2022, 13: 934057.
[65]陈颖. 抗骨接生软膏药学研究及斑马鱼评价 [D]. 南京: 南京中医药大学, 2017.
[66]葛静, 凌洁, 宁青, 等. 基于斑马鱼M-Act/Tox联合评价箭叶淫羊藿的代谢-效/毒作用 [J]. 中草药, 2019, 50(7): 1614-1620.
[67]王智磊. 基于NLRP3炎症小体的淫羊藿致免疫特异质肝损伤易感成分及作用机制研究 [D]. 成都: 成都中医药大学, 2021.
[68]唐进法, 李伟霞, 王晓艳, 等. 基于代谢组学的壮骨关节丸致特异质肝损伤相关易感生物标志物筛查 [J]. 中华中医药杂志, 2018, 33(10): 4336-4340.
[69]Zhong R L, Chen Y, Ling J,. The toxicity and metabolism properties offlavonoids on Laval and adult zebrafish [J]., 2019, 2019: 3745051.
[70]He S B, Zhang C Y, Zhou P,. Herb-induced liver injury: Phylogenetic relationship, structure-toxicity relationship, and herb-ingredient network analysis [J]., 2019, 20(15): 3633.
[71]Jing J, Teschke R. Traditional Chinese medicine and herb-induced liver injury: Comparison with drug-induced liver injury [J]., 2018, 6(1): 1-12.
[72]Yang Y, Ge F L, Tang J F,. A review of herb-induced liver injury in mainland China [J]., 2022, 13: 813073.
Research progress on main chemical constituents and liver injury effects ofand its preparations
ZHANG Yue, WANG Jia-yi, LIU Hui-min, YIN Hong-qing, SONG Li-li, LI Yu-bo
School of Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
In recent years, there has been an increasing occurrence of liver injury caused by traditional Chinese medicine or complex formulations of traditional Chinese medicine. Studies have identified a risk of liver injury associated with the herb Yinyanghuo () and its complex preparations such as Zhuanggu Guanjie Pills (壮骨关节丸) and Xianling Gubao Capsule (仙灵骨葆胶囊). By summarizing the chemical components ofand these two preparations, this research aims to analyze the hepatotoxicity ofand its complex preparations, and investigate the underlying causes and risk factors. The goal is to establish a theoretical basis for the comprehensive prevention and control oftoxicity and ensure the safety of its clinical use.
; preparations; liver injury; Zhuanggu Guanjie Pills; Xianling Gubao Capsule; 2--rhamnosyl icariside II; baohuoside I; baohuoside Ⅱ; sagittatoside A; icaritin; icariside I
R285
A
0253 - 2670(2023)21 - 7213 - 09
10.7501/j.issn.0253-2670.2023.21.030
2023-04-25
国家中医药管理局青年岐黄学者支持项目
张 悦(1998—),硕士研究生,研究方向为中药分析。E-mail: zy18749313836@163.com
通信作者:宋丽丽,副教授,硕士生导师,从事代谢组学和中药分析研究。E-mail: sll0204@163.com
李遇伯,教授,博士生导师,从事代谢组学及毒性评价研究。E-mail: yuboli1@163.com
[责任编辑 赵慧亮]

