痰热清注射液干预慢性阻塞性肺疾病模型大鼠的蛋白组学研究
罗 倩,彭 博,魏晓露,王彩霞,陈腾飞,宋 玲,高云航,叶祖光,张广平,侯红平
痰热清注射液干预慢性阻塞性肺疾病模型大鼠的蛋白组学研究
罗 倩,彭 博,魏晓露,王彩霞,陈腾飞,宋 玲,高云航,叶祖光,张广平*,侯红平*
中国中医科学院中药研究所,北京 100700
研究痰热清注射液对慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)模型大鼠的治疗作用,同时采用串联质谱标签(tandem mass tags,TMT)定量蛋白质组学探讨其可能的作用机制。Wistar大鼠随机分为对照组、模型组、地塞米松(4 mg/kg)组和痰热清注射液高、中、低剂量(4、2、1 g/kg)组,除对照组外,其余各组制备COPD模型,各给药组ip相应药物。连续给药90 d后,检测肺功能和肺泡灌洗液中细胞因子水平;采用苏木素-伊红和天狼猩红染色观察肺组织病理变化;通过TMT定量蛋白质组学分析对照组、模型组、痰热清注射液中剂量组大鼠肺组织差异蛋白。与对照组比较,模型组大鼠自主活动和精神状态均有所降低,肺功能的顺应性降低(<0.001),阻力增大(<0.001),肺组织炎症细胞浸润,肺泡腔扩大,气道壁胶原纤维沉积,表明COPD模型制备成功。与模型组比较,痰热清注射液组大鼠肺功能明显得到改善(<0.01、0.001),肺泡灌洗液中炎症因子水平明显降低(<0.05、0.01、0.001)。蛋白组学分析结果显示,痰热清注射液中剂量组和模型组共有61个差异蛋白,差异蛋白与细胞的坏死、凋亡、自噬等信号通路密切相关。痰热清注射液能够明显改善COPD模型大鼠的肺功能等症状,其机制与细胞的坏死、凋亡、自噬等信号通路密切相关。
痰热清注射液;慢性阻塞性肺疾病;蛋白组学;肺功能;炎症因子;自噬
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种进展缓慢,可造成早期死亡率、高死亡率的慢性呼吸系统疾病。其主要特征是气道阻塞,可逆性差,可导致呼吸衰竭等严重并发症。研究发现,除吸烟外,职业因素、感染、空气污染、气道高反应性、社会和经济因素等与COPD的发生发展也密切相关[1]。COPD的患病率因国家、年龄和性别而异。2020年,COPD已从1990年的全球第6大死亡原因上升至第3位[2]。同时,COPD是一种典型的异质性疾病,可造成多种并发症,包括神经系统疾病、抑郁、贫血、睡眠呼吸暂停、肥胖症、代谢综合征、糖尿病、心血管疾病、胃食管返流疾病、骨质疏松症、过敏性疾病和肺癌等[3-5]。在未来的挑战中,早发现早预防,进行有效地治疗是COPD所面临的挑战。
中医认为,COPD患者反复咳喘,肺气自虚,脾气亦虚。因肺失治节、脾失健运、肾失蒸腾,则痰饮内生,肝失疏泄条达,则气滞有血停瘀生,循环往复,造成痰热肺阻证[6]。在治疗方面,应注重活血化瘀、清热化痰等。痰热清注射液是由黄芩、熊胆粉、山羊角、金银花、连翘组成的中药静脉注射制剂,是我国对中药采取指纹图谱监测标准后生产的第1个注射剂品种。具有清热解毒、化痰止咳、退热和平喘的作用,用于治疗痰热肺阻之症[7-8]。目前,临床上已将痰热清注射液与西医治疗联合用于COPD[9-12],取得了良好的效果。但痰热清注射液是否对COPD具有确切的疗效,又是通过何种途径起到治疗效果尚不清楚。本研究主要建立COPD大鼠模型,通过给予痰热清注射液,观察动物的症状改善,同时采用串联质谱标签(tandem mass tags,TMT)定量蛋白质组生物信息学分析探讨其可能的作用机制。
1 材料
1.1 动物
SPF级雄性Wistar大鼠84只,体质量130~160 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0011,动物使用许可证号SYXK(京)2019-0003。动物饲养于中国中医科学院中药研究所实验动物屏障环境(SPF级),温度20~24 ℃,相对湿度45%~65%,12 h/12 h光照与黑暗交替进行。实验过程中严格遵守动物福利原则,并经中国中医科学院中药研究所伦理委员会批准(批准号2019A1320)。
1.2 药品与试剂
脂多糖(lipopolysaccharides,LPS,批号120M4030V)购自美国Sigma公司;鸿运香烟(条形码6901028250542)购自河北中烟工业有限责任公司;痰热清注射液(批号1906303)购自上海凯宝药业股份有限公司;地塞米松磷酸钠注射液(批号19110802A)购自贵州天地药业有限责任公司;甲醛(批号20180418)购自天津市大茂化学试剂厂;核因子-κB(nuclear factor-κB,NF-κB)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号分别为20200528、2020041、20200617、20200516)购自武汉华美生物工程有限公司;TMT标记试剂盒(批号XH351170)购自美国Thermo公司。
1.3 仪器
DSI/BUXCO气道阻力和肺顺应性监测系统(美国DSI公司);SPG-C型烟雾发生器(苏州阿洛斯环境发生器有限公司);Spectramax i3x型多功能酶标仪(美国Molecular Devices公司);BSA3202S-CW型电子天平(德国Sartorius公司);3-18KS型高速冷冻离心机(美国Sigma公司)。
2 方法
2.1 动物分组、造模与给药
按体质量分层法将大鼠随机分为对照组、模型组、地塞米松(4 mg/kg,临床等效剂量)组和痰热清注射液高、中、低剂量(4、2、1 g/kg,分别相当于临床剂量的2、1、1/2倍)组[13],每组14只。对照组大鼠正常饮食和饮水,其余各组大鼠制备COPD模型。在造模的第1天和第14天,气管滴注20 μL LPS(4 mg/mL),其余时间置于自制烟熏箱中,持续烟熏1.5 h,连续90 d。在造模的第2天,各给药组ip相应药物,连续给药90 d。
2.2 大鼠一般状态观察
造模和给药期间,密切观察大鼠的一般状态,主要为自主活动状况、精神状态、呼吸情况等,每周测定大鼠的体质量。
2.3 肺功能检测
末次给药后,麻醉大鼠,气管插管,测定大鼠的动态顺应性(dynamic compliance,Cydn)和气道阻力(airway resistance,RI)。
2.4 肺灌洗液中细胞因子水平的检测
待肺功能检测完成,大鼠腹主动脉采血后,采用生理盐水对气管和左肺进行灌洗,每次1.5 mL,重复2次,合并灌洗液。将收集的肺灌洗液于4 ℃、1000 r/min离心10 min,取上清液。按照ELISA试剂盒说明书测定上清液中NF-κB、IL-1β、IL-6和TNF-α水平。
2.5 苏木素-伊红(hematoxylin-eosin,HE)染色和天狼猩红(picrosirius red,PSR)染色观察肺组织病理变化
将大鼠的右肺置于4%多聚甲醛中进行固定,梯度乙醇脱水后,二甲苯透明浸透,包埋切片,切片厚度约为3 μm,对切片进行脱蜡后,分别进行HE和PSR染色。HE染色中,细胞核被苏木素染成紫蓝色,多数细胞质及非细胞成分被伊红染成粉红色,用来观察肺组织的结构状态。PSR染色主要用来显示胶原纤维。染色后,采用中性树胶封片,于显微镜下观察并拍照。
2.6 TMT定量蛋白质组学检测和分析
取对照组、模型组和痰热清注射液中剂量组的肺组织,采用SDT裂解法提取蛋白质,BCA法测定其含量。胰蛋白酶酶解蛋白质后,按照TMT标记试剂盒说明书标记蛋白质,采用LC-MS/MS进行数据采集,采用软件Mascot2.2和Proteome Discoverer1.4进行蛋白质鉴定及定量分析,分析不同组别差异蛋白质的含量。使用Pfam数据库对差异蛋白质的结构域进行分析。利用Blast2GO对目标蛋白质集合进行基因本体(gene ontology,GO)注释,GO功能注释主要分为生物过程(biological process,BP),分子功能(molecular function,MF)和细胞组分(cellular component,CC)。利用KAAS软件,对目标蛋白质集合进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路注释。
2.7 统计学分析
3 结果
3.1 大鼠一般状态观察
造模和给药期间,对照组大鼠无明显异常,正常进食饮水。模型组大鼠自主活动明显减弱,精神萎靡,懒动倦卧,毛色无光泽、稀疏、枯槁,进食明显减少,体质量有所下降,出现不同程度的咳嗽、喷嚏等呼吸道症状。地塞米松组和痰热清注射液高、中剂量组大鼠状态较模型组有明显的改善,大鼠体质量也有所恢复。
3.2 痰热清注射液对COPD模型大鼠肺功能的影响
如表1所示,与对照组比较,模型组大鼠的Cydn显著降低(<0.001),RI显著升高(<0.001);与模型组比较,地塞米松组和痰热清注射液高、中剂量组Cydn显著升高(<0.01、0.001),RI显著降低(<0.01、0.001)。
3.3 痰热清注射液对COPD模型大鼠肺泡灌洗液中细胞因子水平的影响
如表2所示,与对照组比较,模型组大鼠肺泡灌洗液中IL-1β、IL-1β、NF-κB和TNF-α水平均显著升高(<0.001);与模型组比较,地塞米松组和痰热清注射液高、中剂量组肺泡灌洗液中IL-1β、IL-1β、NF-κB和TNF-α水平均显著降低(<0.05、0.01、0.001)。

表1 痰热清注射液对COPD模型大鼠肺功能的影响(, n = 12)
与对照组比较:***<0.001;与模型组比较:#<0.05##<0.01###<0.001,表2同
***< 0.001control group;#< 0.05##< 0.01###< 0.001model group, same as table 2

表2 痰热清注射液对COPD模型大鼠肺泡灌洗液中细胞因子水平的影响(, n = 12)
3.4 痰热清注射液对COPD模型大鼠肺组织病理变化的影响
HE染色(图1)结果显示,对照组大鼠肺泡结构完整,气道上皮结构完整。模型组大鼠炎症细胞浸润,肺泡腔扩大,部分破裂融合成肺大疱,小叶中央型肺气肿,细支气管官腔狭窄,管壁增厚,管腔内渗出增多。地塞米松组和痰热清注射液高、中剂量组肺组织结构有所改善,炎性细胞浸润和管腔内渗出有所减少。PSR染色(图2)结果显示,与对照组比较,模型组大鼠气管壁明显增厚,胶原纤维沉积明显。地塞米松组和痰热清注射液高、中剂量组胶原纤维有所减少,管壁增厚不明显。
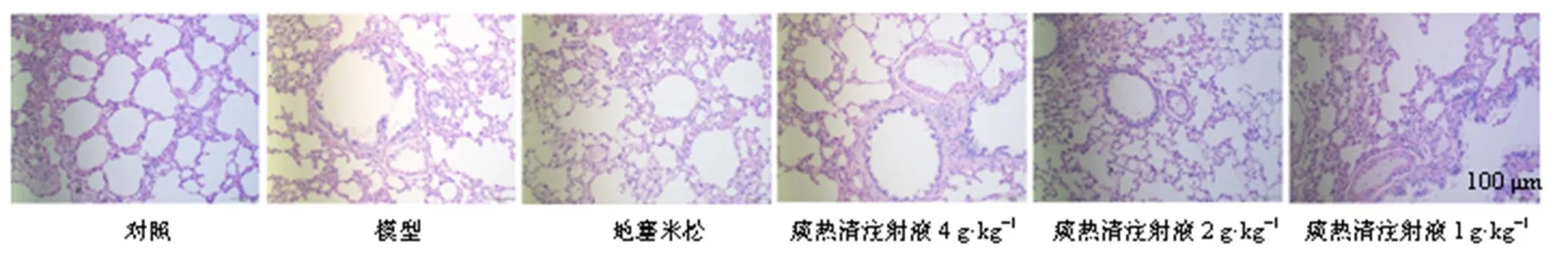
图1 痰热清注射液对COPD模型大鼠肺组织病理变化的影响(HE, ×200)

图2 痰热清注射液对COPD模型大鼠肺组织病理变化的影响(PSR, ×200)
以上结果提示,痰热清注射液能够明显缓解COPD模型大鼠病理进展,而中剂量为有效剂量。为此,将对照组、模型组和痰热清注射液中剂量组的肺组织进行TMT定量蛋白质组学的检测和分析。
3.5 TMT定量蛋白质组学分析
经TMT定量蛋白组学的蛋白质鉴定和差异分析,发现痰热清注射液中剂量组与模型组共有61个差异蛋白,其中上调的蛋白有43个,下调的蛋白有18个(表3)。对上述差异蛋白进行结构域分析显示,痰热清注射液中剂量组与模型组差异蛋白的结构域主要集中在甘油醛3-磷酸脱氢酶NAD结合结构域、甘油醛3-磷酸脱氢酶C-末端结构域、蛋白激酶结构域、胰蛋白酶、钙调神经磷酸酶样磷酸酯酶、醛脱氢酶家族、免疫球蛋白V-set结构域、7跨膜受体(视紫红质家族)、SH3结构域、U-PAR/Ly-6域、中间丝蛋白、免疫球蛋白结构域、RNA识别基序、丝氨酸蛋白酶抑制剂、铁/锰超氧化物歧化酶、木瓜蛋白酶家族半胱氨酸蛋白酶、纤维母细胞生长因子、C2结构域、PH结构域、Hsp90蛋白(图3)。
对上述差异蛋白进行GO分析显示,BP主要涉及细胞死亡、程序性细胞死亡、细胞死亡的负调节、细胞死亡的调节、程序性细胞死亡的调节、凋亡过程、细胞对活性氧的反应、颗粒酶介导的凋亡信号通路等。MF主要涉及氧化物歧化酶活性、氧化还原酶活性、三价铁丁丙、3-氯烯丙醛脱氢酶活性、一氧化氮跨膜转运体活性、氨酰基-tRNA水解酶活性等。CC主要包括胞外区、DUBm复合物和SAGA复合物等(图4)。

表3 痰热清注射液中剂量组和模型组的差异蛋白

图3 痰热清注射液中剂量组与模型组差异蛋白的结构域分析
对上述差异蛋白进行KEGG分析,如图5、6所示,痰热清注射液中剂量组与模型组差异蛋白涉及的信号通路主要有坏死、新霉素、卡那霉素和庆大霉素生物合成、溶酶体、抗原加工和呈递、脂质和动脉粥样硬化、破骨细胞分化、核黄素代谢、2型糖尿病淀粉和蔗糖代谢、半乳糖代谢、金黄色葡萄球菌感染、表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂抗性、胃癌、肾素分泌、乳腺癌、信号通路调节干细胞的多能性、胆汁分泌、神经刺激性配体-受体相互作用、黑色素瘤、戊糖磷酸途径、近端小管碳酸氢盐回收、泛醌和其他萜类醌生物合成等。其他信号通路图详见https://www.kegg.jp/。

图4 痰热清注射液中剂量组与模型组差异蛋白的GO分析
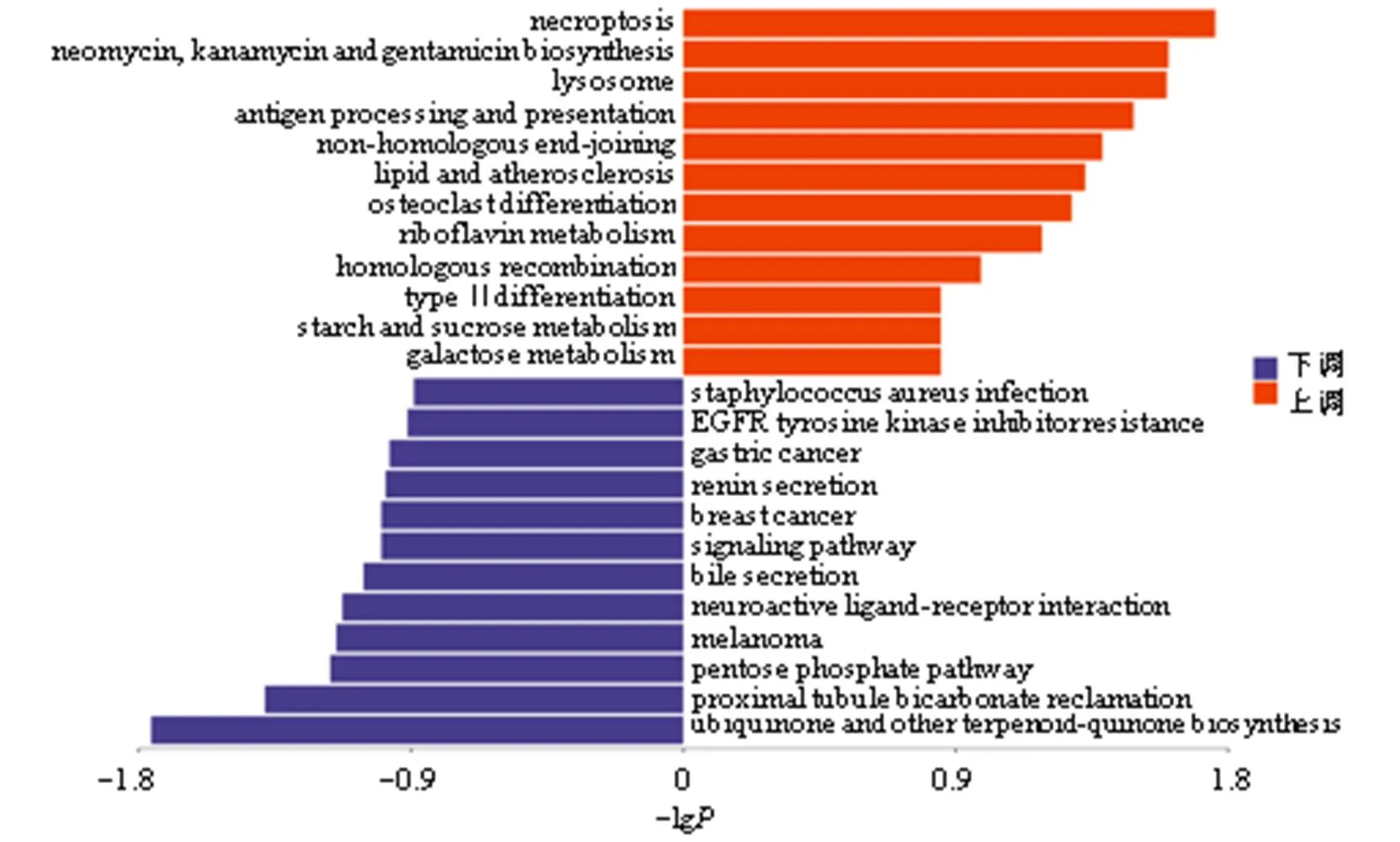
图5 痰热清注射液中剂量组与模型组差异蛋白的KEGG分析

绿底方框表示差异蛋白质下调,小圆圈表示小分子代谢物,大圆框代表其他通路,其中浅绿色底方框为物种专属蛋白
4 讨论
痰热清注射液中黄芩为君药,熊胆粉和山羊角为臣药,金银花和连翘为使药,君药味苦性寒,具有泻火解毒、清热燥湿的作用。臣药具有抑菌、镇咳、平喘、清热解毒之功效。使药具有宣肺化痰、清热解毒的作用。方中诸药,相互配伍,互相协同,起到清热解毒、化痰宣肺之功效。现代药理学研究表明,痰热清注射液可以抑制金黄色葡萄球菌生物被膜的形成过程[14-15],同时能够阻断呼吸道合胞病毒感染靶细胞[16],抑制细菌和病毒的增殖[17],增强机体的免疫力。痰热清注射液能够抑制IL-6、TNF-α、IL-8等炎症因子的表达[18],起到抗炎的作用,这与本研究的结果一致。临床研究报道表明,痰热清注射液可减轻痰热壅肺型COPD急性加重期的氧化应激损伤,改善肺功能[19]。通过本研究药效学指标和组织病理学指标的检测,证实痰热清注射液对COPD具有良好的干预效果,不仅能够抑制炎症因子的表达,抑制气道壁纤维化的进展,同时能够明显改善动物的肺功能,且中剂量为有效剂量。
蛋白组学分析显示,痰热清注射液干预COPD与抑制细胞坏死和凋亡等生物过程密切相关。研究表明,COPD患者氧化应激和系统性炎症明显增强,而TNF-α和肿瘤坏死因子受体-α2(tumor necrosis factor receptor-α2,TNFR-α2)在吸烟者和无症状COPD患者之间存在差异,可作为COPD患者潜在的标志物[20]。凋亡被认为是COPD发生发展的重要途径,而COPD的发生发展过程与肺泡巨噬细胞[21]、肺泡上皮细胞[22]、气道上皮细胞[23]的凋亡密切相关。烟雾和感染的持续刺激,诱发肺组织氧化应激失衡,导致细胞凋亡信号的激活。
研究表明,自噬参与了COPD病理的发展过程。在烟雾诱导的COPD动物模型中,自噬溶酶体的数量和相关蛋白的表达均明显升高,表明COPD过程中存在明显的自噬现象[24],敲除自噬相关的基因和蛋白,能明显改善COPD的症状[25]。其他研究也表明,COPD患者肺组织和肺血管的自噬表达明显增强,气管成纤维的自噬参与COPD的气道重塑[26]。本研究蛋白组学分析显示,痰热清注射液参与COPD的自噬过程,痰热清注射液治疗COPD可能与溶酶体自噬过程密切相关。
KEGG分析结果显示,痰热清注射液中剂量组与模型组差异蛋白的信号通路涉及糖尿病代谢、半乳糖代谢、胃癌、肾素分泌、乳腺癌、神经刺激性配体-受体相互作用等。分析认为,这与COPD的并发症密切相关。COPD并不是单纯性的肺部炎症,其作为一类疾病能够导致多种并发症,涉及多个系统和多种疾病,如神经系统的抑郁等精神性疾病,代谢系统的肥胖、代谢综合征、糖尿病等[27-28],消化系统的胃食管反流疾病等,均会给患者带来沉重的经济负担和医疗负担。而痰热清注射液作为中成药,其多靶点多途径的治疗特色和优势,对COPD的并发症也有一定的作用和影响。
综上,痰热清注射液能够改善COPD动物模型炎症表达和肺功能的降低,具有良好的治疗效果,蛋白组学显示,其机制与干预坏死、凋亡、自噬和相关并发症的发生等密切相关。
利益冲突 所有作者均声明不存在利益冲突
[1]Zhu B F, Wang Y F, Ming J,. Disease burden of COPD in China: A systematic review [J]., 2018, 13: 1353-1364.
[2]Raherison C, Girodet P O. Epidemiology of COPD [J]., 2009, 18(114): 213-221.
[3]Putcha N, Drummond M B, Wise R A,. Comorbidities and chronic obstructive pulmonary disease: Prevalence, influence on outcomes, and management [J]., 2015, 36(4): 575-591.
[4]Skloot G S, Busse P J, Braman S S,. An official American thoracic society workshop report: Evaluation and management of asthma in the elderly [J]., 2016, 13(11): 2064-2077.
[5]Ko F W, Chan K P, Hui D S,. Acute exacerbation of COPD [J]., 2016, 21(7): 1152-1165.
[6]吴蕾, 郑俐慈, 陈远彬, 等. 基于宗气、元气理论探讨慢性阻塞性肺疾病的病机与辨治 [J]. 中医杂志, 2023, 64(14): 1440-1443.
[7]郭涛, 冯永海, 胡静. 痰热清注射液联合头孢哌酮舒巴坦治疗重症肺炎的临床研究[J]. 现代药物与临床, 2021, 36(11): 2314-2317.
[8]陈国全. 痰热清注射液雾化吸入联合孟鲁司特钠治疗小儿肺炎的临床研究[J]. 药物评价研究, 2022, 45(7): 1382-1386.
[9]朱科. 痰热清注射液和盐酸氨溴索对老年慢阻肺合并肺部感染患者的临床治疗效果 [J]. 智慧健康, 2020, 6(8): 141-142.
[10]梁春娜. 氨溴索注射液联合痰热清注射液治疗慢阻肺的临床效果[J]. 临床医学研究与实践, 2020, 5(17): 40-41.
[11]Fan G H, Wang D Y, Wu S N,. Better response to Tanreqing Injection in frequent acute exacerbation of chronic obstructive pulmonary disease (AECOPD) patients-real-world evidence from a nationwide registry (ACURE) study [J]., 2023, 14: 1118143.
[12]孔艺, 吴红卫, 陈永, 等. 基于网络药理学和分子对接探讨痰热清注射液治疗新型冠状病毒肺炎(COVID-19)的机制[J]. 中草药, 2020, 51(7): 1785-1794.
[13]叶兆伟. 中药药理学 [M]. 重庆: 重庆大学出版社, 2015: 26-27.
[14]Yang W F, Liu J L, Blažeković B,.antibacterial effects of Tanreqing Injection combined with vancomycin or linezolid against methicillin-resistant[J]., 2018, 18(1): 1-10.
[15]王玉彩, 菅向东, 王东兴, 等. 痰热清胶囊药理作用及临床应用 [J]. 中国社区医师, 2020, 36(27): 102-103.
[16]王毅军, 奚肇庆, 冯旰珠. 痰热清对呼吸道合胞病毒体外抑制作用研究 [J]. 河北医药, 2010, 32(24): 3447-3448.
[17]郑金粟, 顾立刚. 痰热清注射液对流感病毒FM1感染小鼠抗病毒作用的研究 [J]. 中华中医药杂志, 2009, 24(7): 851-854.
[18]金希, 刘川宁. 痰热清注射液治疗支气管哮喘急性发作期对患者血清炎性因子水平的影响 [J]. 临床医学研究与实践, 2019, 4(5): 124-126.
[19]刘新艳, 于文宁, 张玉净, 等. 痰热清注射液对痰热壅肺型AECOPD患者氧化应激、肺功能和临床疗效的影响[J/OL]. 辽宁中医杂志, (2023-06-08) [2023-09-14]. http://kns.cnki.net/kcms/detail/21.1128.R.20230607.1647.078.html.
[20]Caram L, Ferrari R, Nogueira D L,. Tumor necrosis factor receptor 2 as a possible marker of COPD in smokers and ex-smokers [J]., 2017, 12: 2015-2021.
[21]张阳, 焦雨佼, 巩翠珂, 等. 慢阻肺患者鲍曼不动杆菌感染肺泡巨噬细胞凋亡机制的研究 [J]. 中国病原生物学杂志, 2022, 17(9): 1082-1085.
[22]胡姮, 邹志红, 张刚成. 赤芍总苷通过NF-κB通路对慢阻肺大鼠肺组织炎症及凋亡的作用研究 [J]. 湖北中医药大学学报, 2022, 24(3): 16-20.
[23]李冷. 健脾益肺II号通过调节ROS-ER stress-Ca2+信号通路减少COPD气道上皮细胞凋亡的作用机制研究 [D]. 广州: 广州中医药大学, 2020.
[24]Li Y X, Yu G G, Yuan S P,. Cigarette smoke-induced pulmonary inflammation and autophagy are attenuated in Ephx2-deficient mice [J]., 2017, 40(2): 497-510.
[25]Bodas M, Van Westphal C, Carpenter-Thompson R,. Nicotine exposure induces bronchial epithelial cell apoptosis and senescence via ROS mediated autophagy-impairment [J]., 2016, 97: 441-453.
[26]欧应勇. COPD患者肺组织中IL-17A、支气管成纤维细胞自噬的变化 [D]. 遵义: 遵义医科大学, 2022.
[27]Pavord I D, Jones P W, Burgel P R,. Exacerbations of COPD [J]., 2016, 11: 21-30.
[28]Guerreiro I, Soccal P. COPD and phenotypes [J]., 2019, 15(671): 2082-2086.
Proteomic study of Tanreqing Injection on chronic obstructive pulmonary disease model rats
LUO Qian, PENG Bo, WEI Xiao-lu, WANG Cai-xia, CHEN Teng-fei, SONG Ling, GAO Yun-hang, YE Zu-guang, ZHANG Guang-ping, HOU Hong-ping
Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
To study the therapeutic effect of Tanreqing Injection (痰热清注射液) on chronic obstructive pulmonary disease (COPD) model rats, and explore its possible mechanism by tandem mass tags (TMT) quantitative protein omics.Wistar rats were randomly divided into control group, model group, dexamethasone (4 mg/kg) group and Tanreqing Injection high-, medium-and low-dose (4, 2, 1 g/kg) groups. Except for the control group, COPD models were prepared in other groups, and the corresponding drugs were given to each group. After 90 d of continuous administration, lung function and cytokine level in alveolar lavage fluid were detected. Hematoxylin-eosin and picrosirius red staining were used to observe the pathological changes of lung tissue. The differential proteins in lung tissue of rats in control group, model group and Tanreqing Injection medium-dose group were analyzed by TMT quantitative protein omics.Compared with control group, the autonomic activity and mental state of rats in model group were decreased, the compliance of lung function was decreased (< 0.001), the resistance was increased (< 0.001), inflammatory cells infiltrated in lung tissue, alveolar cavity expanded and collagen fibers deposited in airway wall, which indicated that the COPD model was successfully prepared. Compared with model group, the lung function of rats in Tanreqing Injection group was significantly improved (< 0.01, 0.001), and the levels of inflammatory factors in alveolar lavage fluid were significantly decreased (< 0.05, 0.01, 0.001). Proteomic analysis showed that there were 61 differential proteins in Tanreqing Injection medium-dose group and model group, which were closely related to cell necrosis, apoptosis, autophagy and other signal pathways.Tanreqing Injection can obviously improve the lung function and other symptoms of COPD model rats, and its mechanism is closely related to signal pathways such as cell necrosis, apoptosis and autophagy.
Tanreqing Injection; chronic obstructive pulmonary disease; proteomics; lung function; inflammatory factor; autophagy
R285.5
A
0253 - 2670(2023)21 - 7078 - 08
10.7501/j.issn.0253-2670.2023.21.016
2023-07-22
国家自然科学基金资助项目(82104502);中央级公益性科研院所基本科研业务费专项基金资助项目(ZXKT23006,ZZ13-YQ-060,ZXKT21020);中国中医科学院科技创新工程(CI2021A04615)
罗 倩,硕士,研究方向为中药药理。E-mail: luoqian2000508@163.com
通信作者:侯红平,副研究员,从事慢性疾病的新药研发与机制研究。E-mail: hphou@icmm.ac.cn
张广平,研究员,从事中药药理毒理研究。E-mail: gpzhang@icmm.ac.cn
[责任编辑 李亚楠]

