黄芪总皂苷对三氧化二砷诱导H9c2细胞损伤的保护作用
杨秀华 ,钱新宇,王玥璇,智慧,艾丹,肖云峰*
(1 内蒙古医科大学 药学院,呼和浩特 010110;2 呼伦贝尔职业技术学院,呼伦贝尔 021000;3 包头市第四医院,包头 014030)
三氧化二砷(ATO)俗称砒霜,最初被用于治疗银屑病或结核病的辅助药物[1-2].随着医学的发展,发现其可用于治疗急性早幼粒细胞白血病[3],治愈率高达80%以上[4].随着对ATO的逐步研究,发现其对肺癌[5]、宫颈癌[6]、肝癌[7-8]等疾病也具有较好的治疗作用,应用前景良好.但在抗肿瘤时它对心、脑、肾等也会产生一定的毒性[9].研究表明,ATO 通过引起氧化应激反应致使细胞损伤,最终导致细胞凋亡[10-11],故抑制细胞凋亡可能是减轻ATO 诱导心脏毒性的合理方法之一.黄芪总皂苷(ASTs)是中药黄芪的成分之一,本课题组前期实验结果发现,ASTs可以激活PI3K/Akt/Nrf2 信号传导途径而发挥抗氧化作用[12],但是它能否最终抑制细胞凋亡,是本文的研究重点.现有研究显示:ASTs 通过明显降低Bax、Caspase-3、Caspase-9 蛋白表达及促进Bcl-2 表达来发挥对过氧化物诱导心肌细胞凋亡的作用[13-14].因此,本文拟通过观察ASTs 对ATO 诱导的H9c2 细胞形态、凋亡率及凋亡相关因子Bcl-2、Bax、Caspase-3、Caspase-9mRNA 和蛋白表达的影响,探讨ASTs对ATO所产生的心肌细胞毒性的保护作用,为ASTs进一步的研究和应用提供实验依据.
1 材料与方法
1.1 材料
1.1.1 试剂与细胞
H9c2心肌细胞(上海富恒细胞库);黄芪总皂苷(南京狄尔格医药科技);Bax 抗体、Bcl-2 抗体、Caspase-9抗体、β-actin抗体(英国abcam);Caspase-3抗体(美国CST);合成引物(上海生工).
1.1.2 主要仪器
台式高速冷冻离心机(3K15,美国Gene Company Limited);荧光倒置生物显微镜(DM3000,德国Leica);CO2培养箱(MCO-15AC,美国Thermo Fisher);立式高压蒸汽灭菌锅(ES-315,日本TOMY);电泳仪(Mini Trans-Blot,美国Bio-Rad);红外荧光扫描成像系统(ODYSSEY CLX,美国LI-COP).
1.2 方法
1.2.1 细胞培养
将H9c2 细胞接种于含10%FBS 的DMEM 培养基中进行培养.当细胞生长融合至约80%时,用0.25%胰酶消化传代,取对数生长期的细胞用于后续实验.
1.2.2 检测ATO对细胞活力的影响
将细胞密度调为1×104个/孔,接种于96 孔板,孵育36 h.空白组用无血清培基液处理,ATO 组分别用含有终浓度为1、2、4、6、8、10 µg·mL-1ATO 无血清培养12 h.取10 µL 的CCK-8 液添加至每孔中,孵育1 h,测定波长为450 nm的吸光度,计算细胞存活率.
1.2.3 检测ASTs对细胞活力的影响
细胞分组前操作同1.2.2.空白组用无血清培养液处理,ASTs 预孵育组将含有终浓度为25、50、100 µg·mL-1ASTs 的无血清培养液作用12 h,换液,继续培养12 h,计算存活率.
1.2.4 检测ASTs对ATO致H9c2细胞的损伤的影响
细胞分组前操作同1.2.2.空白组无血清孵育12 h 后,换液,继续培养12 h;模型组用培养基孵育12 h 后换用6 µg·mL-1ATO 的培养基孵育12 h;ASTs(低、中、高)浓度组分别加入25、50、100 µg·mL-1含ASTs的培养基孵育12 h后换用6 µg·mL-1ATO 的培养基孵育12 h.监测其生长状态,计算各组细胞存活率.
1.2.5 Hoechst 33342染色观察H9c2细胞凋亡形态
将细胞密度调为1×105个/孔,接种于24 孔板,孵育36 h.分组及培养时间同1.2.4.后续实验按说明书进行,观察细胞凋亡形态并进行拍照.
1.2.6 流式细胞术检测H9c2细胞凋亡率
将细胞密度调为2×106个/孔,接种于6 孔板,孵育36 h.分组及培养时间同1.2.4,0.25%胰酶消化细胞,离心收集,后续实验严格按照说明书进行操作,1 h内用流式细胞仪检测凋亡率.
1.2.7 RT-qPCR测定相关mRNA表达水平
将细胞以1×106个/孔接种于6 孔板中,孵育36 h.分组及培养时间同1.2.4,后续实验严格按照说明书进行操作,用RT-qPCR 技术检测相关凋亡因子mRNA的表达.引物序列见表1.

表1 引物序列Tab.1 Primer sequences
1.2.8 Western Blot检测相关蛋白表达
将心肌细胞以1×106个/孔接种于6 孔孵育板中,孵育36 h.分组及培养时间同1.2.4,收集细胞,提蛋白,测定蛋白浓度.后续实验严格按照说明书进行操作,使用红外激光成像系统检测相关凋亡因子蛋白表达水平.
1.2.9 统计学方法
2 结果
2.1 ATO对心肌细胞活力的影响
用CCK-8 法检测并计算不同浓度ATO 对H9c2细胞的存活率,结果见图1.由图1可知:与空白组比较,ATO 1~10 µg·mL-1组细胞活力显著降低(P<0.01).

图1 ATO对心肌细胞存活率的影响(n=6)Fig.1 Effect of ATO on the survival rate of cardiomyocytes(n=6)
2.2 ASTs对心肌细胞活力的影响
用CCK-8 法检测并计算不同浓度ASTs 对H9c2细胞的存活率,结果见图2.由图2 可知:与空白组比较,ASTs 各浓度组对H9c2 细胞存活率无明显影响(P>0.05),不会干扰对ATO 诱导细胞凋亡影响的实验结果.

图2 不同浓度ASTs对H9c2细胞存活率的影响(n=6)Fig.2 Effects of different concentrations of ASTs on the survival rate of H9c2 cells(n=6)
2.3 ASTs 预孵育对ATO 致H9c2 细胞活力下降的影响
CCK-8 法检测并计算各组别细胞的活力,结果见图3.由图3可知:与空白组比较,模型组细胞活力显著降低(P<0.01).与模型组比较,ASTs 25、50、100µg·mL-1预孵育12 h可显著提高细胞活力(P<0.01),以高浓度组保护作用最佳.
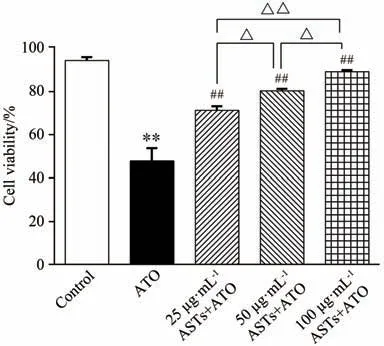
图3 ASTs对ATO诱导心肌损伤的保护作用(n=6)Fig.3 Protective effect of ASTs on ATO-induced myocardial injury(n=6)
2.4 ASTs 预孵育对ATO 致H9c2 细胞损伤形态学影响
各组细胞处理后,观察其生长状态及形态学变化,结果见图4.由图4 可知:空白组H9c2 心肌细胞生长状态好、数量多、均呈长梭形;模型组细胞收缩成圆形,伴有大量细胞死亡;ASTs 各浓度组大部分细胞仍保持长梭形形态,以高浓度组细胞形态最佳.

图4 ASTs对ATO诱导的H9c2细胞损伤的形态学影响Fig.4 Morphological effects of ASTs on ATO-induced injury in H9c2 cells
2.5 ASTs对H9c2细胞凋亡形态的影响
细胞处理后,观察H9c2 细胞凋亡形态,结果见图5.由图5可知:空白组细胞荧光染色均匀,呈低蓝色,形态大小均一,很少见凋亡细胞[图5(a)];模型组呈亮蓝色,可见核固缩,凋亡细胞增多[图5(b)];与ATO模型组比较,ASTs低、中、高浓度组凋亡细胞比例显著减少,正常细胞数目增多[图5(c)-图5(e)].

图5 ASTs对H9c2细胞凋亡形态的影响(10×10)Fig.5 Effects of ASTs on the apoptosis morphology of H9c2 cells(10×10)
2.6 流式细胞术检测H9c2细胞凋亡率
将各组细胞处理后,流式细胞仪检测凋亡率,结果见图6.由图6可知;与空白组相比,模型组细胞凋亡细胞显著升高(P<0.01);与模型组相比,ASTs 各组凋亡细胞显著减少(P<0.01).
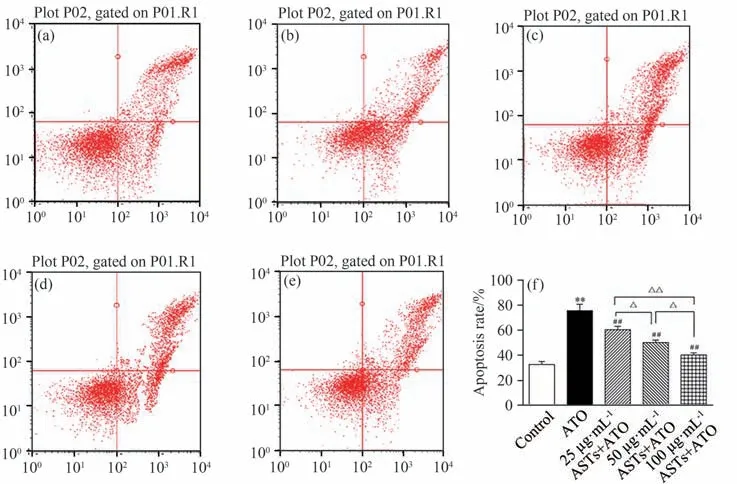
图6 流式细胞术检测H9c2细胞凋亡率(n=3)Fig.6 H9c2 cell apoptosis rate detected by flow cytometry(n=3)
2.7 ASTs预孵育对相关mRNA表达水平的影响
将各组细胞处理后,用RT-qPCR 技术检测相关mRNA表达水平,结果见图7.由图7可知:与空白组比较,ATO 降低了Bcl-2mRNA 水平(P<0.01),升高了Bax、Caspase-3、Caspase-9mRNA 水平(P<0.01);与模型组比较,ASTs升高了Bcl-2mRNA水平(P<0.01),降低了BaxmRNA 水平(P<0.05),ASTs中、高浓度组降低了Caspase-3、Caspase-9mRNA水平(P<0.05).
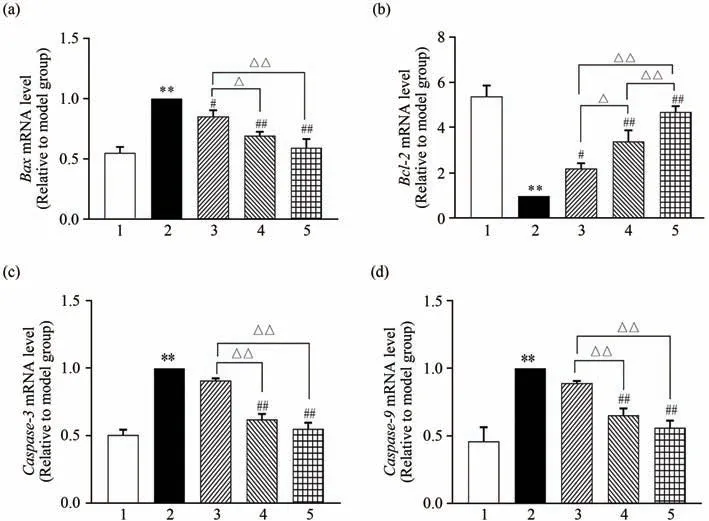
图7 ASTs对心肌细胞Bax、Bcl-2、Caspase-3、Caspase-9 mRNA表达的影响(n=3)Fig.7 Effect of ASTs on the expression of Bax,Bcl-2,Caspase-3,Caspase-9 mRNA in cardiomyocytes(n=3)
2.8 ASTs预孵育对相关蛋白表达的影响
将各组细胞处理后,用红外激光成像系统检测各组细胞的相关蛋白的表达,结果见图8.由图8 可知:与空白组比较,ATO降低Bcl-2/Bax水平(P<0.01),升高Caspase-3、Caspase-9 水平(P<0.01);与模型组比较,ASTs中、高浓度升高Bcl-2/Bax水平(P<0.01),降低Caspase-3、Caspase-9水平(P<0.05).
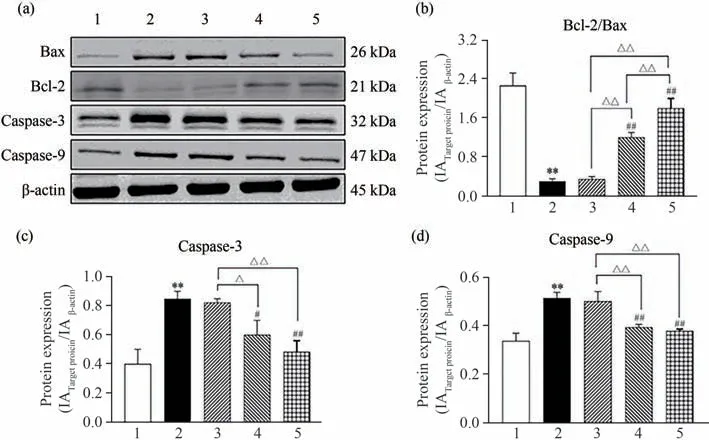
图8 ASTs对H9c2细胞Bax、Bcl-2、Caspase-3和Caspase-9蛋白表达的影响(n=3)Fig.8 Effects of ASTs on the expression of Bax,Bcl-2,Caspase-3 and Caspase-9 proteins in cardiomyocytes(n=3)
3 讨论
ATO 发挥抗恶性肿瘤作用的主要机制是其能够诱导肿瘤细胞凋亡,但同时也是产生毒性反应的主要原因之一[15].本文发现:ATO 导致H9c2 心肌细胞活力下降,心肌细胞凋亡发生率显著升高,心肌细胞凋亡数目增多,这是药物产生心脏毒性的重要病理机制之一,因此抑制心肌细胞凋亡是考察心脏保护药物药效的指标之一.ASTs 预孵育能提高心肌细胞活力,降低细胞凋亡的比例,从而降低 ATO 产生的心脏毒性,发挥心脏保护作用.
细胞凋亡是维持各器官、组织及细胞等所处内环境稳态的重要方式[16],是一种复杂的分子调控机制,由Bcl-2 家族和Caspase 家族两大家族进行调控.Bcl-2 家族是主要的细胞调控基因之一,作用于线粒体,使膜通道开放以及促凋亡物质流动[17],是调节细胞凋亡过程的一类蛋白质,由抗凋亡因子和凋亡因子组成.其中Bcl-2 是抗凋亡因子,保护细胞免于凋亡,Bax 是促凋亡因子,促使细胞凋亡,二者共同决定细胞的存亡[18-19],Bcl-2与Bax是一对最主要的拮抗基因,Bcl-2与Bax可形成异二聚体,其比值参与细胞凋亡的调控[6].李珊珊等[20]研究发现:华蟾素通过上调Bax,下调Bcl-2基因而诱导人胃癌 MKN-45 细胞凋亡.本文研究发现:ASTs 使Bcl-2/Bax 明显升高,显示其抗凋亡作用,抑制ATO 引起的心肌细胞凋亡.Caspase家族相关因子在细胞凋亡中也发挥了至关重要的作用,主要是诱导细胞程序性死亡而介导细胞凋亡[21].其中 Caspase-9、Caspase-3是介导细胞凋亡的关键因子.Caspase-9 是内源性凋亡通路的关键酶,Caspase-3是死亡因子,可激活凋亡信号的传递,是最为关键的凋亡执行者,其过表达可加速细胞凋亡进程[22].当Caspase-9 被启动后,Caspase-3 表达增加,可通过裂解蛋白激酶及细胞骨架而导致细胞凋亡.程婷婷等[23]研究发现地参多糖通过下调Caspase-3、Caspase-9基因表达而发挥对非小细胞肺癌 A549 细胞的凋亡作用.本文研究发现:ASTs 使Caspase-3、Caspase-9水平显著下降,减少细胞凋亡.
综上所述,本文结果提示:ASTs 对ATO 诱导的H9c2 细胞凋亡具有保护作用,可能与调控Bcl-2/Bax、Caspase-3、Caspase-9 凋亡相关因子有关,但其抑制凋亡的更多机制有待于进一步研究.

