石墨相氮化碳光催化还原CO2研究进展
常世鑫,虞梦雪,俞迨,严翼*,王之,吕康乐
(1 中南民族大学 资源与环境学院 &资源转化与污染控制国家民委重点实验室,武汉 430074;2 杭州市质量技术监督检测院,杭州 310019)
工业革命以来,人类活动不断的增加和工业的迅速发展促使了化石燃料的大量使用,导致CO2温室气体的大量排放[1-4].伴随国家的“双碳”目标和绿色发展战略的提出,如何合理解决CO2气体造成的环境问题将影响社会和经济的可持续发展.
CO2是一种比较稳定的分子,使C=O 键断裂需要大约750 kJ‧mol-1的能量,常规的物理化学方法处理CO2较困难.但是分子中的O 周围存在孤对电子,可以为路易斯酸中心提供电子,而其中C 可以接受来自路易斯碱中心的电子[5];此外,CO2可以吸附在绝大多数催化剂材料表面上,这为催化还原CO2分子提供可能性[5-6].受光激发的半导体材料可以诱导CO2转化为高价值的碳氢燃料产物,在缓解温室效应的同时,还生产了高附加值工业化学品.因此,CO2的光催化还原具有节能和环保的优点,符合可持续发展的理念[7-8].
随着研究的不断深入,高活性CO2还原的半导体光催化材料的开发也从初始的TiO2逐渐拓展到硫化物、金属氧化物和非金属氮碳化物等[9-10],这些催化剂的光吸收范围从紫外光逐渐向可见光拓展,CO2还原产物日渐丰富,从C1 产物(如CO、CH4、CH3OH 和HCOOH)过渡到C2 产物(如C2H5OH等)[5-6].在这些半导体材料中,氮化碳由于具有较好的物理化学稳定性、优异的光响应范围、合适的带隙结构、便捷的制备方式和易于改性等优点而受到广泛关注[3-4,7].同时,由于氮化碳的能带结构满足光催化CO2还原的热力学条件,被迅速应用于CO2还原领域.但是,体相氮化碳仍然存在可见光吸收范围窄、载流子复合率高和比表面积小等缺点.针对这些问题,近年来研究人员致力于对氮化碳进行改性从而提升其光催化性能,特别是CO2还原产物的选择性,以产生更高价值的多碳产物.
基于以上研究结果,本文主要针对氮化碳改性调节CO2还原产物的选择性进行总结,分别从缺陷调控、元素掺杂和构建异质结三个角度进行详细阐述,重点探讨了改性方法对于氮化碳光吸收、光电特性及还原产物选择性的影响,最后对氮化碳光催化材料未来发展提出展望.
1 氮化碳的结构和性质
氮化碳是一种热门的聚合型材料,拥有着较高的化学稳定性和热稳定性,耐酸碱腐蚀,最高可在700 ℃下保持热稳定性[4,11].氮化碳前驱体在高温环境中,可以一步一步缩合成环状结构,这种环状结构的雏形最早由BERZELIUS 发现,并在1834 年由LIEBIG命名为“melon”[11-14].这种雏形材料继续进行缩合最终可得到两种氮化碳的主要结构——三嗪环(C3N3)[图1(a)]和七嗪环(C6N7)[图1(b)].这两种聚合型的结构由于缩合不完全,使少量杂质氢在结构边缘上产生伯胺基团或者仲胺基团,产生大量无序的体相缺陷.这些体相缺陷的存在,不利于光生载流子的快速迁移扩散,而成为了载流子复合中心,抑制光催化活性.所以,需要对氮化碳进行结构修饰与改性,提升其光催化性能[11,15-16].

图1 氮化碳结构、性质和制备方法Fig.1 Structure,properties and preparation method of carbon nitride
氮化碳是一种典型的N 型半导体材料,其能带结构如图1(c)所示,带隙约为2.7 eV,它的导带电位比大多数的CO2还原产物的电位更负,理论上可以生成诸多的还原产物.但在实际应用过程中,受到热力学和动力学因素的限制,氮化碳光催化CO2还原产物主要为CO 和CH4[8].在CO2还原反应过程中,氮化碳价带上的空穴分解H2O为导带产物的生成提供H+[16];而导带上的电子还原CO2时,生成CH4比生成相同量的CO 需要更多的电子和H+[公式(1)和公式(2)],所以生成CH4受到动力学因素的影响程度更大.此外,氮化碳材料的导带电位也满足生成H2的条件,这也制约了氮化碳还原CO2生成CH4[16-17].
氮化碳可以通过尿素、氰胺、双氰胺、三聚氰胺、硫脲等前驱体[图1(d)]通过热聚合(包括水热合成法、模板法、熔融盐法等)得到,方法便捷、易于批量制备[12-13,18-20].其中,氰胺热缩合生成双氰胺,再由双氰胺热缩合生成三聚氰胺,最后通过三聚氰胺的逐渐缩合制备出氮化碳,这种途径被公认为是产生相对较少缺陷的聚合物的一种高效方法[4,11].但是制备出的氮化碳存在较多缺陷,为了改善氮化碳缺陷多和载流子易复合的问题以提高光催化剂的活性和调节产物的选择性,可以从制备方式出发,通过缺陷调控、元素掺杂或修饰改性、构造异质结等途径实现氮化碳的高效应用和产物选择性的调控[21-23].对氮化碳进行改性处理后的CO2还原产物及选择性的结果详见表1.

表1 氮化碳改性策略与光催化还原CO2性能Tab.1 Modification strategies and photocatalytic CO2 reduction performances of carbon nitride
2 改性氮化碳调控CO2光催化还原选择性
CO2的光催化还原,要经历多电子逐步还原的反应过程.CO2在氮化碳表面的光催化还原产物主要有C1产物和C2产物,而生成更长链的多碳产物至今仍然面临着很大的挑战[5].C1产物的生成过程,首先是H+与电子转移到CO2表面,生成羧基中间体(COOH*),然后进一步生成CO、CH4等产物[6].CO 由C=O*或C≡O*生成,而其他C1还原产物如HCHO、CH3OH 和CH4的生成途径则由中间体CO*经过一系列反应生成[5].其中CH4的生成方式有两种:一种通过CO*加氢生成CH3O*,再转化成CH4和H2O;另一种由CO*生成COH*,然后脱水形成C*,最后逐步加氢生成CH4[5-6,50].C2产物由生成的CO*加氢生成*CHO,然后碳碳键偶联产生COCHO*,继而生成乙醇和乙醛等产物[5,24,39].改性后的氮化碳因为性能发生改变会导致CO2还原过程中热力学性能和动力学性能发生改变,使得生成的中间体的种类和相应的生成速率发生变化,最终影响到产物的选择性[5,16].基于氮化碳的改性方式进行分类,本文将从多种氮化碳的改性方法对于产物选择性影响角度进行详细阐述.
2.1 缺陷调控
由于石墨相氮化碳的热聚合不完全,导致大量无序体相缺陷的生成,这些缺陷很容易成为光生载流子的复合中心,抑制石墨相氮化碳的光催化活性.但是,对于结晶度比较好在石墨相氮化碳,可以通过特定缺陷(如碳缺陷位点和氮缺陷位点)的引入来调控其半导体能带结构和表面化学环境,增强光吸收和载流子分离效率,实现CO2还原的活性的增强和产物选择性的调控[1-2].氮空位的引入可以增强CO2的吸附性能,同时可以作为陷阱诱捕光生电子,通过延长载流子的寿命和抑制载流子复合,来提升石墨相氮化碳的光催化还原CO2性能[17].此外,捕获电子后的氮空位由于周围电子分布的改变更有利于CO2吸附和活化[17].通过制备出的三聚氰胺-三聚氰酸超分子进行自组装制备出氮化碳(表1序号1),将氮化碳置于550 ℃下,使用氩气和氢气的混合气体氛围进行氢热处理制备出有氮空位缺陷的管状氮化碳[17].通过原位红外测试[图2(a)]可知:在反应过程中的产生了大量生成CO 的中间体——CH3O*、HCOO-和COOH*,并未发现大量生成CH4中间体,使CO2还原更倾向于生成CO.

图2 N缺陷氮化碳CO2还原选择性影响机理图Fig.2 Schematic diagram of selectivity reduction of CO2 over carbon nitride with N defect
除了改变煅烧热处理的气体氛围可以制造氮空位,利用甲酸辅助刻蚀也可以产生氮空位缺陷.杨朋举教授课题组[22]用三聚氰胺作为前驱体煅烧出氮化碳,利用氩气将甲酸带入管式炉对氮化碳进行热处理从而产生氮空位.通过表征发现氮空位主要集中在氮化碳的表面,形成氮空位后也极大地提高了CO 的产率,CO 选择性大约在85%(表1 序号2).通过吉布斯自由能的理论计算[图2(b)]可以发现:这种方式引入的氮空位降低了生成COOH*的活化能,使得产物中CO的选择性更高.
氮空位的形成会影响材料能带结构,带隙的位置可以受到氮空位的电子密度的影响[16,51].张金龙教授课题组[16]报道三聚氰胺在空气氛围下通过改变温度进行高温煅烧可以制备出氮空位的氮化碳.根据CO2还原的活性测试结果发现:随着催化剂煅烧温度的提高,CH4的选择性大幅提高,750 ℃煅烧出来的氮化碳CH4的选择性最大并且达到96.4%(表1 序号4).通过能带分析发现:随着煅烧温度的提高,间隙态的生成位置逐渐降低[图2(c)],在650 ℃以上的温度进行煅烧,间隙态的位置会低于产生CO 的电位.间隙态的产生会使得电子在激发后率先集中在其附近,更有利于从热力学方面产生CH4.此外,利用Pt4+在催化剂表面光沉积来研究氮化碳的光生电子的迁移途径发现:光生电子倾向于迁移并聚集在催化剂的边缘,导致边缘的氮缺陷处的电子密度更高,在动力学上对产生CH4更有利.在热力学和动力学双重优势下,还原产物体现出更高的CH4选择性.
用传统方式热缩合得到的氮化碳基本为非晶态或半晶态的状态.在结晶氮化碳表面引入缺陷也是一种提升性能的方法.文献[24]通过加入氨基-2-丙醇(AP)和双氰胺制备氮化碳提高了单体的结晶度和聚合物的聚合度,获得了结晶氮化碳(图3).从样品的高分辨率透射电镜[图3(b)]照片,可以观察到明显的缺陷区域和有序的晶格条纹,反映出其缺陷氮化碳较高的结晶性能.这种结构可以促进CO2向油类化合物的转化,通过对反应过程分析[图3(c)]可知:这种结构使得CO2逐步生成C2产物的中间体——CO*和CHO*,CO*和CHO*更容易自发偶联生成C2产物中间体OCCHO*,抑制CHO*进行质子化的过程,故最终生成产物以CH3CHO为主,并且选择性高达98.3%(表1 序号5).从理论上讲,相比将CO2还原生成C1产物,还原生成C2产物具有更高的能量密度和更大的商业价值[52].

图3 局部结晶氮化碳的结构与CO2还原反应机理Fig.3 Morphology of locally crystalline carbon nitride and CO2 reduction reaction mechanism
2.2 元素掺杂
元素掺杂改性也是一种常用的改性手段.金属或者非金属掺杂剂的原子轨道与催化剂本身的分子轨道发生杂化,能够起到改变反应的活性位点、调节能带结构和电子分布结构等作用,进而通过影响催化剂的性能来改变产物的选择性[5-6].
在氮化碳还原CO2过程中,电子从氮原子上激发并向碳原子上迁移,但是光激发后电子更加倾向于分布在氮附近,尤其是分布在双配位氮的附近[图4(a)],这使电子的迁移更加困难,导致在催化过程中载流子复合率高和反应动力更低[16,27].刘敏教授课题组[27]建立了硼掺杂氮化碳的模型,根据模型[图4(b)]可知:硼原子已成功掺杂在相邻的七嗪环之间,并且与七嗪环的氮原子形成了良好的亲和力.通过计算发现在硼掺杂氮化碳后,激发后的电子从N(2Px,2Py)向B(2Px,2Py)上转移更加容易,可以极大地增加反应的动力,更有利于CH4的产生.他们用硼酸和尿素混合进行一步煅烧实验生成硼掺杂氮化碳,硼作为主要的活性位点可以改变对CO2还原中间体的吸附,使得产物更容易生成CH4,所以相比纯氮化碳,生成CH4的选择性得到了提高.
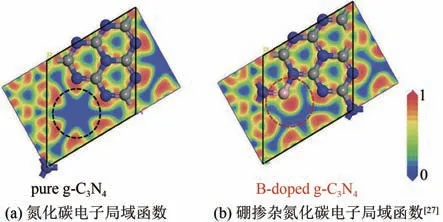
图4 B掺杂氮化碳DFT计算Fig.4 DFT calculation about B doped carbon nitride
相比硼掺杂,硫掺杂对氮化碳的性能改变有着不同影响.文献[26]通过水热和程序升温的方法制备出介孔硫掺杂氮化碳,更多的介孔形成和硫的掺杂增大了比表面积,并增强了对CO2的吸附能力[图5(a)],这有利于CO2的活化并进行还原反应.在能带结构中,由于硫参与轨道杂化并且作为主要的活性位点,载流子的分离效率得到提高,反应的活性也得到增强.在生成产物的过程中,相比纯氮化碳,硫掺杂改性的氮化碳使生成的CO 产物更容易脱附[图5(b)],因此生成CO的选择性显著提高.

图5 S掺杂氮化碳的CO2吸附等温线和CO-TPD光谱Fig.5 CO2 adsorption isotherms and CO-TPD spectra of S-oping carbon nitride
2.3 表面等离子体效应
金属纳米粒子的负载可以增强光吸收和促进载流子分离,从而提高光催化活性的效果.在氮化碳上掺入金属纳米粒子后,不仅可以作为活性位点和形成促进载流子分离的肖特基结构显著提升性能,而且还会由于金属纳米粒子的局部表面等离子共振效应(LSPR)进一步拓展催化剂的光吸收范围[7,53-54].负载Au 纳米粒子的氮化碳就是一个不错的例子,可以通过LSPR 效应一定程度上提高CH4的选择性.KAIMIN S 教授课题组[28]利用NaBH4还原法所制备的负载Au纳米粒子的氮化碳,不仅有效地抑制了载流子复合,还通过LSPR 效应促进了更多热电子产生和增强了在可见光范围下的光吸收能力,大幅提高了CO2还原的活性,尤其是为CH4的形成提供了更多活性电子促进其生成.向全军教授课题组[29]用N2等离子体处理浸渍在HAuCl4中的氮化碳制备催化剂,这种Au纳米粒子负载氮化碳也能通过Au纳米粒子的LSPR效应显著提高CH4的选择性.
此外,金属纳米粒子作为活性位点也可以降低反应能垒.董帆教授课题组[30]使用碳点(CDs)作为基质,将Bi 纳米粒子锚定在氮化碳上并与其进行桥接制备出CNB-2,Bi 通过LSPR 效应增强了氮化碳光吸收的能力和产生了更多热电子,热电子产生后可自发注入氮化碳中,为CO2还原提供更多热电子[图6(b)];而作为基质的CDs 可以作为光生空穴的受体,在内建电场的作用下Bi 和氮化碳所产生的空穴可以转移到CDs 上,有利于光生电荷的分离并为CO2还原提供更多的还原动力.通过吉布斯自由能可以得出,Bi 纳米粒子的掺入明显降低生成CO 途径的中间产物的活化能,为生成CO 提供更多热力学条件,最终生成CO 的选择性得到了提高.

图6 金属纳米离子改性氮化碳CO2还原反应机理图Fig.6 Scheme diagram of metal nanoions modified carbon nitride CO2 reduction reaction
2.4 单原子催化
将金属由纳米级尺寸制备成更小的单原子尺寸,会引起原子自身特性发生更为显著的改变.通过金属单原子对氮化碳改性,一方面暴露出更多的单原子位点,影响吸附中心和反应位点;另一方面单原子通过改变电子结构对反应过程进行调整,拥有了更加出色的催化性能表现[54-56].金属单原子改性是一种充满挑战又极大提高催化剂性能的方法,有不少有关通过单金属单原子对氮化碳改性提升性能的报道.熊宇杰教授课题组[33]通过在氮化碳上分别负载Pt 单原子(Pt@Def-CN)和Pt 纳米粒子,进行CO2还原实验中,相比未负载金属的氮化碳,它们的反应活性和CH4的选择性显著提高,其中Pt@Def-CN对于CH4的选择性提升更高,达到了99%(表1序号15),由于单原子独特的性质对选择性造成了影响.一方面,因为H 原子与Pt 单原子之间结合相对不稳定,Pt 单原子附近存在更多—OH 基团,抑制了H2产生,为生成CH4提供更多H+;另一方面,Pt 单原子有效地降低了反应过程中生成CH4的活化能能垒[图7(a)],同时又增加了CO*中间产物的解析能,提高了CH4的选择性.向全军教授课题组[35]制备出掺入Cu 单原子的高结晶氮化碳,Cu 单原子的加入可作为CO2活化的活性中心,提高了对CO2的吸附能力,增强了反应活性.此外,Cu 单原子的加入使得生成CO 的反应过程优先于生成CH4的反应过程[图7(b)],极大地提高了CO的选择性.

图7 单原子金属改性氮化碳CO2还原反应机理图Fig.7 CO2 reduction reaction scheme diagram of monometallic metal modified carbon nitride

图8 氮化碳异质结CO2还原选择性机理图Fig.8 CO2 reduction reaction scheme diagram of carbon nitride with heterojunction
双金属单原子通过协同作用能提高CO2还原性能.李亚栋教授课题组[37]合成出含有Co 和Mn 双金属单原子的氮化碳来进行CO2还原.在还原过程中,光生空穴更倾向于移动到Mn 单原子上作为活性位点加速H2O 分解,提供H+;而光生电子更倾向于移动到Co 单原子上,通过增加CO2的键长和键角将CO2活化,最终生成CO.这种双金属单原子的协同作用使CO 的选择性基本上达到100%(表1 序号21).侯军刚教授课题组[39]将Cu 和In 单原子分散在氮化碳上,双金属单原子的引入改变了催化剂的电子结构[图7(c)].在Cu单原子附近有明显的电荷富集的迹象,而在In 单原子附近有明显的电荷消耗的迹象,它们之间的协同作用促进了电荷转移和电荷分离.此外,双金属的作用增强了对中间体CO*的吸附并降低了C—C 偶联的活化能,促使了偶联生成乙醇.
金属单原子和金属纳米粒子同时引入氮化碳上能够协同发挥作用,调整CO2还原的选择性.郑旭升教授课题组[40]通过在氮化碳上引入Pd 单金属(Pd1)和Pd 纳米粒子(PdNPs)作为双活性位点,改善了氮化碳的光催化性能.相比只引入Pd1,双金属单原子引入后的协同作用使得CH4的选择性有了显著提高[图7(d)].PdNPs的加入促进H2O 分解并且加快H+转移到Pd1;而Pd1则更有利于吸附中间体CO*,加快质子化过程,生成CH4.此外,PdNPs和Pd1的协同作用也降低了从CO*到生成CHO*的活化能能垒,显著提高了生成CH4的选择性.
金属单原子与非金属之间也能够产生协同作用,提高氮化碳的性能,影响产物的选择性.毛俊杰教授[41]课题组报道了通过将P 和Cu 作为双活性位点锚定在氮化碳上,在CO2还原过程中生成高选择性的C2H6产物.首先,P 和Cu 修饰对氮化碳的带隙起到一定调整作用,在一定程度上更有利于电子空穴的光激发分离.其次,P 和Cu 作为电子和空穴的捕获位点,可以促进Cu 对电子的富集从而实现CO2还原的多电子过程.最后,P 和Cu 的修饰降低了中间生成C2H6的反应途径的活化能,CO*和CO*更容易发生偶联,形成中间体OCCO*,逐步加H 最终生成C2H6产物.
2.5 异质结构建
不同于单一的材料,将复合材料制成异质结更有利于提高催化剂的性能.由于异质结界面在空间结构上彼此分离,光生电子和空穴的复合会更容易被抑制,从而改变生成产物的选择性[7,21,57].Ⅱ型异质结在CO2还原的相关文献中经常被报道,汪铁林教授课题组[42]在NiAl 层状双金属氢氧化物(NiAl-LDHs)和氮化碳中引入还原氧化石墨烯(rGO)辅助制备成Ⅱ型半导体,由于rGO 拥有优异的导电子能力,能进一步促进载流子分离,使氮化碳上光生电子更迅速分离并转移到NiAl-LDHs 的Ni 原子上,导致生成CO的选择性大大提高.Ⅱ型异质结虽然可以极大地促进载流子分离,但会使催化剂的价带或导带的电位降低[12,21].
Z 型异质结概念受到植物光合作用的机理启发提出.相比Ⅱ型异质结,Z 型异质结保持了更正的价带和更负的导带电位,因此复合材料拥有更强的光催化氧化/还原性能[21,57-58],常应用于光催化领域.文献[46]报道利用静电自组装和低温共沉积法将ZnO和氮化碳锚定在石墨烯气凝胶上制备出间接接触Z型异质结结构,这种异质结结构的构建不仅使电子空穴更有效地空间分离,在CO2还原产物中CO 的选择性更高.有国外课题组[47]制备出氮化碳和FeWO4复合的直接接触Z型异质结.同样地,这种异质结也极大地抑制了载流子分离和提高了氧化电位,使产物中H+更倾向于生成H2,抑制了CH4的产生,故CO2还原的产物中没有CH4和其他烃类产物产生.
3 总结与展望
光催化技术可以利用太阳能来驱动温室气体CO2的催化还原,制备具有高附加值的碳氢燃料,因此该技术具有节能和环保的优点.在所有的半导体光催化材料中,石墨相氮化碳因为具有可见光响应和能带结构合理等优点,而成为受欢迎的CO2还原光催化材料.但是,其依然存在缺陷多、比表面积小和光生载流子易复合等缺点,在一定程度上制约了该技术的实际应用.因此,科学家们采用各种策略对石墨相氮化碳进行修饰改性,以进一步提升其光催化还原CO2的性能.本文总结了目前石墨相氮化碳用于CO2还原方面的5 种改性方式,分别是缺陷调控、元素掺杂、等离子体效应、单原子修饰和异质结构建.对石墨相氮化碳的结构修饰,改变了催化剂表面的化学环境,进而对CO2光催化还原路径产生和产物还原选择性产生深远影响.为了实现CO2在氮化碳表面的高效光催化还原,在今后的研究中以下工作值得进一步深入研究.
(1)开展基于结晶石墨相氮化碳的修饰改性研究.相对于普通氮化碳,结晶氮化碳的体内和表面缺陷大幅度减少,而表现出高效载流子分离效率和光催化性能.但是石墨相氮化碳依然属于有机半导体材料,其表面缺乏过渡金属作为CO2分子的吸附和活化中心.因此,需要开展基于结晶氮化碳的表面改性特别是过渡金属表面修饰研究.
(2)开展修饰组分之间的协同作用机制研究.从CO2在石墨相氮化碳表面的吸附开始,到吸附产物如CH4/CO 的脱附,中间需要经历很多关键步骤.因此,深入研究各修饰组分之间的接力还原CO2机制,对深刻理解CO2还原的活性中心结构和指导高效光催化还原CO2材料的开发具有重要意义.
(3)开展CO2光催化还原的原位瞬态谱学研究.CO2分子在光催化还原过程中,存在中间产物结构复杂且寿命短的难题,不利于开展CO2的石墨相氮化碳光催化还原过程机理研究.目前原位红外光谱(DRIFTs)技术已广泛用于CO2的光催化还原中间产物的结构鉴定.但是很多中间产物存在浓度低和寿命短的问题,相关信息难以被普通的原位红外光谱所俘获.因此,需要开展CO2光还原的瞬态谱学研究,结合光催化反应动力学和理论计算,解析光催化还原过程机理,最终为高活性和高选择性石墨相氮化碳的CO2光催化还原材料的开发提供指导.
(4)开展具有高能量密度的长链碳氢燃料的生成机制研究.目前,CO2在石墨相氮化碳表面的光催化还原产物,主要集中在C1产物如CH4和CO.这两种气体物质的能量密度低,不利于运输和保存.因此,提高大能量密度的长链碳氢燃料(如C2甚至于C3产物)的选择性,意义重大,但是面临巨大挑战.

