花楸原花青素保存条件优化及其抗氧化性研究
高思琦,吴越,沈雪,赵福阳,李嘉沂,藏小丹*
牡丹江医学院 公共卫生学院(牡丹江 157011)
黑果腺肋花楸,又名黑色石楠、不老莓、野樱莓,是一种落叶丛状灌木,属于蔷薇科涩石楠属,原产于北美大湖区东北部到阿帕拉契山脉上部山地沼泽之间[1]。其果实富含多酚和花青素,是生产功能性食品的理想原料之一[2]。该植物因其促进健康的特性而备受欢迎,其果实提取物有助于治疗多种疾病,如癌症、糖尿病和心脑血管疾病等。因此提取自黑果腺肋花楸的物质被广泛应用于欧美地区的医药和食品工业。1990年代起,我国开始引进黑果腺肋花楸,用于食品加工与有效成分的保健品研发,使其具有很高的药用保健价值[2]。2018年,国家卫生健康委员会公告将黑果腺肋花楸作为新食品原料。因花青素具有强大的抗氧化特性,可带来各种健康益处,因此被列为许多慢性疾病的保护剂[3]。且与已有原料提取花青素的组成相比,黑果腺肋花楸花青素提取物种花色苷种类比较单一,均属矢车菊家族花色苷,更有利于分离出单体[4]。然而,随着时间、温度等变化,黑果腺肋花楸原花青素保存率将会降低,因此,如何在不同环境下最大程度地保持黑果腺肋花楸原花青素的稳定性和抗氧化性成为一个不可避免的问题。
1 材料与设备
1.1 材料与试剂
黑果腺肋花楸干(通化市谭小六商贸有限责任公司);蓝莓干(伊春市鑫旺山特产品开发有限公司);抗坏血酸(天津市致远化学试剂有限公司);花青素标准品(合肥千盛生物科技有限公司);香草醛(天津市光复科技发展有限公司);1, 1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picryl-hydrazyl,DPPH):上海麦克林生化科技有限公司;过氧化氢溶液(天津市大茂化学试剂厂);无水乙醇(哈尔滨市化工试剂厂);三氯乙酸、三氯化铁、氯化钠(天津市登峰化学试剂厂);水杨酸、甲醇、氢氧化钠、盐酸、硫酸亚铁(天津市恒兴化学化学试剂制造有限公司);铁氰化钾、磷酸二氢钠(天津市东丽区天大化学试剂厂)。
1.2 仪器与设备
KQ5200DE超声清洗仪(昆山市超声仪器公司);SN-TDL-40D离心机(上海尚仪精密仪器有限公司);LX-FA2004电子天平(上海力辰仪器科技有限公司);723N分光光度计(上海精密仪器有限公司);LC-WB-6恒温水浴锅(上海力辰仪器科技有限公司);BCD-254冰箱(博西家用电器有限公司)。
2 方法
2.1 花青素的提取与测定
2.1.1 提取
参考Teng等[5]和Taghavi等[6]的方法并根据实际操作改进。在三角烧瓶中准确称取10 g的黑果腺肋花楸和蓝莓干粉,加入1%的HCl酸化的70%乙醇,并在避光条件下恒温于超声微波协同萃取仪中按照超声时间40 min、超声功率300 W、乙醇体积分数50%、料液比1∶30(g/mL)进行提取。待提取液按4 000 r/min离心15 min后,收集上清液,使用酸性乙醇将其定容至50 mL,即可得到提取液。
2.1.2 测定
采用张欣[7]的方法。精密称取50 mg原花青素标准品,用甲醇定容至50 mL棕色容量瓶中,超声30 s,得到1 mg/mL的原花青素母液。使用移液枪分别准确吸取0,1.2,2.4,3.6,4.8和6.0 mL的母液定容至10 mL棕色容量瓶中,稀释10倍后得到质量浓度为0.1 mg/mL的标准品稀释液。接着,分别移取10倍稀释后的各浓度标准品稀释液进行百倍稀释。最后,将分别移取1 mL 100倍稀释后的各浓度标准溶液加入到10 mL棕色离心管中,加入2.5 mL 1%香草醛-甲醇溶液和2.5 mL 8%盐酸-甲醇溶液,避光后在恒温水浴器中加热1 h,使用分光光度计在波长550 nm处测定吸光度。以浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2.2 单因素试验
2.2.1 花青素保存率的计算
参考吴春燕等[8]的方法并做调整。根据处理前后花青素溶液的吸光度差异计算不同条件下花青素保存率,按式(1)计算。
式中:Aλmax为最大吸光度;A0为初始吸光度。
2.2.2 pH对黑果腺肋花楸花青素稳定性的影响
分别以0.2 mol/L HCl溶液和0.2 mol/L NaOH溶液将黑果腺肋花楸花青素溶液的pH调节至3,5,7,9和11,于4 ℃避光静置。反应1 h后,在550 nm波长处平行测定3次,取吸光度的平均值。
2.2.3 储存温度对黑果腺肋花楸花青素稳定性的影响
为探究黑果腺肋花楸原花青素的最佳保存温度,将溶液置于避光环境中,并在4,20,40,60和80 ℃的恒温水浴中保存。反应1 h后,在550 nm波长下进行3次平行测定,取其吸光度的平均值。
2.2.4 自然光照时间对黑果腺肋花楸花青素稳定性的影响
将黑果腺肋花楸原花青素溶液置于室温下,自然光照射1,2,3,24和48 h后取样,在550 nm波长处平行测定3次,取其吸光度的平均值。
2.2.5 恒温保存时间对黑果腺肋花楸花青素稳定性的影响
将黑果腺肋花楸原花青素溶液置于水浴中恒温于40 ℃避光保存反应10,20,30,40,50和60 min后在550 nm波长处平行测定3次,取其吸光度的平均值。
2.2.6 空气暴露时间对黑果腺肋花楸花青素稳定性的影响
将花青素置于培养皿中,室温避光保存10,30,60和120 min后取样,在550 nm波长处平行测定3次,取其吸光度的平均值。
2.3 响应面试验
选用黑果腺肋花楸原花青素保存率为响应值,温度、恒温保存时间、自然光照时间为响应变量。应用响应面优化黑果腺肋花楸中原花青素的保存条件。试验考察水平及因素见表1。

表1 响应面考察因素与水平
2.4 抗氧化试验
2.4.1 DPPH自由基清除能力
参考叶晓楠等[9]的方法并稍加改动。使用蒸馏水分别配制质量浓度为0.25,0.5,0.75,1.0,2.0,3.0和4.0 mg/mL的黑果腺肋花楸和蓝莓提取物样品,以及VC溶液。从不同浓度样品和VC溶液中各取1 mL,加入1 mL浓度为0.2 mmol/L的DPPH乙醇溶液,反应完全后避光,在波长为517 nm处测定混合物的吸光度。DPPH清除率按式(2)计算。
式中:A0为空白对照;A1为样品溶液吸收光度;A2为无水乙醇与样品溶液吸收光度。
2.5 OH-清除能力
采用孙燕等[4]和赵彦巧等[10]的方法并稍加改动。用蒸馏水分别配制质量浓度为0.25,0.5,0.75,1.0,2.0,3.0和4.0 mg/mL的黑果腺肋花楸、蓝莓提取物样品和VC溶液。在反应体系中依次加入0.2 mL 6 mmol/L的FeSO4溶液和水杨酸-乙醇溶液,再加入0.4 mL不同质量浓度的样品溶液、0.4 mL VC溶液和1.2 mL 6 mmol/L的双氧水溶液,于37 ℃反应1 h,反应完全后在波长510 nm处测定混合物的吸光度。羟自由基清除率按式(3)计算。
式中:A0为空白对照的吸光度;A1为加样品的吸光度;A2为无显色剂H2O2的吸光度。
2.5.1 Fe3+还原力测定
参考张欣[7]的方法并做调整。制备质量浓度为0.25,0.5,0.75,1.0,2.0,3.0和4.0 mg/mL的黑果腺肋花楸、蓝莓提取物和VC溶液。从不同浓度的样品溶液和VC溶液中各取0.8 mL,加入pH 6.6的磷酸盐缓冲液和1%铁氰化钾溶液各2.0 mL,在50 ℃条件下反应20 min,冷却,加入2.0 mL 10%三氯乙酸溶液,混匀后按3 000 r/min离心5 min,取0.1 mL上清液,加入9.0 mL蒸馏水和0.9 mL 0.3% FeCl3溶液,反应完全后在波长700 nm处测定混合物的吸光度。吸光度越大,样品的还原力越大,以VC作为阳性对照。
2.6 数据处理
所有试验均进行3次重复,使用SPSS Statistics 27进行单因素分析,使用Graphpad Prism 2022和Design-Expert 13软件对数据进行作图和分析。
3 结果与分析
3.1 原花青素含量的测定
3.1.1 原花青素标准曲线
标准曲线回归方程为Y=1.413 69X+0.005 88,R2=0.999 5,在0~0.01 mg/mL范围内具有良好的线性。标准曲线如图1所示。

图1 原花青素标准曲线
3.1.2 黑果腺肋花楸,蓝莓提取物中原花青素含量的测定
根据2.1.1、2.1.2小节所述的方法,超声微波协同处理40 min,设定超声功率300 W、乙醇体积分数50%、料液比1∶30(g/mL)提取蓝莓和花楸的原花青素。经100倍稀释的黑果腺肋花楸提取液的吸光度为0.051,经20倍稀释的蓝莓提取液的吸光度为0.042,带入标准方程可算得花楸粗提取液中原花青素含量62.242 mg/g、蓝莓粗提取液中原花青素含量12.306 4 mg/g。综上所述,花楸中原花青素的含量约为蓝莓的5倍。
3.2 单因素试验
3.2.1 pH对花楸花青素稳定性的影响
由图2可知,黑果腺肋花楸原花青素在pH 3时吸光度最大,随着pH接近7,吸光度的降低速度开始变缓,pH>9后降低速度又开始随着pH的增大而增加。且当pH<3时,黑果腺肋花楸原花青素呈现明亮的红色,pH 7时溶液为紫色近乎透明,pH 9时呈现为青色,当pH 11时溶液呈现出墨绿色。Silva等[11]用氰化物-3-氨基葡萄糖苷的标准溶液进行光谱研究,确定了颜色变化依赖于pH的平衡。β-环羟化状态和pH已经被证明介导花青素降解为其酚酸和醛成分[12]。单糖花青素在pH<2时以2-苯基苯并吡喃阳离子(AH+)的形式存在,在pH 4~5时花青素以醌型假碱(B)或查而酮(C)形式存在,此时其是无色的,pH>6时候以醇型A存在,所以原花青素在不同的pH下呈现出不同的颜色[13]。

图2 不同pH对花楸花青素稳定性的影响
3.2.2 储存温度对花楸花青素稳定性的影响
由图3可知,随着温度的上升,黑果腺肋花楸的保存率降低,60 ℃以上时,保存率变化率较大。天然色素在低温或干燥状态时,性质一般较稳定,加热或高温可加快变色反应,尤其在加热至沸点时易氧化褪色[14]。研究表明。20 ℃和40 ℃时酰化衍生物颜色保存相对稳定,褪色程度略有变化,但在60 ℃时,酰化衍生物褪色至迅速上升出现衰落[15]。在热处理过程中,花青素由于其高反应性而被降解,并且在水的存在下,键会被水解[16]。

图3 温度对原花青素保存率的影响
3.2.3 光照时间对花楸花青素稳定性的影响
如图4所示,随着光照时间的增加,黑果腺肋原花青素保存率下降,3 h时出现明显拐点,后下降速率加快。朱新贵等[16]的研究表明不同颜色的光对花青素破坏力不同,且在相同的光照强度下,蓝光对色素的破坏速度最快,红光最慢,各单色光对色素的破坏速度由大到小排序为蓝光、白光、绿光、紫光、黄光、橙光、红光。

图4 光照时间对原花青素保存率的影响
3.2.4 恒温保存时间对花楸花青素稳定性的影响
如图5所示,在40℃时,随着时间的增加,保存率总体呈下降趋势,60 min时保存率下降近20%。现有研究表明,花青素受热后降解速率加快,半衰期变短且符合热力学第一公式,随着加热温度的升高,时间的增多,花青素的降解加快[13]。

图5 恒温保存时间对原花青素保存率的影响
3.2.5 空气中暴露时间对花楸花青素稳定性的影响
如图6所示,暴露于空气中的黑果腺肋花楸原花青素在10~120 min内,随着时间的增加保存率逐渐降低,但变化较小。120 min与10 min时相比,保存率降低2.062%。

图6 空气中暴露时间对花楸花青素稳定性的影响
3.2.6 对黑果腺肋花楸原花青素的稳定性的单因素分析
对5个单因素进行单因素分析,结果如表2所示。
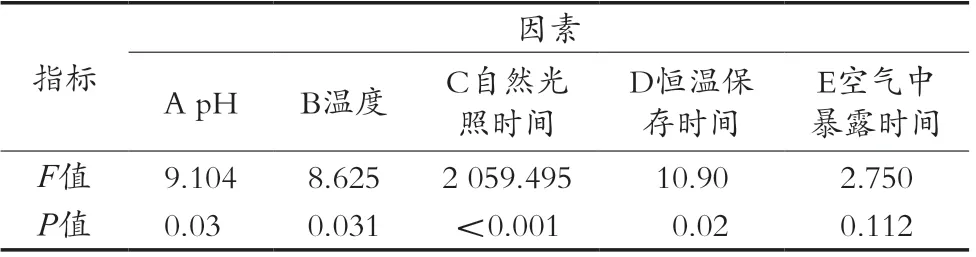
表2 单因素试验方差分析结果
由表2单因素试验方差分析结果可知,pH,温度,恒温保存时间对黑果腺肋花楸原花青素的保存率影响显著(P<0.05),自然光照时间对黑果腺肋花楸原花青素的保存率影响极其显著(P<0.01),空气中暴露时间对黑果腺肋花楸原花青素的保存率影响不显著(P>0.05),因此,选择温度、光照时间、恒温保存时间这三个关键因素进行响应面试验[17]。
3.3 响应面试验结果
3.3.1 响应面结果与分析
应用Box-Behnken建立三因素三水平的响应优化试验[18],结果见表3。

表3 Box-Behnken试验设计及结果
3.3.2 二项回归方程拟合与方差分析
根据响应面试验结果拟合回归方程:保存率=96.73+0.120 0A+0.275 0B-1.68C-1.67AB-1.88AC-2.84BC-3.49A2-1.38B2-4.03C。
方差分析结果如表4所示。回归方程模型F=9.72,P=0.011 0<0.05,说明该方程具有显著性;失拟项F=9.13,P=0.100 3>0.05,差异不显著,说明此模型准确度良好,存在误差较小,二次模型合理。在此情况下,根据方差中F值,分析各因素对保存率的影响程度并排序。3个单因素对保存率的影响程度C>B>A,即恒温保存时间>自然光照时间>温度。且一次项C对黑果腺肋原花青素的保存具有显著影响,是模型的重要参数,A和B对模型不显著:二次项A2和C2对模型均具有极具显著影响。

表4 回归方程各项的方差分析
3.3.3 因素间的交互分析
使用Design-Expert 13软件根据二次回归方程绘制响应图,结果见图7。响应面坡峰的陡峭程度,表明交互因素对结果的影响程度。另外,等高线的形状也显示交互项对黑果腺肋花楸原花青素稳定性的作用[19]。坡度越陡说明此项因素对响应面的影响越大,表明两两交互作用对黑果腺肋花楸原花青素的稳定性的影响越大[20]。

图7 因素间的交互效应分析
由图7可知,两变量交互作用对黑果腺肋花楸原花青素稳定性均有显著影响,且在一定范围内呈现出先上升后下降的趋势,其中自然光照时间和恒温保存时间的交互对原花青素稳定性有显著影响,与方差分析结果一致。
3.3.4 最佳稳定性验证
采用Design-Expert 13软件分析预测,得出黑果腺肋花楸原花青素最佳保存条件:温度4 ℃、自然光照时间149.56 min和恒温保存时间16.18 min,在此条件下预测保存率为97.16%。在最佳参数和实际情况进行适当调整后,保存温度定为4 ℃,自然光照时间定为150 min,恒温保存时间定为16 min。按照这一条件进行3次平行试验,黑果腺肋花楸原花青素的保存率分别为96.63%,96.92%和97.61%,平均值为97.05%。与预测值相比,相对误差为0.113%,t检验差异不显著(P<0.05)。因此,采用响应面法优化黑果腺肋花楸原花青素保存稳定性条件是可行的。
3.4 抗氧化性试验
3.4.1 清除DPPH自由基试验
如图8所示,在质量浓度0.25~4.00 mg/mL范围内,黑果腺肋花楸原花青素与VC清除DPPH自由基的能力存在显著性差异(P<0.05),蓝莓原花青素与VC清除DPPH自由基能力存在显著差异(P<0.05),黑果腺肋花楸原花青素与蓝莓原花青素清除DPPH自由基的能力存在显著性差异(P<0.05),且清除DPPH能力黑果腺肋花楸原花青素>蓝莓原花青素>VC,均随浓度的上升而上升。
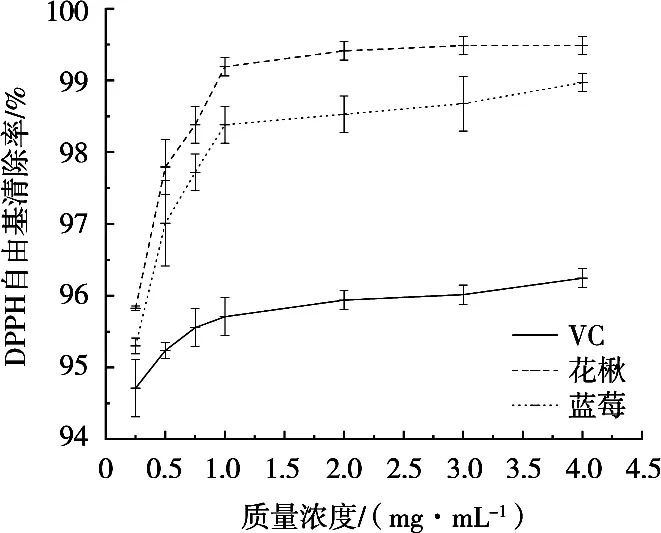
图8 DPPH自由基清除能力
3.4.2 OH-清除试验
如图9所示,在质量浓度0.25~4.00 mg/mL范围内,黑果腺肋花楸原花青素、蓝莓原花青素与VC清除DPPH自由基能力存在显著性差异(P>0.05),且均随浓度的上升而上升,质量浓度为1 mg/mL时达到拐点,后随浓度上升,清除率几乎不再变化,三者对羟自由基的清除效果相同。

图9 OH-除能力
3.4.3 Fe3+还原能力
如图10所示,在质量浓度0.25~4.00 mg/mL范围内,黑果腺肋花楸原花青素、蓝莓原花青素与VC的Fe3+还原能力均不存在显著性差异(P>0.05)。三者吸光度随浓度上升而上升,1 mg/mL后增长幅度减少并逐渐趋于稳定,且黑果腺肋花楸原花青素的Fe3+还原能力大于蓝莓原花青素和VC。

图10 Fe3+还原能力
4 结论
研究以黑果腺肋花楸果干为原材料,采用超声波辅助萃取技术提取其中的原花青素成分。通过响应面法优化保存条件,检测其中的抗氧化能力。结果表明:最佳保存条件为温度4 ℃、自然光照时间15 min、恒温保存时间16.18 min,保存率可达到97.16%(相对误差仅有0.113%)。同时,研究以VC和蓝莓做对照,对比了黑果腺肋原花青素的DPPH自由基、羟自由基清除能力和总还原力抗氧化指标。结果显示,黑果腺肋花楸原花青素在相同浓度和检测条件下,其抗氧化能力总体高于VC和蓝莓原花青素。这可以证明黑果腺肋花楸原花青素是一种优秀的抗氧化和抗衰老物质。
综合来看,此次研究为黑果腺肋花楸原花青素未来在保健品、药品、化妆品等领域的运用提供了重要的参考。

