基于Bp-MRI的PI-RADS v2.1评分构建列线图预测PSA(4-20 ng/mL)前列腺癌的诊断价值
张若弟,周云舒,刘世莉,陈晓华,王卓,张少茹,陈志强,2,3*
0 前言
前列腺癌(Prostate cancer, PCa)是男性最常见的实体恶性肿瘤,居男性癌症相关死因第二位[1]。据文献报道,至2030 年我国PCa 粗发病率为38.99/10 万,粗死亡率为10.41/10 万[2],这提示我们,PCa防控形势越发严峻。血清前列腺特异性抗原(prostate specific antigen, PSA)仍广泛用于PCa筛查、指导穿刺活检、复发风险分层、诊断后监测[3-4]。尽管PSA (4-20 ng/mL) PCa 患者穿刺比率增高,但其特异性不高[5-6]。多项研究表明,总前列腺特异性抗原(total prostate specific antigen, tPSA)在4~10 ng/mL、10~20 ng/mL 之间,PCa 检出率分别为11.8%~20.5%、20.5%~25.0%[4,7-8]。因此,如何提高PSA (4-20 ng/mL) PCa 的检出率是目前PCa 早诊、早治的重要问题。
多参数磁共振成像(multiparametric MRI,mp-MRI)的前列腺影像报告和数据系统2.1 版(Prostate Imaging Reporting and Data System version 2.1, PI-RADS v2.1)作为前列腺MRI 扫描技术规范、诊断报告书写的重要指南,已广泛应用于临床,且对PCa 的早期诊断及分期具有较高价值[9-10]。PI-RADS v2.1 也强调了双参数磁共振成像(biparametric MRI, bp-MRI)诊 断PCa 的 潜 在 价值[11-13]。多项研究表明简化的bp-MRI 方案检测临床显著性PCa(clinically significant PCa, csPCa)与标准mp-MRI 具有相似的诊断效率[14-15]。有研究发现PSA(4-10 ng/mL)的患者中,bp-MRI联合前列腺特异性抗原密度(prostate specific antigen density, PSAD)在检测csPCa 方面的性能优于mp-MRI,且具有更高的特异性[16]。有文献报道PSA 水平与PCa 患病率存在种族差异,与传统灰区PSA(4-10 ng/mL)相比,亚洲男性PSA“灰色区域”范围应高于4~10 ng/mL[17]。国内对可疑区间PSA (4-20 ng/mL)PCa 的类似研究较少[18-19]。而PSA 位于4~20 ng/mL 区间时,不典型增生、低级别瘤变的发生率较高,给予积极主动检测及相关治疗至关重要,国外并未应用bp-MRI 的PI-RADS v2.1 评分分析PSA (4-20 ng/mL)PCa的诊断效能。故本研究以PSA(4-20 ng/mL)的患者为研究对象,基于bp-MRI 的PI-RADS v2.1 评分及PSA 等临床指标构建列线图模型,为临床可疑PCa 的患者提供个体化的风险预测,并进一步提高PCa的诊断准确性。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经宁夏医科大学总医院医学伦理委员会批准,免除受试者知情同意,批准文号:2018-339。回顾性分析宁夏医科大学总医院2017年10月至2022年2月因PSA升高或有明显临床症状,如:尿痛、进行性排尿困难、肉眼血尿等行bp-MRI检查并有病理学结果的患者资料206例。纳入标准:(1)tPSA 值是4~20 ng/mL;(2)MRI 检查前未接受过相关治疗,无其他肿瘤病史;(3)一般资料、tPSA、游离前列腺特异性抗原(free prostate specific antigen, fPSA)及T2 加权成像压脂(T2-weighted imaging fat suppression, T2WI-FS)序列、扩散加权成像(diffusion-weighted imaging, DWI)等资料完整;(4)有直肠超声(transrectal ultrasound, TRUS)引导下系统性穿刺或根治术后的病理结果,且均在穿刺活检前行bp-MRI检查。排除标准:MRI图像质量差,无法准确进行PI-RADS v2.1评分。
1.2 扫描方案
所有患者在前列腺穿刺前两周内行bp-MRI检查,采用荷兰Philips 3.0 T Ingenia MR扫描仪及32通道心脏相控线圈,扫描序列包括T1WI轴位,T2WI-FS矢状位、轴位、冠状位和DWI轴位。各序列具体扫描参数见表1,DWI序列b值取0、1000、1500 s/mm2。
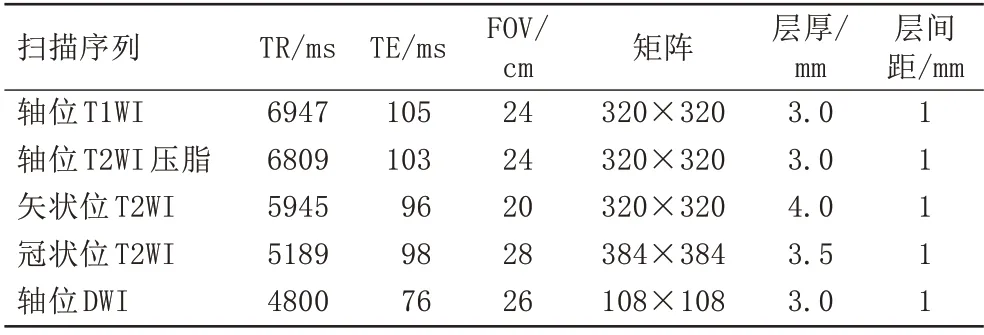
表1 前列腺bp-MRI扫描序列及参数Tab.1 The scanning sequence and parametersof prostate bp-MRI
1.3 图像分析
从我院PACS系统获取患者的bp-MRI图像,由两名分别具有3年经验的住院医师和8年腹部MRI诊断经验的影像主治医师在未知病理结果及PSA水平的情况下,严格以PI-RADS v2.1标准对bp-MRI图像评分并记录,移行带、外周带的病变主导序列分别为T2WI-FS、DWI。评分不一致者经两名医师协商后作出最终评分,两名医师PI-RADS v2.1 评分的一致性极好(Kappa值:0.869,P<0.05)。当前列腺存在多个病变时,记录最高评分。具体改良的bp-MRI评分方案见表2[11]:
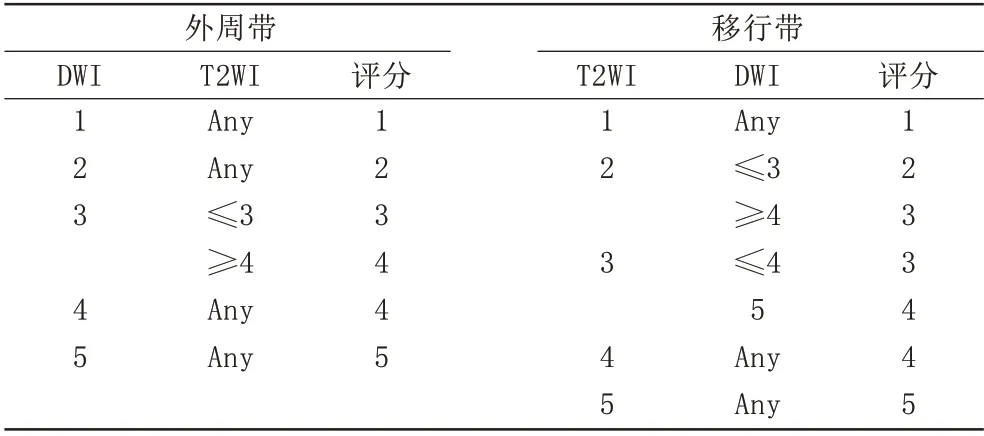
表2 综合评分Tab.2 Comprehensive score
1.4 临床指标
本研究纳入的临床及影像学指标:年龄、tPSA、fPSA、游离前列腺特异性抗原百分比(%fPSA=fPSA/tPSA)、前列腺体积(prostate volume, PV)、PSAD、游离前列腺特异性抗原百分比/前列腺特异性抗原密度(fPSA/tPSA)/PSAD、PI-RADS v2.1 评分。根据PI-RADS v2.1指南,在T2WI-FS的正中矢状面上测最大前后径及最大上下径,在轴位上测最大横径[20],计算PV,并计算相关参数。PV=前后径max×上下径max×横 径max×0.523;PSAD=tPSA/PV;(f/t)/PSAD= (fPSA/tPSA)/(tPSA/PV)=(fPSA×PV)/tPSA2。
病理标准:由一名具有8年以上穿刺经验的泌尿外科主治医师在TRUS 引导下行穿刺活检,采用10+X针穿刺法,将前列腺分为10 区,每个区穿刺1 针,再结合bp-MRI 图像,可疑病变加穿1~2 针。符合手术指征的患者行前列腺根治性切除术,由两名分别具有5 年和10 年经验的住院医和副主任病理医师记录病变的位置及Gleason评分。
1.5 统计学方法
采用SPSS 26.0 和R4.1.2 软件对数据进行分析。对计量资料进行正态性检验,符合正态分布的以(xˉ±s)表示,组间比较用Student'st检验;偏态分布以M(P25,P75)表示,组间比较用Mann-WhitneyU检验;分类变量用例数(%)表示,组间比较采用χ2检验、校正卡方或Fisher 精确概率法。采用逐步回归向后-LR 法进行多因素logistic 回归确定PSA(4-20 ng/mL) PCa独立危险因素,随后应用R软件构建列线图模型,采用Bootstrap自抽样法对该模型进行内部验证,通过一致性指数(concordance index,C-index)和校准图评价该模型的预测准确度和一致性,用决策曲线分析(decision curve analysis,DCA)其临床净效益。以受试者工作特征(receiver operating characteristic, ROC)曲 线 下 面 积(area under the curve, AUC)、敏感度和特异度评价诊断效能,并通过DeLong 检验比较AUC 值间的差异。P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料与组间比较结果
本研究最终纳入PSA(4-20 ng/mL)的患者206 例,其中PCa 组66 例(32%),良性病变组140 例(68%)。与良性组相比,PCa 组的患者年龄更大,tPSA及PSAD 值更高,PI-RADS v2.1 评分也越高。两组间年龄、tPSA、%fPSA、PV、PSAD、(f/t)/PSAD、PI-RADS v2.1差异均有统计学意义(P<0.05,表3)。
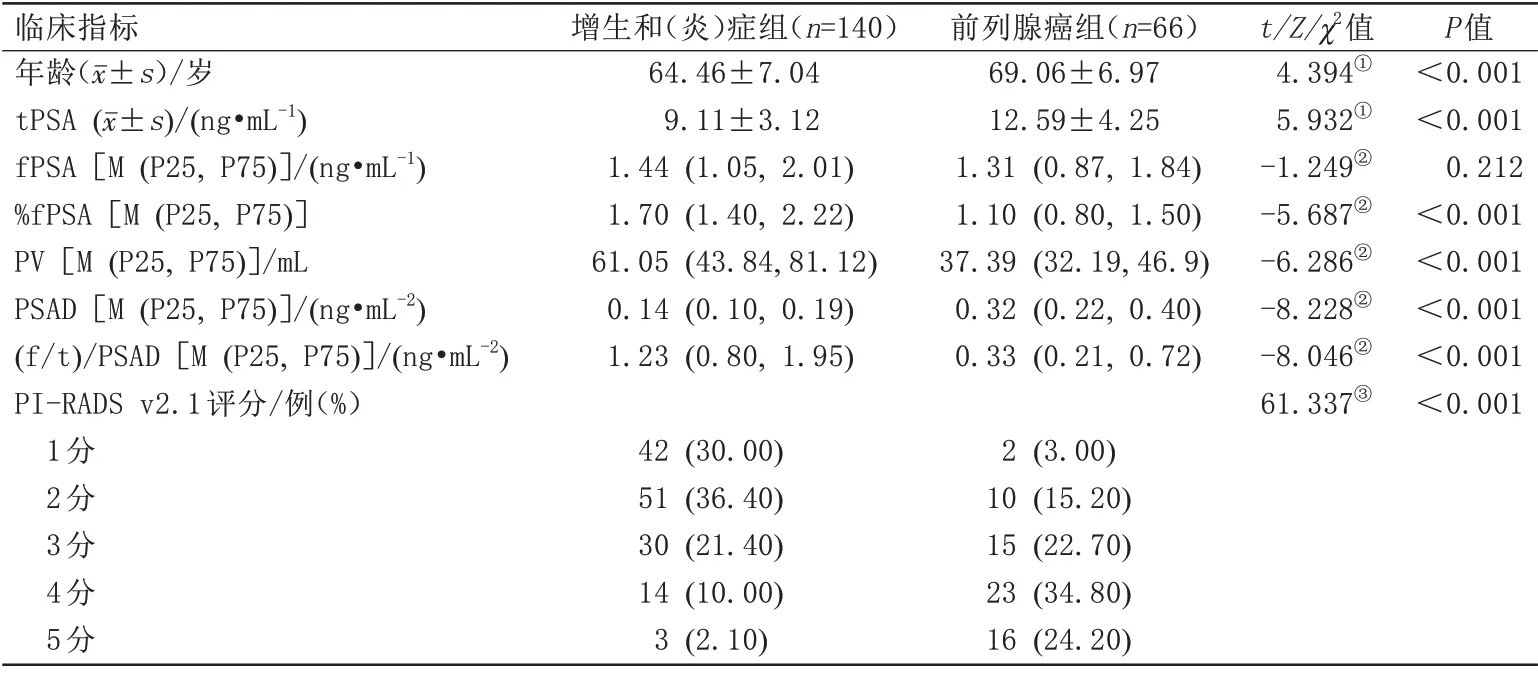
表3 206 例患者临床指标的基线分析Tab.3 Baseline analysis of clinical indexes of 206 patients
2.2 logistic回归及列线图预测模型的构建
单、多因素logistic 回归结果显示年龄、tPSA、PV、PI-RADS v2.1 是PSA (4-20 ng/mL) PCa 的独立危险因素(P<0.05;表4)。最终纳入上述4 项指标,应用R 软件构建PSA(4-20 ng/mL)罹患PCa 风险的列线图模型(图1)。

图1 预测前列腺特异性抗原4~20 ng/mL前列腺癌风险的列线图模型。tPSA:总前列腺特异性抗原;PV:前列腺体积;PI-RADS v2.1:前列腺影像报告和数据系统2.1版。图2 列线图模型的校准曲线。图3 列线图模型的决策曲线。纵轴为净获益率,横轴为概率阈值。Fig.1 A nomogram model for predicting the prostate specific antigen (4-20 ng/mL) prostate cancer risk.It is composed of age, total prostate specific antigen(tPSA), prostate volume (PV) and Prostate Imaging Reporting and Data System version 2.1 (PI-RADS v2.1).Fig.2 Calibration curve of nomogram model.Fig.3 Decision curve of the nomogram model.The vertical axis is the net benefit rate, and the horizontal axis is the probability threshold.
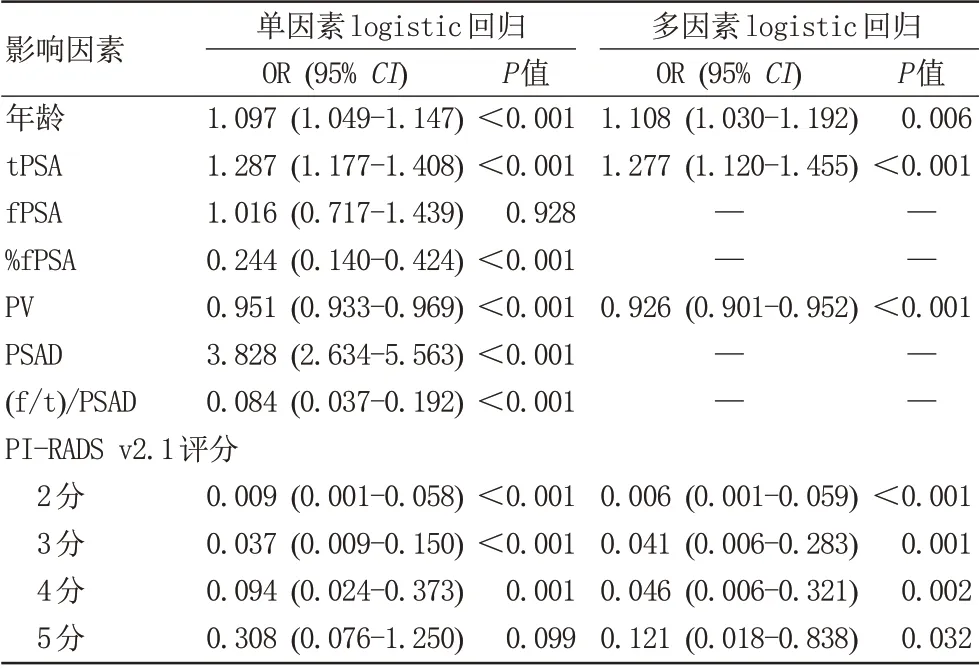
表4 各指标 logistic 回归分析结果Tab.4 Results of Logistic regression analysis of each index
采用Bootstrap 自抽样法重复抽样1000 次后进行模型的内部验证,该列线图模型的C-index 为0.945,具有良好的预测准确度。校准曲线显示列线图模型对预测PSA (4-20 ng/mL) PCa 的发生风险具有较好的一致性(图2)。DCA 表明,在较宽的概率阈值范围内,列线图模型可获得净收益(图3)。
2.3 列线图模型解读
本研究列线图模型由年龄、tPSA、PV、PI-RADS v2.1 构成。根据列线图中线段可得出各预测变量所对应的分值,各项分值相加后记为总分,其对应的预测风险值,即为罹患PCa的风险概率(图4、5)。

图4 男,69岁,前列腺癌患者。总前列腺特异性抗原为16.1 ng/mL,前列腺体积为55.71 mL。4A:轴位T2WI抑脂示右侧外周带边界清,低信号灶(箭),直径约0.9 cm;4B:轴位DWI(b 值=1000 s/mm2)示病灶呈明显高信号(箭);4C:轴位ADC 图示病灶呈明显低信号(箭),PI-RADS v2.1 评分为4 分;4D:病理结果(HE ×100)为前列腺癌(Gleason 评分4+4=8 分,WHO/ISUP 分级分组为4 组)。图5 男,70 岁,前列腺增生患者。总前列腺特异性抗原为18.8 ng/mL,前列腺体积为95.50 mL。5A:轴位T2WI示移行带多发包膜不完整的异常信号结节;5B:轴位DWI(b值=1000 s/mm2)未见明显高信号;5C:轴位ADC图未见明显低信号,PI-RADS v2.1 评分为2分;5D:病理结果(HE ×100)前列腺增生。DWI:扩散加权成像;ADC:表观扩散系数;PI-RADS v 2.1:前列腺影像报告和数据系统2.1版;WHO:世界卫生组织;ISUP:国际泌尿病理学会。Fig.4 Male, 69 years old, patient of prostate cancer.Total prostate specific antigen is 16.1 ng/mL, prostate volume is 55.71 mL.4A: T2-weighted imaging fat suppression axial with clear low-signal focus (arrow) at the periphery of the right peripheral zone, and the maximum diameter is approximately 0.9 cm; 4B: DWI (b value=1000 s/mm2) axial, the lesion shows obvious hypersignal (arrow); 4C: ADC axial, the lesion is significantly low signal (arrow), the score of PI-RADS v2.1 is 4 points; 4D: Pathological (HE ×100) shows prostate cancer (Gleason score 4+4=8, graded into 4 group).Fig.5 Male, 70 years old, patient of prostatic hyperplasia.Total prostate specific antigen is 18.8 ng/mL, prostate volume is 95.50 mL.5A: On T2-weighted imaging fat suppression axial, there are multiple abnormal signal nodules with incomplete capsule in transitional zone; 5B: DWI (b value=1000 s/mm2) axial, no significant high signal is found; 5C: ADC axial, with no significant low signal is found.PI-RADS v2.1 score is 2 points; 5D: Pathological (HE ×100) shows prostatic hyperplasia.DWI: diffusion-weighted image; ADC:apparent diffusion coefficient; PI-RADS v2.1: Prostate Imaging Report and Data System version 2.1; WHO: World Health Organization; ISUP: International Society of Urological Pathology.
2.4 评估各独立指标和列线图模型的诊断效能
列线图模型对PSA (4-20 ng/mL) PCa 的诊断效能高于PI-RADS v2.1、PV、tPSA、年龄,详见表5、图6。
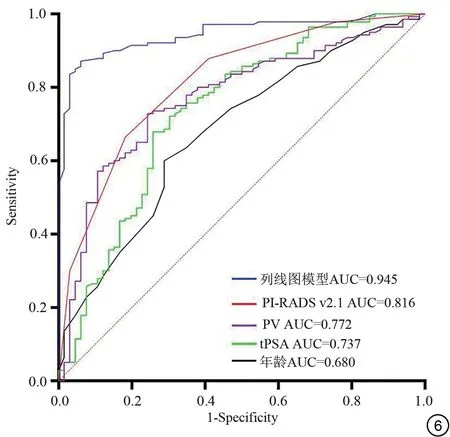
图6 列线图模型及各独立指标预测前列腺特异性抗原4~20 ng/mL前列腺癌的ROC 曲线。ROC:受试者工作特征;AUC:曲线下面积;PI-RADS v2.1:前列腺影像报告和数据系统2.1 版;PV:前列腺体积;tPSA:总前列腺特异性抗原。Fig.6 ROC curve of nomogram model and independent indicators for predicting prostate specific antigen (4-20 ng/mL) prostate cancer.ROC:receiver operating characteristic; AUC: area under the curve; PI-RADS v2.1: Prostate Imaging Report and Data System version 2.1; PV: prostate volume; tPSA: total prostate specific antigen.
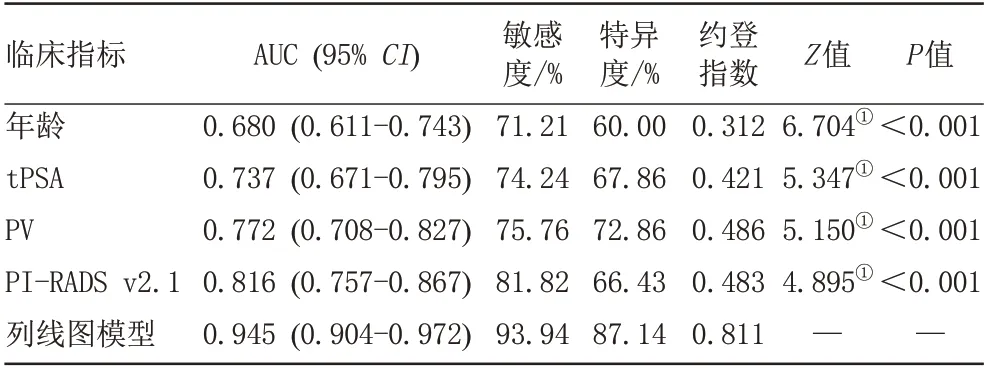
表5 列线图模型及独立指标预测PSA (4-20 ng/mL) PCa的诊断效能Tab.5 The nomogram model and independent indicators predicted the diagnostic efficacy of PSA (4-20 ng/mL) PCa
3 讨论
本研究经单、多因素logistic 回归筛选了年龄、tPSA、PV和PI-RADS v2.1共4个临床及影像学指标,构建了预测PSA (4-20 ng/mL) PCa 的列线图模型,该列线图模型(AUC:0.945,敏感度93.94%,特异度87.14%)诊断效能显著高于单独应用PI-RADS v2.1 评分及其他预测指标。结果表明基于bp-MRI 的PI-RADS v2.1联合临床指标筛查PCa诊断效能好,可行性较高,有望作为mp-MRI的潜在替代方案以优化检查。
3.1 单独使用PSA筛查PCa的局限性
PSA 是一种丝氨酸蛋白酶,主要由正常或有癌变倾向的前列腺细胞产生,PCa 会破坏血—上皮屏障,导致血清PSA 浓度明显增加,因此,它是早期筛查和检测PCa 肿瘤生物标志物,但其缺乏特异性[21-22]。本研究显示单独使用tPSA 诊断PSA (4-20 ng/mL) PCa的AUC为0.737,敏感度和特异度较低,与既往研究结果类似[3,23]。原因可能是PSA 受到了多种因素的影响,如前列腺炎、PV、尿路感染等。因此单独使用PSA筛查、诊断PCa有一定的局限性。在临床中,PSA需结合影像学及其他相关指标来积极监测患PCa 的风险及预后疗效。
3.2 bp-MRI的优势及诊断价值
bp-MRI的优势[12,24-27]包括:(1)无对比剂的相关不良反应;(2)缩短了MRI 扫描时间;(3)降低检查成本、减少经济及资源负担等。研究表明T2WI-FS与DWI组成的bp-MRI诊断PCa的准确性与标准的mp-MRI相似,且差异无统计学意义[26-28],因此使用bp-MRI 诊断PCa更简单、便捷,亦可指导前列腺活检及临床分期。TAMADA 等[29]发现基 于bp-MRI 的PI-RADS v2.1 及PSA等指标对PCa的诊断特异性显著高于mp-MRI。本研究中基于bp-MRI的PI-RADS v2.1的AUC为0.816,敏感度和特异度分别为81.82%,66.43%,在预测PSA(4-20 ng/mL) PCa方面具有优势,这与既往研究结果类似[4,30],不同的是本研究的PI-RADS v2.1 评分是在bp-MRI协议下进行的。
3.3 联合PI-RADS v2.1 的列线图模型预测PCa 的诊断效能
列线图是将logistic 回归方程中多个预测指标间的函数关系,画成相应具有刻度的直线计算图,简单易懂,能够针对每位患者提供个体化的风险预测。近年来,文献报道联合PSA的诺莫图模型可用于预测PCa[30-31]。WEN 等[30]以PSAD、PI-RADS v2.1 建立的诺莫图模型AUC为0.940。MA等[31]结合年龄、PSAD、PI-RADS v2.1 评分构建列线图模型,在训练组中模型的AUC 为0.938,在外部验证组中,其AUC 值为0.914,决策曲线显示该模型的净效益明显高于PI-RADS v2.1评分和PSAD,其具有良好的临床疗效。这与本研究结果类似。联合预测模型将显著提升PCa 的预测精度与效能。另外本研究结果显示PI-RADS v2.1 评分≥3 分为诊断阈值,敏感度为81.82%,特异度为66.43%,这与中国肿瘤整合诊治指南[32]提出的临床诊疗指导一致。本研究与上述研究[30-31]不同之处在于:(1)针对PSA(4-20 ng/mL)特殊区间的PCa 患者,且模型纳入了bp-MRI 的PI-RADS v2.1 评分;(2)列线图模型在不增加费用的前提下更进一步提高PSA (4-20 ng/mL) PCa的诊断准确性,有助于医师做出更精准的个体化评估。
3.4 本研究的局限性
本研究存在以下的局限性:(1)这是一个回顾性、单中心研究,纳入的样本量较小,因此存在抽样误差及选择的偏倚;(2)TRUS 系统穿刺确诊PCa 仍存在假阴性结果,所以更需进一步行多中心联合研究,对数据的有效性进行验证;(3)本研究只进行了内部验证,还需外部验证来确认该模型的有效性。
4 结论
综上所述,基于bp-MRI 的PI-RADS v2.1 联合临床指标构建的列线图模型,可用于PSA (4-20 ng/mL)PCa的无创预测,并进一步提高PCa的诊断准确性,为临床决策提供依据。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:陈志强设计本研究的方案,对稿件重要内容进行了修改,获得了宁夏回族自治区自然科学基金和宁夏回族自治区重点研发计划项目的资助;张若弟起草和撰写稿件,获取、分析或解释本研究的数据;周云舒、刘世莉、陈晓华、王卓、张少茹获取、分析或解释本研究的数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

