头颈部神经源性肿瘤145 例回顾性分析
巫瑞雪 雷聆艺 李飞 周伟华 许胜恩 覃纲
头颈部神经源性肿瘤是少见的头颈部原发肿瘤,主要起源于原始神经嵴细胞。根据肿瘤起源可分为三大类:①起源于外周神经鞘细胞的神经鞘瘤、神经纤维瘤、恶性周围神经鞘膜瘤;②起源于交感神经节细胞的节细胞神经瘤、节细胞神经母细胞瘤、神经母细胞瘤;③起源于副神经节的嗜铬细胞瘤和异位嗜铬细胞瘤,异位嗜铬细胞瘤又称副神经节瘤。除嗜铬细胞瘤外,其他肿瘤均可发生于头颈部。神经源性肿瘤在头颈肿瘤中较少见,诊疗上缺乏规范化标准。本文回顾145 例头颈部神经源性肿瘤病例,结合文献探讨其临床和影像学特点以及治疗方法,以期提高对头颈部原发性神经来源肿瘤的认识。
资料与方法
研究对象为我院2001 年1~7 月收治的头颈部神经源性肿瘤145 例患者,患者年龄7~79岁,平均45.43 岁,中位年龄41 岁。病程1 周~40 年,约55%患者病程不超过1 年。纳入标准为经术后病理诊断及穿刺或钳取活检明确诊断的头颈部神经源性肿瘤病例。所有患者术前均行CT 或MRI 检查,1 例患者放弃治疗未行手术,144 例患者行手术治疗,恶性肿瘤术后行放化疗。
观察指标:对患者的临床特征、影像学检查、治疗情况、术后并发症、预后进行分析、总结。
1 临床特点
根据2000 年世界卫生组织(WHO)年龄划分标准[1],将患者分为5 组,即儿童组(≤13 岁),青年组(14~44 岁),中年组(45~59 岁),老年前期组(60~74岁),老年组(≥75 岁),见表1。96 例瘤体位于颈部,其余散在分布在鼻腔、鼻窦、咽喉、腮腺等,见表2。111 例以局部无痛性肿块为主要临床症状,其他主要症状有疼痛、鼻阻、声嘶、咽部异物感/吞咽障碍等,见表3。
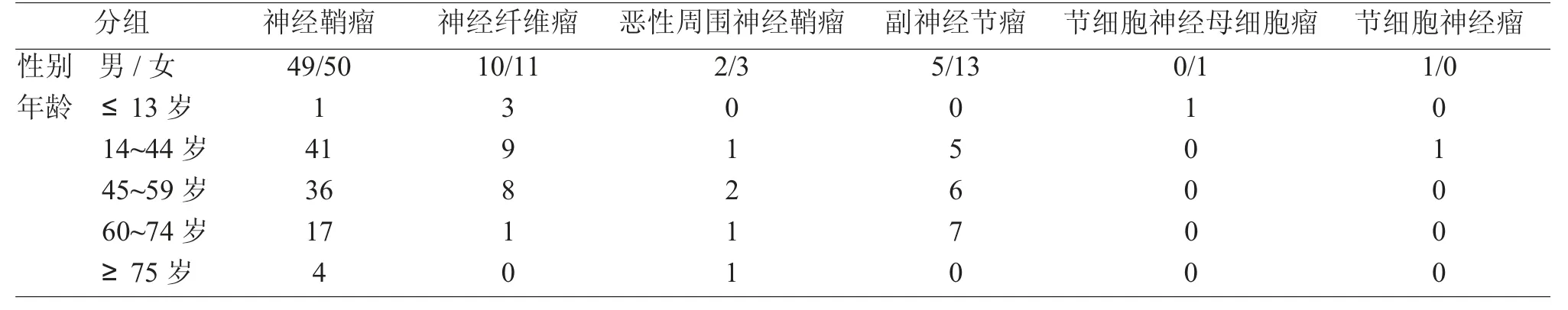
表1 145 例患者性别、年龄分布
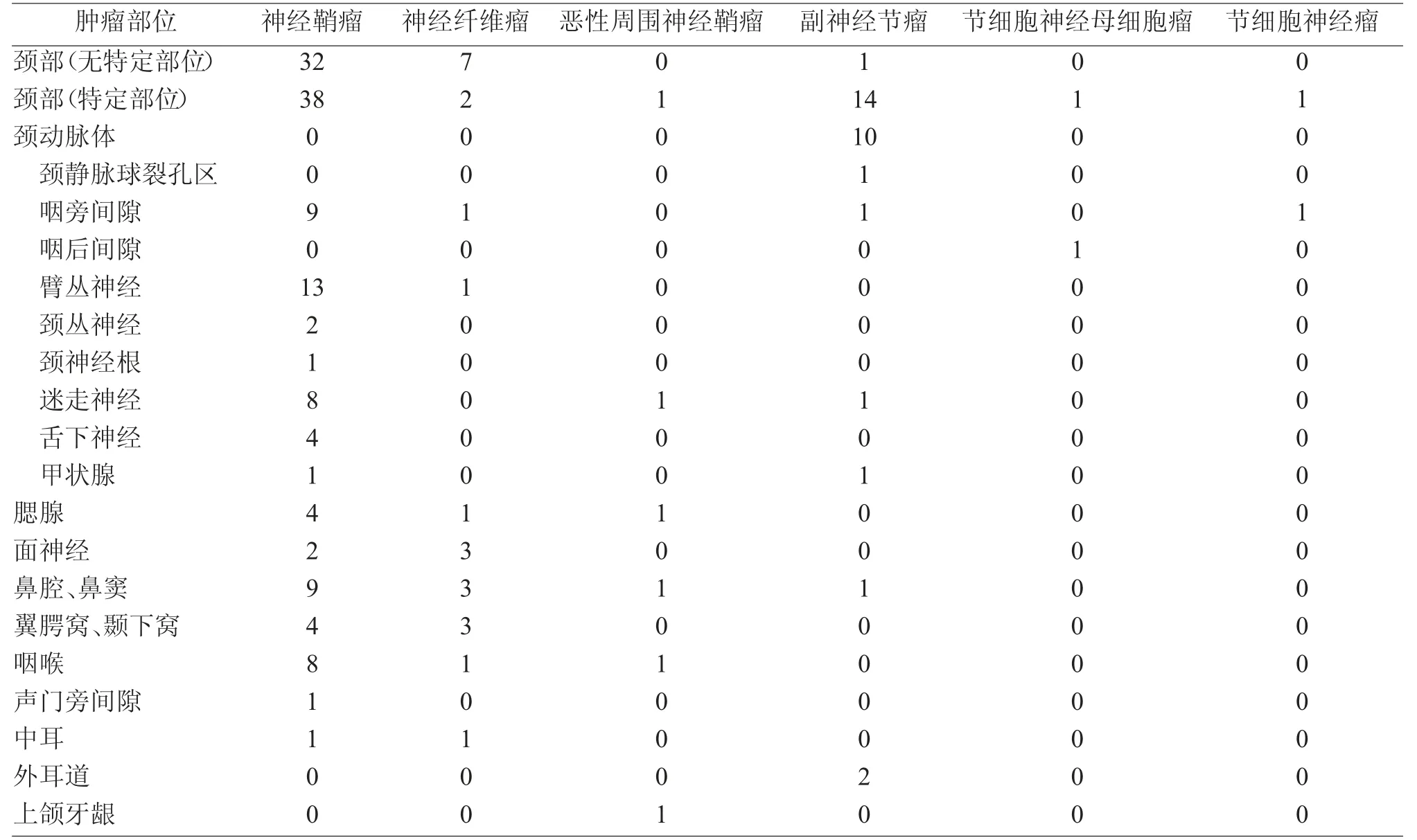
表2 145 例头颈部神经源性肿瘤位置分布
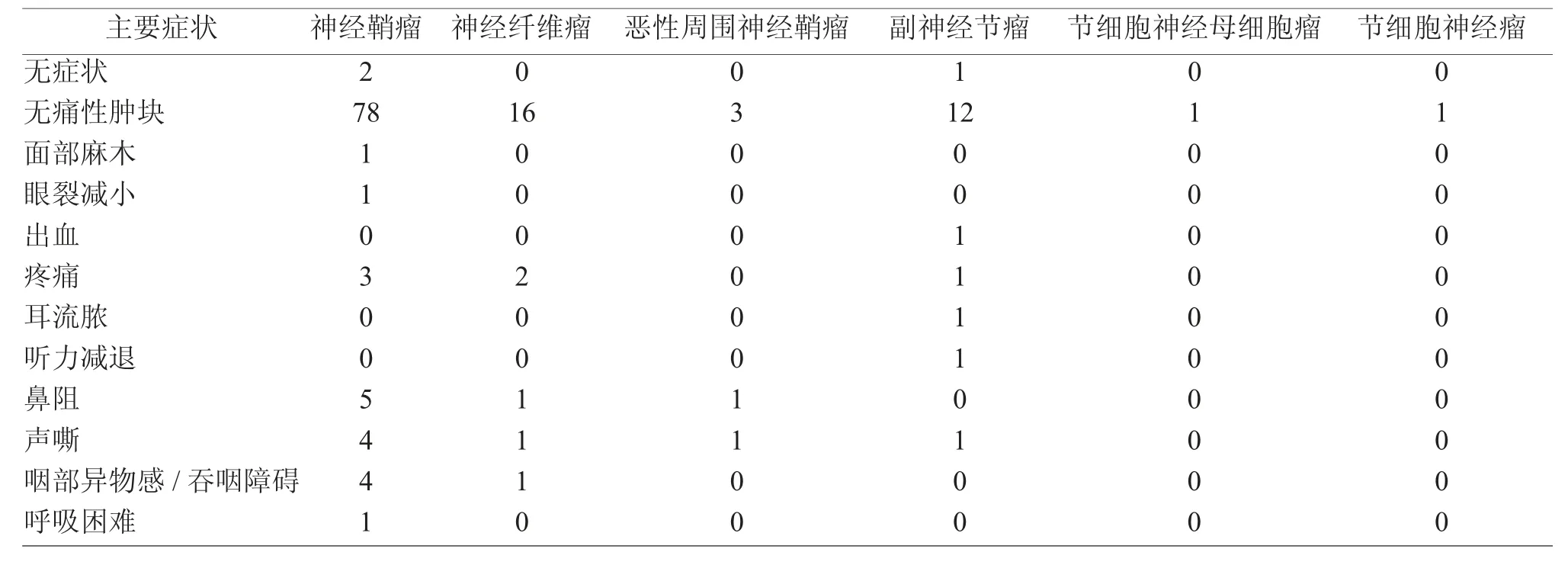
表3 145 例神经源性肿瘤患者主要症状
2 辅助检查
头颈部神经源肿瘤CT 呈类圆形或不规则软组织影,密度不均匀,增强扫描呈不均匀强化,MRI 呈类圆形混杂信号影,T1WI 等信号,T2WI 不均匀高信号,增强扫描呈欠均匀或不均匀强化,部分患者影像见图1。72 例患者术前行活检,包括细胞学穿刺活检63 例和钳取活检9 例,54 例结果阳性,其中40 例与术后病理诊断一致,14 例诊断不一致——具体为术后诊断神经鞘瘤中术前5 例诊断为囊肿、4 例诊断为涎腺混合瘤、1 例诊断为神经纤维瘤、1例诊断为胆脂瘤、1 例诊断为恶性肿瘤,神经纤维瘤1 例术前诊断为涎腺混合瘤,1 例节细胞神经母细胞瘤术前诊断为颗粒细胞肌母细胞瘤。

图1
3 治疗情况
145 例患者分别就诊于耳鼻咽喉头颈外科(56例)、血管外科(51 例)、口腔颌面外科(23 例),其他于甲状腺外科、神经外科、小儿外科、骨科等就诊。144 例患者行手术治疗,恶性肿瘤术后辅以放化疗。术后出现声音嘶哑2 例,饮水呛咳1 例,声音嘶哑和饮水呛咳5 例,4 例面瘫,3 例臂丛神经来源肿瘤出现患侧肢体肌力下降,4 例患侧肢体局部麻木不适,1 例患侧上臂外展受限,1 例椎旁神经鞘瘤出现霍纳综合征,1 例颈动脉体瘤术后血肿压迫气道致缺血缺氧性脑病,经治疗后恢复。
4 病理检查结果
神经鞘瘤99 例,恶性周围神经鞘瘤5 例,神经纤维瘤21 例,副神经节瘤18 例,节细胞神经母细胞瘤1 例,节细胞神经纤维瘤1 例。部分病理图片见图2。
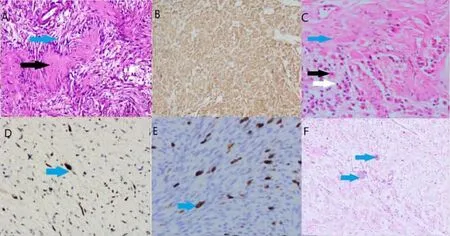
图2 头颈部神经源性肿瘤的病理组织学表现
5 随访
因联系方式失效失访37 例,总共随访108 例。良性肿瘤随访时间为3 月~10 年,经1 次手术治愈94 例,11 例失访,1 例神经纤维瘤术后18 月、术后3 年两次复发,再次术后失访;2 例神经纤维瘤病再发;1 例神经鞘瘤复发。恶性肿瘤随访时间4 年~11年,1 例放弃治疗后失访,5 例行手术治疗,其中1例鼻腔鼻窦恶性周围神经鞘瘤术后2 月复发再次行手术,术后失访;1 例上颌牙龈恶性周围神经鞘瘤术后未行放化疗,6 年后复发死亡,其余病例无复发或转移。
讨论
1 临床特点
本组病例提示神经源性肿瘤患者年龄主要分布在青年组和中年组,无明显性别优势。交感神经节细胞来源的肿瘤好发于儿童,成熟度越低的肿瘤发病率越高、发病年龄越小[2]。据文献统计,神经母细胞瘤患儿中50%的病例在1 岁前确诊,80%的病例在5 岁前确诊[3]。恶性周围神经鞘膜瘤较多继发于神经纤维瘤病Ⅰ型,放疗史是发生恶性周围神经鞘膜瘤的主要危险因素[4]。
本组资料还提示头颈部神经源性肿瘤最好发于颈部,少部分分布在鼻腔、鼻窦、外耳道、中耳、咽喉、唾液腺等,其中迷走神经、臂丛神经是常见的神经来源。以颈部包块为主诉的患者约40%首诊于耳鼻咽喉头颈外科,约60%首诊于血管外科。头颈部神经源性肿瘤在临床症状上常缺乏特异性,以局部无痛性肿物为主要表现,患者可能因不影响生活质量等原因未及时就诊,病程多为数月至1 年,部分病例病程可达数十年。瘤体进一步增大压迫神经还可导致霍纳综合征、面瘫、声嘶、饮水呛咳、肢体乏力、麻木等症状,压迫肿块可出现电击感和放射痛等。极少部分头颈部副神经节瘤、神经母细胞源性肿瘤有内分泌功能,可产生儿茶酚胺引起阵发性高血压、心悸、多汗、头痛、皮肤潮红、口感、便秘等[3,5]。位于中耳的神经源性肿瘤多来源于面神经,起病隐匿,可出现如耳痛、耳流脓、传导性聋、面瘫等症状,极易误诊为中耳胆脂瘤或化脓性中耳炎。本组病例中位于中耳的面神经肿瘤均术前误诊为慢性化脓性中耳炎,需引起重视。
2 辅助检查
术前明确神经源性肿瘤的诊断较困难,影像学检查是主要的辅助检查手段。对于明确病变范围、制定手术方案有很大帮助,本组患者术前均行CT或MRI 检查。不同头颈部神经源性肿瘤的影像学检查表现较为相似,CT 平扫表现为密度不均匀的软组织影,MRI 平扫表现为长T1 长T2 的混杂信号影。神经鞘瘤在CT 上表现为包膜完整的低密度影,增强扫描呈点状、环状不均匀强化;神经鞘瘤往往与神经走行方向一致,MRI 上可见“鼠尾征”[6]。在病理上,当细胞紧密排列的Antoni A 区位于中央、结构较疏松的Antoni B 区位于4 周时,MRI 可见“靶征”[6]。位于中耳的面神经鞘瘤需与中耳胆脂瘤鉴别,累及鼓室段或乳突段的面神经鞘瘤常可生长到鼓室中耳腔内,CT 可见面神经骨管明显扩大或破坏消失,呈膨胀性的骨质破坏,听骨向外推移或破坏,患者常伴有传导性听力下降;而中耳胆脂瘤呈溶骨性破坏,若侵蚀面神经,最易破坏锥曲段或鼓室段面神经骨管,未累及区域的面神经骨管完整、无扩大,听骨向内移位[7]。神经纤维瘤影像学表现与神经鞘瘤相似,而恶性周围神经鞘膜瘤与良性肿瘤难以仅从影像上区分,需病理检查鉴别。50%~70%肿瘤细胞S-100 蛋白呈阳性,高级别恶性周围神经鞘膜瘤中见散在肿瘤细胞表达S-100 蛋白,p53 和Ki-67 的表达有助于恶性肿瘤的诊断[8]。
CT 是神经母细胞源性肿瘤的重要影像学检查方法,文献报道良恶性肿瘤的不同在于CT 上恶性肿瘤可见钙化灶[9],节细胞神经母细胞瘤、神经母细胞瘤80%-90%出现钙化,而粗大不定形钙化是神经母细胞瘤较为特征性的表现[10]。
头颈部副神经节瘤以颈动脉体瘤最为多见,颈动脉体瘤位于颈动脉分叉上,偏心性包绕颈动脉,使颈内外动脉夹角增大[11]。本组资料9 例颈动脉体瘤均完成CTA 检查,可见瘤体推挤部分颈内、外动脉,致颈总动脉分叉处角度加大。DSA 是颈动脉体瘤诊断的金标准,其特征性造影表现为颈总动脉分叉扩大、肿瘤滋养血管和肿瘤染色[12]。迷走神经副神经节瘤多位于颈动脉分叉上方、颈静脉孔周围,不会引起颈动脉分叉扩大,而是使颈动、静脉分离。颈静脉球瘤位于颈静脉孔及鼓室部位,导致病变部位骨质呈虫蚀样破坏,增强CT 可见颈静脉孔区梭形肿块,颈静脉孔扩大,周围见紊乱血管影。颈静脉球瘤MRI 典型表现为T2WI 呈明显高信号,部分病灶可呈现出特征性的“盐和胡椒征”[12],即高信号的肿瘤背景下流空血管呈多发点状低信号。
组织病理学检查是一种快速有效的诊断方法。位于鼻腔、咽喉、外耳道、颈部表浅位置的肿瘤,在排除血管来源的病变时,术前可尝试细针穿刺活检或钳取活检以明确诊断,但部分神经源性肿瘤出现囊性变及囊内出血、坏死,细针穿刺活检易造成误诊,或者由于肿瘤位置深在,准确取材困难,术前应仔细阅读影像,了解其结构,注意取样方向和深度。本组72 例患者术前活检结果即有18 例出现阴性,14 例出现诊断不一致。故最终的确诊仍依赖于术后病理。
3 治疗及预后
手术完整切除并保留神经功能是治疗头颈部神经源性肿瘤的主要治疗手段。囊内摘除肿瘤是神经鞘瘤的首选手术方式,但对于直径较大的肿瘤,囊内摘除较难以进行,需切除肿瘤并切断起源神经,此时可借助手术显微镜行神经吻合术,获得更好的手术效果。神经鞘瘤完全切除后很少复发,本组神经鞘瘤的手术患者中,仅1 例患者术后复发,其余患者均一次手术治愈。头颈部神经纤维瘤是较难根治的良性肿瘤,手术安全缘应距离肿瘤1~3cm[13],尽量扩大切除减少复发。本组病例中1 例神经纤维瘤术后两次复发,可能因为保留面神经功能,未能完全切除肿瘤所致。1 例神经纤维瘤伴有神经纤维瘤病Ⅰ型的儿童患者术后不到1 年再发,可能因为伴神经纤维瘤病Ⅰ型的神经纤维瘤本身复发率高、治愈率低[14]。
恶性周围神经鞘膜瘤的治疗首选手术切除,手术切除范围较至少3~5cm[15],但由于头颈部解剖结构的关系,常难以做到根治性的切除,术后需辅助放疗和化疗。一般认为伴有神经纤维瘤病Ⅰ型、肿瘤直径大于5cm、不能完全切除肿瘤的患者局部复发率、死亡率较高[16]。据统计恶性周围神经鞘瘤患者5 年和10 年生存率分别为34%~52%和23%~34%,局部复发率为40%~65%[17]。对神经母细胞源性肿瘤,强调风险分层个体化治疗[18]。但头颈部结构的特殊性常导致术前无法活检明确诊断,当术后病检诊断为神经母细胞源性肿瘤时应再次评估是否需化疗等综合治疗。节细胞神经瘤预后良好,术后不易复发;节细胞神经母细胞瘤恶性程度低于神经母细胞瘤,很少发生转移,预后较好,神经母细胞瘤恶性程度高,易发生早期多处转移,预后较差。
头颈部副神经节瘤的治疗方式根据肿瘤的位置、大小、是否转移等决定,首选治疗方式仍是手术切除。颈动脉体瘤与大动脉或神经粘连紧密,术前栓塞可以减少神经损伤,减少术中出血[19],本研究中5 例颈动脉体瘤行术前栓塞,术中出血明显减少,未出现并发症。迷走神经副神经节瘤的患者首选手术治疗,但双侧迷走神经病变会出现致命性呼吸困难,而手术造成神经功能损伤不能绝对避免。Suárez等[20]认为迷走神副神经节瘤手术与放疗的局部复发率相似,但更易发生神经功能损伤,所以对大多数双侧迷走神经病变的患者,应考虑观察随访,在肿瘤进展的情况下行放射治疗。颈静脉球瘤目前治疗方法主要有手术和放射治疗,哪一种治疗最佳尚无定论。瘤体小,力求完全根治的患者可选择手术治疗;对于一些病变范围广泛、难以手术切除或手术切除不满意者,可采用放射治疗[21]。副神经节瘤预后一般良好,但部分肿瘤具有一定程度的侵袭性,术后需长期密切随访。
总之,头颈部神经源性肿瘤在青年、中年群体多见,神经母细胞源性肿瘤多见于儿童。外周神经鞘来源的肿瘤最多,瘤体多位于颈部,单发局部无痛性肿块为最常见的临床症状。CT 和MRI 对头颈部神经源性肿瘤的诊断都具有重要价值,在影像学上各种神经源性肿瘤表现相似,特定区域的影像改变可提示神经来源,确诊需依靠病理检查;手术完整切除瘤体是头颈部神经源性肿瘤的主要治疗方法,血管神经损伤是常见并发症,恶性肿瘤术后需放化疗。总体来说,良性神经源性肿瘤术后很少复发,恶性神经源性肿瘤预后较差。

