基于多参数MRI影像组学在预测非小细胞肺癌分型中的应用
王曼曼,江建芹,徐高峰,符益纲,王玉玲,耿其楠,李真真
盐城市第一人民医院影像科,江苏 盐城 224000;*通信作者 徐高峰 18905100082@163.com
肺癌是目前最常见的恶性肿瘤之一,病死率位于恶性肿瘤首位[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的类型,肺鳞癌和肺腺癌分别约占原发性NSCLC的35%和60%[2],两者具有不同的组织学特征及生长方式,鳞状细胞癌与细胞间桥接和单个细胞角化有关,而腺癌的腺体结构更为突出[3]。肺腺癌多发于肺野周围,其生长迅速,易侵犯血管,进入血行转移;而肺鳞癌多发生于肺门,生长缓慢,前期很难发现症状[4]。肺腺癌和鳞癌的临床治疗方案不同,预后也存在差异[5-6]。因此,区分NSCLC的组织学亚型是制订临床治疗策略的重要前提。
临床上NSCLC的组织学亚型主要依靠病理活检进行诊断。但是肿瘤具有时间及空间异质性[7],穿刺、支气管镜等只能获取一小部分肿瘤的组织学信息,不能全面反映肿瘤组织的特点,且病理检测存在创伤、无法反复取材。因此,无创定性分析NSCLC分型是近年来的研究热点。影像组学是指从影像图像中高通量地提取大量影像特征,应用计算机软件将图像转换为高维的可开采数据,量化肿瘤的形态学特征和内部异质性,进而服务于临床[8-9]。MRI是术前评估肺癌的常见无创检查方法,目前,MRI影像组学已广泛应用于膀胱癌、乳腺癌和胶质瘤亚型的鉴别和预后预测[10-12],但在肺癌中的研究较少。本文旨在探讨基于MRI的T1WI、T2WI及表观扩散系数(ADC)影像组学模型和临床特征模型在鉴别肺腺癌和鳞癌方面的临床价值。
1 资料与方法
1.1 研究对象 回顾性收集2017年8月—2021年4月在盐城市第一人民医院检查的114例肺癌患者的MRI资料。纳入标准:①MRI检测到肺部实性病灶,最大直径≥10 mm;②MRI检查完成后,经手术切除、穿刺或纤维支气管镜等病理证实为肺腺癌或肺鳞癌;③术前临床资料、术后病理资料齐全。排除标准:①MRI检查前接受放疗、化疗或靶向治疗等;②MRI图像序列不全或存在明显的伪影与变形。114例患者中,肺腺癌66例,肺鳞癌48例。收集患者年龄、性别、病变大小、病变部位、吸烟状况等临床资料及术后或穿刺活检得到的病理分型(鳞癌、腺癌)。本研究获得本院伦理委员会批准(2022-k-115),患者均签署知情同意书。
1.2 仪器设备及扫描方案 所有入组检查者均使用MRI扫描仪(MAGNETOM Skyra 3.0T,Siemens Healthcare,Erlangen),18通道体表线圈。患者取仰卧位、头先进,扫描范围从胸廓入口至肺下界。患者腹部绑腹带,并且使用心电门控进行呼吸监测。扫描序列包括T1WI容积内插屏气扫描(volumetric interpolated breath-hold examination,VIBE)、T2 fast-BLADE(fBLADE)、扩散加权成像(DWI)。DWI的b值为0、300、800 s/mm2,通过扫描仪工作站自动生成ADC图像。其余扫描序列参数见表1。
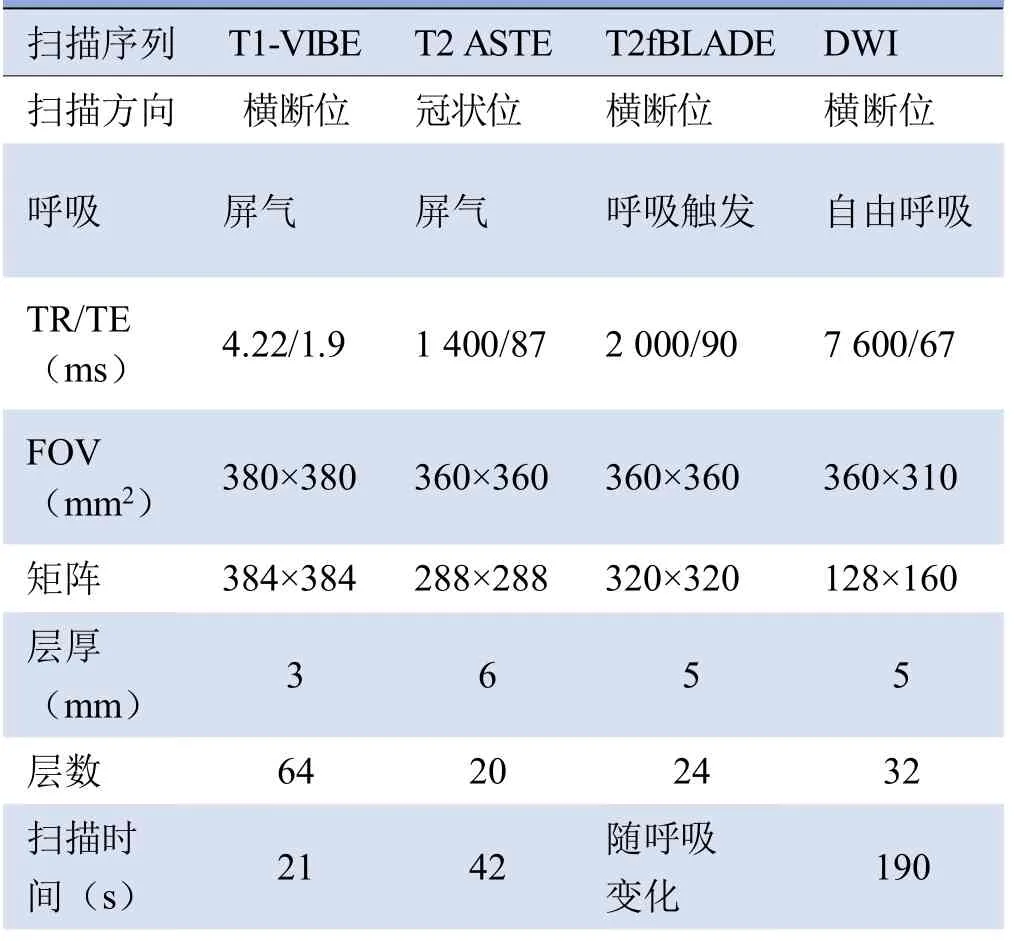
表1 详细扫描序列参数
1.3 影像组学流程与方法
1.3.1 感兴趣区(ROI)分割 入组患者的T1-Vibe、T2WI及ADC图导入软件3D-slicer(版本4.11.20210226;www.slicer.org)中。由2名分别有8年(观察者1,主治医师)和5年(观察者2,住院医师)工作经验的放射科医师讨论确定边界后,采用半自动勾勒法,分割ROI,最后形成3D-ROI(图1)。勾画ROI时包含整个病灶的体积,不排除囊化、坏死等区域,但需避开肺不张等肺部组织及肉眼可见的伪影。结合常规MRI序列进行ADC图勾画。

图1 使用3D-slicer软件逐层半自动勾画ROI生成全体积瘤体
1.3.2 特征提取 病变分割或ROI选择之后,用软件3D-slicer的插件radiomics分别从常规T1WI、T2WI及ADC 3个序列中各自提取得到844个影像组学特征,包括病灶外形特征、一阶统计学特征、纹理分析特征、小波特征。
1.3.3 特征筛选、分析数据 将114例患者按7∶3随机分为训练队列80例和验证队列34例。使用最小绝对收缩选择算子(least absolute shrinkage and selection operator,LASSO) 回归算法对提取特征筛选降维,并选择最佳预测特征。采用10倍交叉验证选择最优λ,去除不重要的组学特征,保留与鉴别肺腺癌及肺鳞癌相关的特征。通过筛选后的特征乘以各自的加权系数,再求和计算影像组学评分(radiomics score,Rad-score)。3D-ROI
1.3.4 预测模型鉴定 筛选出特征后,建立支持向量机(support vector machines,SVM)预测模型,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),量化每一个序列的预测效能。使用单因素逻辑回归模型在年龄、吸烟状况、病变位置、性别和病灶大小中筛选出与肺癌分型相关的临床特征,然后结合筛选出的临床特征及Rad-score,建立临床-影像综合列线图。用校准曲线对综合列线图的性能进行验证。
1.4 统计学分析 本研究中使用R 4.0.3、SPSS 20.0软件。符合正态分布的计量资料以±s表示,采用独立样本t检验;计数资料用例数和百分比表示,采用χ2检验。采用R软件中caret包对数据分组及回归训练;glmnet包进行LASSO回归分析筛选影像组学特征,计算Rad-score评分;pROC包建模后绘制ROC曲线;e1071包用于建立SVM模型;rms包构制列线图。采用Delong检验比较不同模型性能。P<0.05为差异有统计学意义。
2 结果
2.1 患者基本临床资料 肺腺癌组与肺鳞癌组性别及吸烟状况差异有统计学意义(P=0.008、0.001),在训练队列和验证队列之间,各项临床及病理资料差异均无统计学意义(P>0.05),见表2。
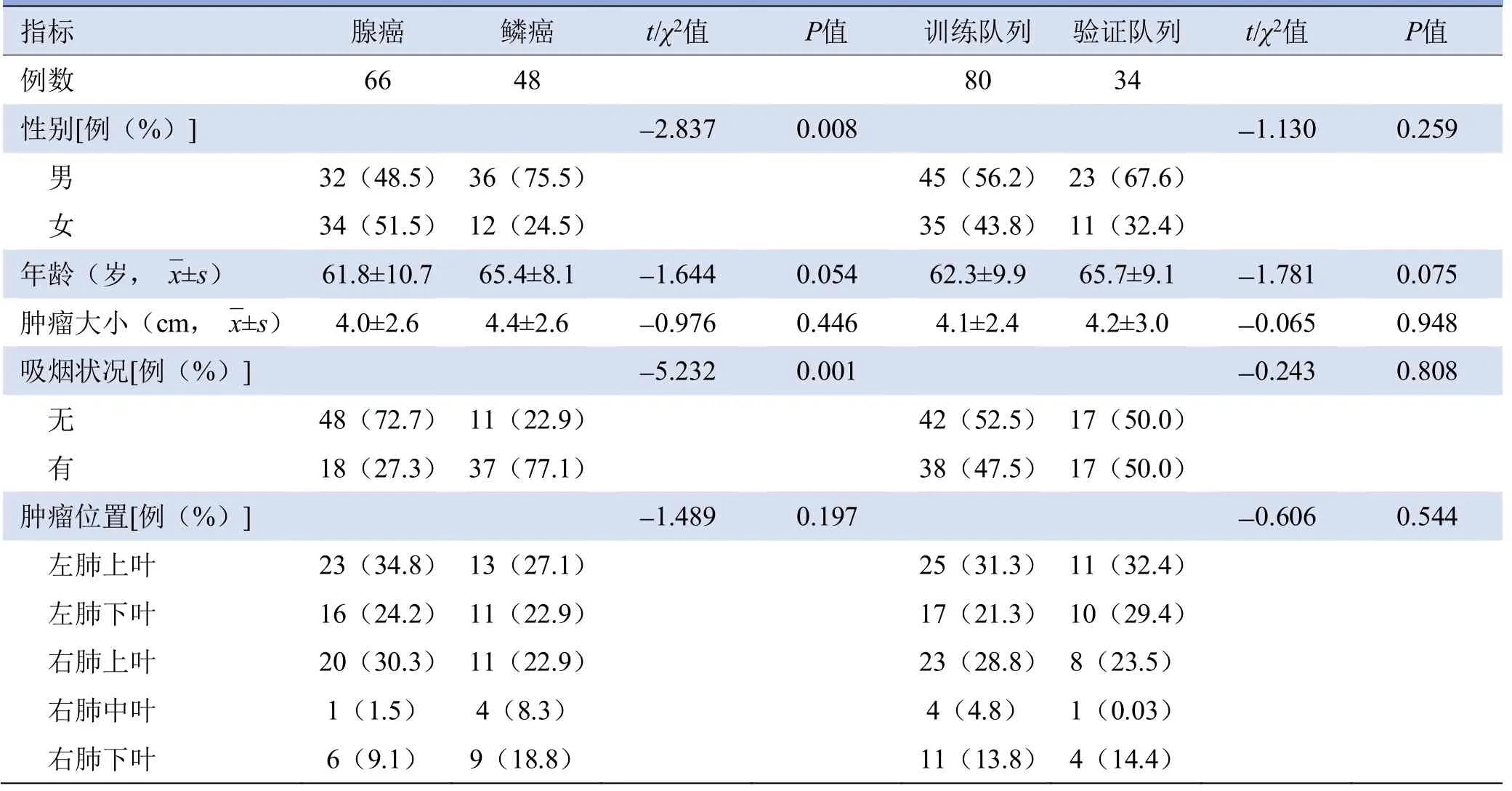
表2 肺腺癌组与鳞癌组患者临床资料病理特征比较及训练队列和验证队列肺癌患者临床资料比较
2.2 影像组学特征选择及建立预测模型 从T1WI、T2WI、ADC图像中分别提取出10、8、4个与NSCLC分型相关的影像组学特征,基于T1WI联合T2WI序列筛选出14个与NSCLC分型相关影像组学特征(图2、3)。
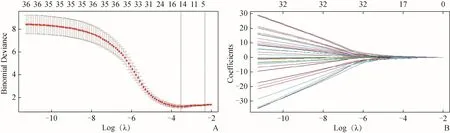
图2 T1WI联合T2WI影像组学特征的筛选。A.在LASSO模型中通过10倍交叉验证和最小化标准选择参数λ。B.在最佳参数λ(λ=0.029)处选取14个系数非0的影像组学特征
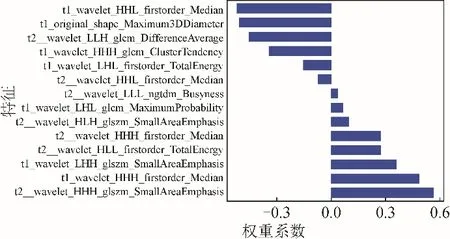
图3 基于T1WI联合T2WI影像组学筛选出的影像组学特征
在训练队列与验证队列,T1WI模型、T2WI模型及T1WI联合T2WI组合模型的诊断效能(AUC=0.911、0.860、0.921;验证队列AUC分别为0.881、0.888及0.909)均优于ADC影像组学模型(训练队列AUC为0.709,验证队列AUC为0.642),见图4、表3。Delong检验显示,基于T1WI、T2WI及T1WI联合T2WI与ADC影像组学模型的AUC差异有统计学意义(P=0.017、0.027、0.002)。T1WI联合T2WI影像组学模型与单独T1WI及单独T2WI影像组学模型的AUC差异无统计学意义(P=0.604、0.732),但T1WI联合T2WI影像组学模型验证队列的AUC、准确度、敏感度均高于单独T1WI及单独T2WI影像组学模型。因此本研究选择T1WI联合T2WI联合组学模型构建列线图。
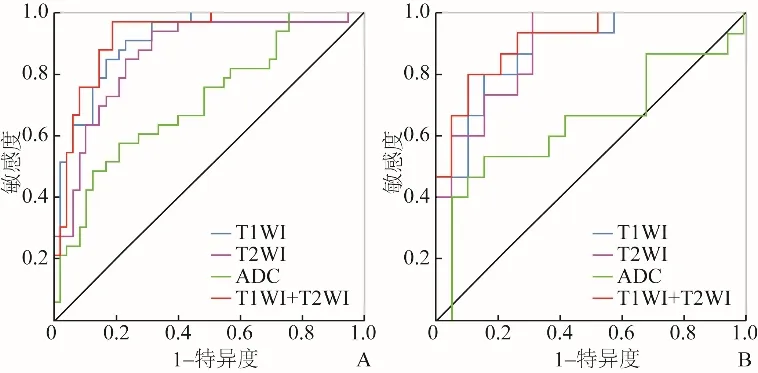
图4 T1WI、T2WI、ADC、T1WI联合T2WI预测NSCLC分型的ROC曲线。A为训练队列,B为验证队列

表3 验证队列中不同组学标签评估NSCLC分型的预测效能
2.3 综合列线图的构建、验证及临床应用 结合临床因素(吸烟状况与性别)和Rad-score(T1WI联合T2WI的影像组学模型)建立临床-影像的综合列线图(图5)。训练队列中预测NSCLC中肺鳞癌及肺腺癌分型的临床-影像综合列线图AUC为0.961(95% CI 0.923~1.000),验证队列中AUC为0.940(95% CI 0.862~1.000),诊断效能高于影像组学模型。T1WI联合T2WI影像组学模型及临床-影像综合列线图的ROC曲线见图6。临床-影像综合列线图的校准曲线显示,训练队列和验证队列中综合模型预测NSCLC中肺鳞癌及肺腺癌分型的结果与病理结果之间的一致性较好(图7)。
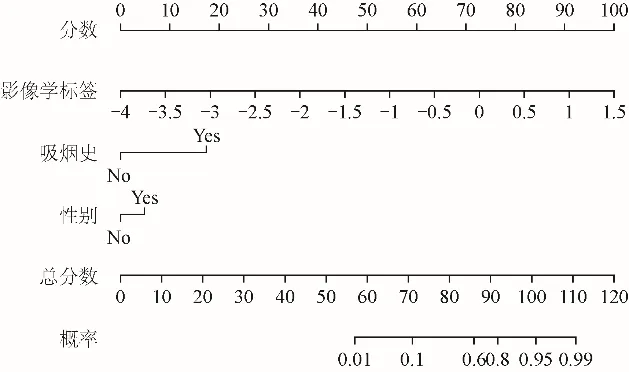
图5 临床-影像的综合列线图。包括影像组学评分和性别、吸烟情况
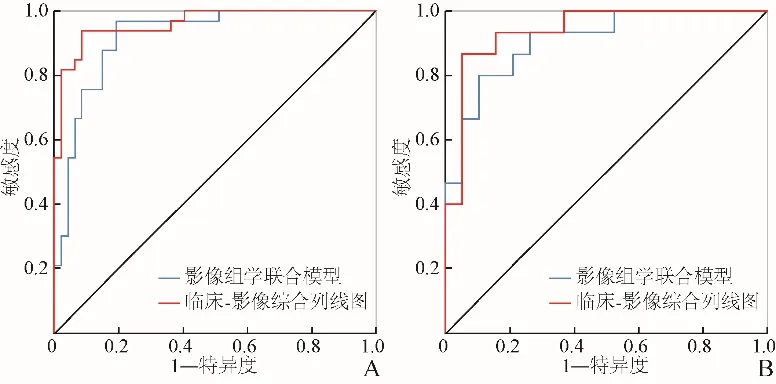
图6 训练队列和验证队列中临床-影像综合列线图模型、影像组学联合模型的ROC曲线。A.训练队列;B.验证队列
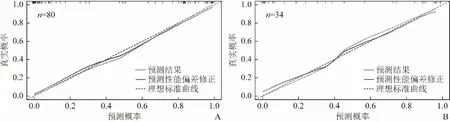
图7 在训练队列和验证队列中预测NSCLC分型的校准曲线。45°的直线表示实际(Y轴)和列线图预测(X轴)存活概率完美匹配的标准曲线。虚线表示临床-影像综合列线图预测结果,实线表示预测性能偏差的修正,预测虚线与标准曲线越贴近,说明列线图的预测能力越好、精度越高。A.训练队列;B.验证队列
3 讨论
本研究开发并验证了鉴别NSCLC分型的单独影像组学模型及临床-影像综合列线图,结果显示该方法在当前队列中显示出良好的鉴别能力和临床有效性,表明本研究所提出的列线图可能是一种有效、无创和安全的识别NSCLC组织学亚型的方式。
3.1 ADC影像组学模型预测NSCLC亚型 本研究中基于T1WI、T2WI及两者联合的影像组学模型效能优于单独ADC模型。ADC是反映水分子扩散运动能力的最常用临床参数。已有研究表明ADC在肿瘤检测和表征、治疗反应评估和肿瘤分期方面表现良好,并且还可以反映生物学特征[13-14]。而本研究中ADC图的预测效能一般,分析可能的原因:①本研究为回顾性研究,采集和图像重建参数的变化,可能会引入一些不是由潜在的生物效应引起的纹理变化,影响模型的鲁棒性[15];②ADC图较T1WI及T2WI图像分辨率低,有文献研究基于ADC图提取出的影像组学特征可重复性低[13],而影像组学更注重结构相,以致提取到组学特征较少。
3.2 T1WI、T2WI影像组学模型预测NSCLC亚型Wang等[16]建立基于T2WI序列影像组学模型,结果显示该模型能够区分肺腺癌与其他组织学类型(AUC=0.770)。Tang等[17]开发并验证了包括T2WI序列在内的多参数组学模型区分NSCLC分型的价值。T2WI序列信噪比高,病灶与正常组织对比度高,且不存在T1WI序列中因屏气不足产生的运动伪影。本研究中T2WI的预测效能,和既往研究结果相仿,证明了基于T2WI的影像组学模型在NSCLC病理分型中的价值。
目前鲜有文献基于T1WI序列构建影像组学模型预测NSCLC亚型的效能,而本研究中单个序列中T1WI构建的组学模型提取有效特征数量最多,其AUC为0.911,提示基于T1WI的影像组学特征可潜在反映肺癌的病理学特征。T1WI序列结构相更优,具有层厚薄、分辨率高的特点,且扫描序列简单,在今后的研究及工作中实用性强。
有研究[18-19]证明联合序列效能高于单一序列。本研究中T1WI联合T2WI构建影像组学模型的预测效能在训练队列及验证队列均高于单序列模型,说明在不同的MRI序列中存在互补的信息。
3.3 临床-影像综合列线图预测NSCLC分型 随着研究领域的不断扩大,影像学变量与其他学科生物学变量的联合越来越频繁,诊断优势也逐渐显现[20-21]。本研究T1WI及T2WI联合模型中纳入性别及吸烟状况后,效能进一步提高,说明临床特征中包含了对肺腺癌及肺鳞癌鉴别诊断所需的补充信息。吸烟相关的风险在肺鳞癌中显著高于肺腺癌[22-23]。已有研究发现不同性别体内激素及微生物群在肺部疾病和免疫中起重要作用[24]。Liu等[25]发现在肺腺癌中一些基因的异常表达与患者性别显著相关。因此,对于个体化治疗进程中,将吸烟状况及性别纳入本研究的临床-影像综合列线图是合理的。
3.4 本研究的局限性 ①仅勾画肿瘤的ROI,未考虑肿瘤周围区域的信息,未来将在大样本、多中心研究中继续探究。②除验证吸烟状况与性别与肺癌分型的相关性外,未纳入影像学特征、血液学指标,今后需要进一步分析。③基于临床应用的MRI常规基本序列,未来应纳入更多MRI功能序列,更全面地反映肿瘤生物学状态。
总之,多参数MRI影像组学模型及临床-影像综合列线图可以有效提高术前预测NSCLC分型的诊断效能,为精准医学和临床个体化治疗提供客观、可靠的参考依据。

