基于CT征象的大脑中动脉M1分叉部破裂动脉瘤预后模型的建立和验证
杨明光,余飞,黄英,杨艳丽,鲁宏,杨华,刘衡*
1.遵义医科大学附属医院放射科,贵州 遵义 563000;2.重庆市急救医疗中心 重庆市第四人民医院影像科,重庆 400010;3.重庆市第七人民医院 重庆理工大学附属中心医院放射科,重庆 400054;4.重庆市中医院放射科,重庆 400021;*通信作者 鲁宏 471739847@qq.com;刘衡 zmcliuh@163.com
颅内动脉瘤破裂引起的蛛网膜下腔出血(aneurysmal subarachnoid haemorrhage,aSAH)是一种相对罕见但病情危重的卒中亚型,约占所有卒中的5%,临床预后较差[1]。大脑中动脉(middle cerebral artery,MCA)为颅内动脉主要分支,是颅内动脉瘤的好发部位,其在颅内动脉瘤中占35%[2],约75%~85%位于M1分叉部[3]。MCA动脉瘤破裂出血伴颅内血肿常引起多种并发症,具有较高的病死率及致残率[4]。既往临床医师常以个人经验和直觉判定动脉瘤破裂出血的临床结局,从主观方面制订救治方案,但受到患者个体特征、临床危险因素以及动脉瘤形态差异的影响,易导致患者预后不良。临床预测模型是一种基于统计学方法衍生的预测工具,可帮助医师从病史、体征、实验室和影像学检查中提炼出具有较强独立危险因素的组合概率预测临床结局[5]。列线图可直观、可视化地展示预测模型,近年来在疾病的早期诊断及预后评估中广泛应用。既往罕有大脑中动脉M1分叉部动脉瘤预后的研究,本研究基于临床资料及CT影像征象建立大脑中动脉M1分叉部动脉瘤破裂患者预后的列线图预测模型,并进行外部验证其临床实用性,为临床个性化诊疗提供更具价值的参考依据。
1 资料与方法
1.1 研究对象 本研究为回顾性队列研究。使用图像存档和通信系统收集重庆市急救医疗中心2014年1月—2022年3月大脑中动脉M1分叉部动脉瘤破裂出血患者117例作为训练队列构建模型,遵义医科大学附属医院2016年1月—2022年3月大脑中动脉M1分叉部动脉瘤破裂出血患者116例作为外部验证队列用于评估模型。纳入标准:经CT血管成像(CTA)证实大脑中动脉M1分叉部动脉瘤破裂导致蛛网膜下腔出血。排除标准:①合并其他血管畸形;②梭形动脉瘤及夹层动脉瘤;③合并颅内其他疾病;④CT图像质量不佳,无法评估动脉瘤的形态学参数。本研究经重庆市急救医疗中心医学伦理委员会批准(2021第68号),豁免患者知情同意。
1.2 仪器和图像采集 使用Lightspeed VCT 64排螺旋CT(GE)和SOMATOM Definition Flash 128排螺旋CT(联影)进行图像采集。扫描参数:头颅平扫CT:层厚5 mm,层间隔5 mm,管电压120 kV,管电流180~200 mA。头部CTA:层厚0.625 mm,层间隔0.625 mm,管电压120 kV,管电流400 mA。以4.5 ml/s注射对比剂碘海醇(350 mgI/ml)50 ml,注射结束后以4.5 ml/s注射生理盐水30 ml。
1.3 数据收集
1.3.1 动脉瘤形态学参数的定义及测量 由2位具有5年以上工作经验的放射科医师对CTA图像进行双盲测量和评估,意见不一致时由具有15年以上工作经验的主任医师进行审核。包括12个动脉瘤形态学参数(图1):动脉瘤形态呈囊状、边缘光滑为形态规则,具有分叶或小囊泡为形态不规则;子囊为动脉瘤壁上的囊状突起;宽度为垂直深度的最大直径;深度为动脉瘤颈中点至瘤底部的最长连线;最大径为瘤颈边缘至瘤底部的最长连线或宽度;垂直高度为动脉瘤颈部至动脉瘤底部的最大垂直距离;母动脉直径为(动脉瘤近侧母动脉直径+1.5倍动脉瘤近侧母动脉直径距离的母动脉直径)/2;瘤颈宽为动脉瘤颈部的最大横径;AR比为深度/瘤颈宽的比值;SR比为深度/母动脉直径的比值;宽/颈比为宽度/瘤颈宽的比值;深/宽比为深度/宽度的比值[6]。
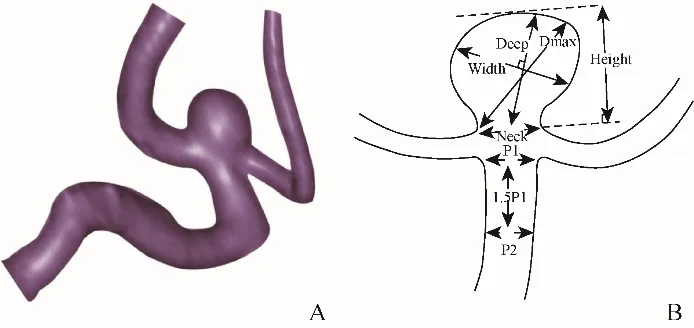
图1 大脑中动脉M1分叉部动脉瘤破裂形态参数示意图。A为M1分叉部动脉瘤彩色三维立体图; B为动脉瘤线条图;Neck:瘤颈宽;Deep:深度;Height:高度;Width:宽度;Dmax:最大径
1.3.2 临床资料与CT平扫征象 收集患者性别、年龄、收缩压、舒张压、高血压病史、格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分与治疗方式等临床资料;CT平扫征象包括有无血肿、Fisher评分与中线移位。
1.4 预测结局 结局变量根据出院时的格拉斯哥预后量表(Glasgow outcome scale,GOS)评分评估患者临床预后:1=死亡;2=植物生存,长期昏迷,去强直状态;3=重度残疾,清醒但生活不能自理;4=中度残疾,生活可以自理,不能正常工作或学习;5=恢复良好,可以正常工作和学习。预后评判标准:4~5分为预后良好,1~3分为预后不良。
1.5 预测模型的构建 根据Xia等[7]的研究选取可能影响大脑中动脉M1分叉部动脉瘤破裂出血预后相关的预测因素构建3种模型。通过Logistic回归筛选出临床危险因素建立临床预测模型(模型1);基于CT平扫征象和CTA动脉瘤形态学特征建立影像模型(模型2);基于临床危险因素、CT平扫征象和CTA动脉瘤形态学特征建立联合模型(模型3)。
1.6 统计学分析 采用SPSS 18.0与R 4.1.2软件。符合正态分布的计量资料以±s表示,使用独立样本t检验分析;不符合正态分布的计量资料以M(Q1,Q3)表示,使用Mann-Whitney U检验分析。计数资料以频数(百分比)表示,使用χ2检验或Fisher精确检验分析。将单因素分析中差异有统计学意义的影响因素纳入多因素Logistic回归分析,基于最小赤池信息准则进行向前逐步多因素Logistic回归分析,以确定不良预后的独立预测因素。使用受试者工作特征(ROC)曲线和Hosmer-Lemeshow检验(P>0.05表示拟合良好)评估模型的区分度和校准能力。使用校准曲线评估模型的性能,决策曲线分析评估预测模型的临床价值。计算模型的诊断准确度、敏感度、特异度、阳性预测值和阴性预测值。最后在外部验证集中验证各模型的效能。使用R软件中“rms”包构建列线图将最优模型可视化。校准曲线采用“boot”方法,重抽样1 000次进行验证。P<0.05为差异有统计学意义。
2 结果
2.1 训练集与验证集中患者临床资料及影像特征比较 两组性别、年龄、高血压病史、子囊、动脉瘤宽度、动脉瘤深度、动脉瘤最大径、垂直高度、母动脉直径、瘤颈宽、SR比、深/宽比差异均无统计学意义(P均>0.05),收缩压、舒张压、入院GCS、有无血肿、动脉瘤形态、AR比、宽/颈比、中线移位、Fisher评分、治疗方式差异有统计学意义(P均<0.05),见表1。训练集与验证集中,多数患者选择的手术方式为动脉瘤夹闭术。训练集与验证集中预后不良情况见表1。

表1 大脑中动脉M1分叉部动脉瘤破裂预后预测模型开发和验证队列中预测变量的分布
2.2 训练集中预后预测模型的单因素、多因素Logistic回归分析结果 训练集中预后良好与预后不良组收缩压、高血压病史、入院GCS评分、血肿、动脉瘤形态、子囊、动脉瘤宽度、动脉瘤深度、最大径、垂直高度、AR比、SR比、宽/颈比、中线移位、Fisher评分及治疗方式差异有统计学意义(P均<0.05),见表2。多因素Logistic回归显示,收缩压、入院GCS评分、最大径及中线移位为大脑中动脉M1分叉部动脉瘤破裂预后预测模型训练集中预后不良的独立预测因子,见表3。

表2 大脑中动脉M1分叉部动脉瘤破裂预后预测模型开发队列的单因素Logistic回归分析
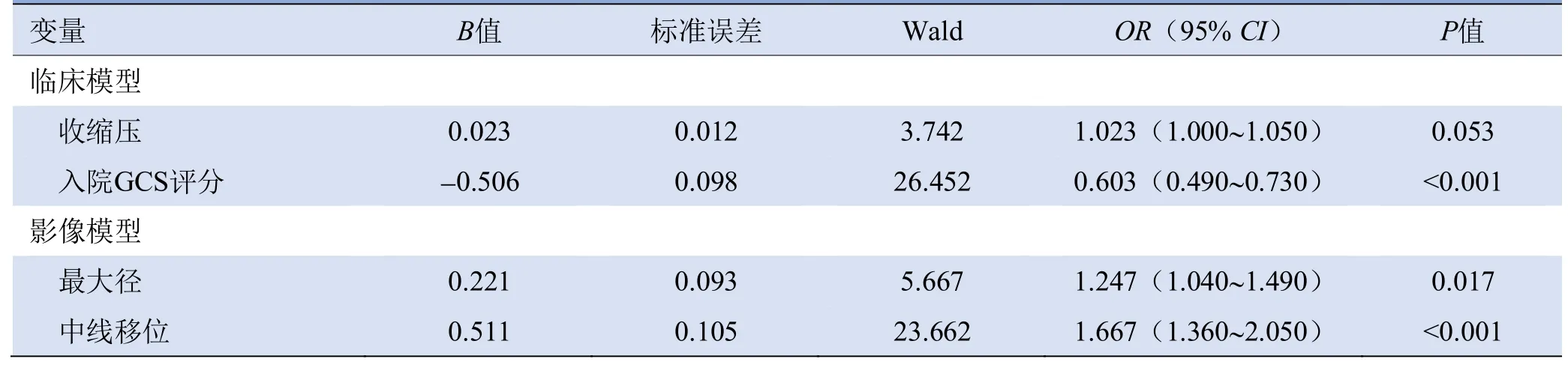
表3 大脑中动脉M1分叉部动脉瘤破裂预后预测模型开发队列中临床危险因素和影像学特征的多因素Logistic回归分析
2.3 模型评价 多因素Logistic回归分析显示,在训练集、验证集中,①临床预测模型:ROC曲线下面积(AUC)分别为0.874、0.861(P=0.269、0.522);②影像预测模型:AUC分别为0.884、0.865(P=0.685、0.109);③联合模型:AUC分别为0.907、0.905(P=0.680、0.622)。见表4、图2。校准曲线图的结果表明,临床联合影像预测模型在训练集和验证集中的一致性较好(图3)。决策曲线分析显示联合模型在训练集和验证集中具有良好的临床运用价值,在训练集和验证集中,3种模型的域概率范围均较广,AUC以联合模型最大,临床净获益率以联合模型最高(图4)。

表4 3种大脑中动脉M1分叉部动脉瘤破裂预后预测模型的效能

图2 训练集(A)和验证集(B)临床预测模型、影像预测模型与联合预测模型的ROC曲线

图3 训练集(A)和验证集(B)临床预测模型、影像预测模型与联合预测模型的校准曲线
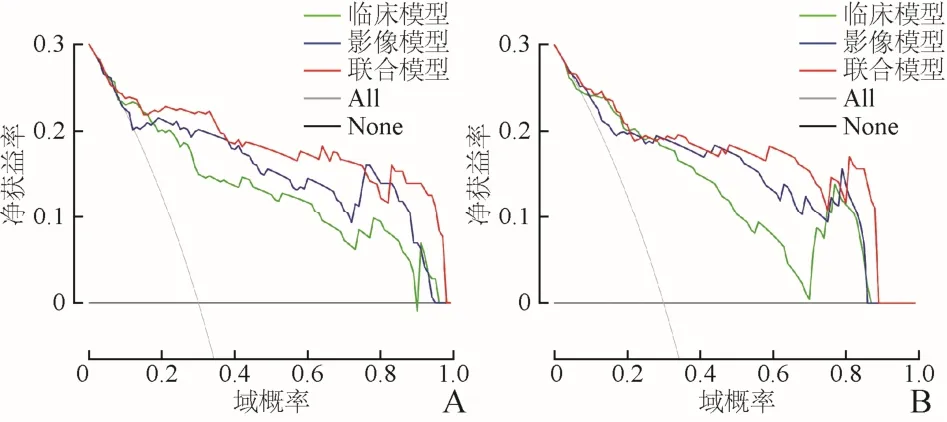
图4 训练集(A)和验证集(B)临床预测模型、影像预测模型与联合预测模型的临床决策曲线
各预测模型的敏感度、特异度、准确度、阳性预测值与阴性预测值见表4。使用列线图将联合预测模型进行可视化,见图5。

图5 联合模型列线图
3 讨论
本研究结果显示入院GCS评分、收缩压、动脉瘤最大径、CT平扫征象中线移位是大脑中动脉M1分叉部动脉瘤破裂出血患者出院时不良结局的独立预测因子。联合模型具有良好的预测性能,在训练集中AUC为0.907,验证集中为0.905。
3.1 本研究与既往研究aSAH预后预测模型的比较动脉瘤破裂出血患者的预后结局受多种因素相互影响。无论临床因素、实验室指标或影像学指标,根据入院时患者的一般情况及临床医师的直觉判断动脉瘤破裂出血的预后仍具有较大挑战;随着精准医学时代的到来,为了消除变量间的混杂因素,临床医师尝试设计可靠的模型评估动脉瘤破裂出血患者的预后情况。近期Jaja等[8]建立了可预测aSAH患者预后的模型,为评估aSAH患者病情发展及预后提供了参考,但其以临床资料作为研究核心内容,忽略了CT平扫征象及动脉瘤形态学的影响;既往大多数报道均将颅内不同位置的动脉瘤放在同一研究中进行综合分析,但由于颅内动脉各主干及分支血管上的动脉瘤在血流动力学及动脉瘤形态学方面存在较大差异,动脉瘤位置会影响aSAH患者的临床病程和死亡率[9]。Xia等[7]开发了一种基于临床因素及CTA动脉瘤形态参数的随机森林机器学习方法建立预测前交通动脉瘤破裂后出院时的预后模型,在训练集、验证集中AUC分别为0.90、0.84,与本研究结果相似;但本研究方法更为简便、实用性更强,同时还可以将模型可视化。
3.2 GCS对aSAH预后的影响 评估预测模型的性能并解释预测因子的临床相关性较为复杂。GCS作为目前最经典、最常用的昏迷评分,是国际通用的客观评价脑功能障碍和昏迷严重程度的方法,用于评估出血患者的意识水平及预后[7,10],量化指标少,简单、方便记忆、使用广泛。既往研究报道GCS评分3个组成部分的评分者间信度均较好[11],本研究结果显示GCS评分对动脉瘤预后具有较好的预测价值。
3.3 高血压对aSAH预后的影响 在动脉瘤生长和破裂的发展进程中[12],高血压会加剧动脉瘤血流动力学紊乱、介导或促进血管壁发生炎症反应[13],本研究发现训练集和验证集大脑中动脉M1分叉部动脉瘤破裂出血患者既往有高血压病史者约占50%。McGurgan等[14]报道血压升高与aSAH风险呈正相关,收缩压基线每升高10 mmHg或舒张压压力升高5 mmHg,aSAH风险增加20%。另外,高血压可影响aSAH的功能预后[15],包括初次出血量、再次出血的可能性、并发症发生率等。合并高血压的aSAH患者动脉瘤壁会承受更高的血管内压力,出血后短时间内形成的纤维血凝块不能很快封堵破裂口,而且高收缩压患者发生再次破裂的概率较无高血压者更高[16]。同时,严格控制高血压可进一步改善aSAH患者的长期预后[17]。
3.4 动脉瘤大小对aSAH预后的影响 本研究纳入的12种动脉瘤形态学参数中,除动脉瘤最大径外,其余参数均不是大脑中动脉M1分叉部动脉瘤破裂预后不良的独立风险因素。动脉瘤大小是影响颅内动脉瘤破裂风险的重要形态学参数之一,动脉瘤越大,其破裂的风险越大[18]。Zhang等[19]研究显示动脉瘤大小是影响患者预后的不良因素,Morgan等[20]对263例大脑中动脉瘤手术患者的资料进行回顾性分析发现,手术风险与动脉瘤大小呈正相关,动脉瘤直径<7 mm者手术不良预后率为2.8%,而>25 mm者手术不良率为15%,说明动脉瘤大小能影响手术预后。另外,大脑中动脉大动脉瘤(≥10 mm)或巨型动脉瘤(≥25 mm)因其复杂的血管结构、管腔内血栓、宽颈和梭形等特征,治疗难度较大,故此类患者的临床预后结果更差[21]。
3.5 中线移位对aSAH预后的影响 中线结构发生移位表明颅内压力梯度过大超出自身代偿能力,脑组织向低压侧偏移;移位程度继续进展则将演进为脑疝,一旦出现脑疝,患者预后常不良,因此中线结构偏移程度能为临床病情进展提供一定依据。本组中线结构移位的患者相对于无中线移位的患者,预后良好率明显降低。
3.6 本研究局限性 ①作为回顾性研究,临床结果评估及动脉瘤测量可能存在偏倚及误差;动脉瘤破裂前后的大小可能会存在变化,然而,也有研究报道颅内动脉瘤破裂后形态不会改变[22];②仅对大脑中动脉M1分叉部进行研究,结果可能不适用于其他动脉瘤位点;③动脉瘤破裂再出血的发生以及术后并发症可能会对临床病程产生影响;④预后随访时间点仅针对出院时的短期结果,未评估长期临床结果;⑤仅涉及重庆市、遵义市的患者,可能会限制推广到其他区域。本研究根据入院时临床资料、CT平扫征象以及CTA动脉瘤形态学相关特征建立的大脑中动脉M1分叉部动脉瘤破裂出血预后的列线图预测模型能够较准确地判断患者临床结局。

