水体氨基甲酸酯类农药总量快速检测方法
郜洪文, 肖春红
(同济大学 环境科学与工程学院,上海 200092)
CMs通常被用作杀虫剂、杀菌剂和除草剂等,因其特殊的性质,如较低的生物富集潜力和短期毒性[1],使用量逐年增加,在水体中出现的频率也不断上升[2]。CMs可以通过多种途径侵入人体,分布在人体的肌肉组织、肝、脂肪和肾中[3],据报告,每年有25万~37万人受到农药残留的危害[4]。目前常用的CMs残留检测方法包括色谱法和快速检测方法,色谱法包括气相色谱、气相色谱-质谱联用、高效液相色谱等,灵敏度高,但前处理复杂、检测成本高、耗时长,对技术人员要求高,难以应用于实时和现场检测[5-6],特别是在缺乏专业人员和设备的农产品市场或基层单位;快速检测方法主要包括酶抑制法[7]、免疫分析法[8]、传感器法和光谱分析法[9],大多停留在实验室研究阶段,难以投入到实际的生产和使用中。
通过对5种CMs(西维因、抗蚜威、灭虫威、硫双灭多威和丙硫克百威)快检方法的研究,本文提出了一种简单、准确的水体中CMs残留总量快速检测技术,开发了长效快速检测试剂,配合便携式水质检测仪,便于基层和现场农残快速检测工作的开展。
1 实验部分
1.1 仪器与试剂
VM-500Pro型数显多功能混匀仪(群安实验仪器有限公司);HWS-11型电热恒温水浴锅(上海尚道仪器制造有限公司);S-4100型紫外可见分光光度计(韩国Scinco公司);GE Lab01型多功能分析检测仪(上海绿帝环保科技有限公司,见图1);Agilent 7 890/5 975C GC/MSD(安捷伦科技有限公司)。试剂如下:

图1 多功能分析检测仪Fig.1 Multifunctional analysis detector
(1)甲胺标准储备液(500 mg·L-1):27.2 mg甲胺盐酸盐溶于去离子水并定容至25 mL。
(2)CMs标准储备液(1 g·L-1):0.025 g农药溶于乙醇并定容至25 mL。
(3)混合农药标准储备液(3.47 mmol·L-1):分别取2.53 mL西维因、2.94 mL抗蚜威、2.75 mL灭虫威、4.38 mL硫双灭多威和5 mL丙硫克百威标准储备液,混合均匀。
(4)(甲胺、CMs、混合农药)标准使用液:用去离子水将标准储备液稀释100倍。
(5)CMs检测剂A:30 g碳酸氢钠和0.5 g次氯酸钠混合,烘干制成胶囊;检测剂B:亚硝酸钠烘干制成胶囊;检测剂C:称取0.4 g可溶性淀粉和0.2 g硼酸,加去离子水调成糊状,加100 mL煮沸的热水溶解,冷却后加入1 g KI,继续煮沸5 min,冷却澄清,取上清液。
二氯甲烷(农残级)、乙醇(ACS)、乙二醇(GC)、甲胺盐酸盐(98%)、碳酸氢钠(GR)、碘化钾(分析纯)、氢氧化钠(分析纯)和西维因(97%)购于上海阿拉丁生化科技股份有限公司;亚硝酸钠、可溶性淀粉和硫酸购于国药集团化学试剂有限公司,均为分析纯;次氯酸钠(90% 河南省蓝天化工有限责任公司)。所有溶液和检测剂均储存于冷藏箱(4℃)。
1.2 实验方法
取25 mL水样,加入5 mL二氯甲烷,3 000 r·min-1条件下涡旋萃取30 s,静置5 min,取出4 mL下层萃取液于消解管中,滴加4滴乙二醇,连接导气管,另一端置于盛有去离子水的消解管中,100℃条件下,利用智能消解仪蒸发浓缩6—8 min,直至导气管口无气泡冒出,随后加入2 mL去离子水和8滴2 mol·L-1NaOH,拧紧管盖,100℃条件下加热10 min,待反应液冷却后,将其倒入显色瓶中,滴加8滴1 mol·L-1H2SO4,用去离子水定容至5 mL,依次加入CMs检测剂A(反应5 min)、B(反应5 min)和C(反应5 min,10 min内完成测定),显色完成后,利用便携式水质检测仪测定显色结果。
1.3 GC-MS检测条件
(1)色谱条件(Agilent 1 9091J-433: 5 430.75 677;HP-5 5% Phenyl Methyl Siloxan;30 m × 250 μm×0.25 μm):进样口温度:250℃;载气:高纯度的氦气,流速为1.5 mL·min-1;压力:11.962 psi;采用手动进样,进样模式为脉冲不分流;进样量:1 μL;升温程序:初始温度为40℃,保持2 min,然后以20℃·min-1升温至270℃,保持7 min;运行时间:20.5 min。
(2)质谱条件:溶剂延迟时间:5 min;质谱接口温度:270℃;离子源温度:230℃;四级杆温度:150℃;EMV模式为相对的;采集模式:Scan/SIM,全扫描(低质量数:50.0;高质量数:450.0;阈值:150)。
1.4 矢量色度法简介
矢量色度法依据色空间概念,将由RGB颜色空间表示的显色体系转换为Lab色彩空间表示的测量值,从而依据矢量色度模型计算测量液的矢量色度值[10-12]。基于矢量色度法所研发的便携式水质检测仪无分光系统,不需要设置波长,具有便携和易于操作等优点。
2 结果与讨论
2.1 显色反应条件影响
2.1.1 吸收光谱
配制0.3 mg·L-1甲胺标准溶液,依次加入检测剂A、B和C,显色完成后,测定显色体系吸光度值,结果表明,显色溶液在585 nm左右有最大吸收峰,故本研究测定显色体系在585 nm处的吸光度值。
2.1.2 NaClO用量
加入0.1~0.5 mL质量百分浓度为0.012 5%的NaClO溶液,测定0.3 mg·L-1甲胺标准溶液显色后的吸光度值,结果表明:当NaClO溶液加入量为0.25 mL时,显色体系吸光度值达到最大。NaClO溶液不稳定,易变质,结合现有研究结果[13-15],检测0.4 mg·L-1甲胺和相同物质的量浓度的二甲胺和三甲胺,分别需加入0.23、0.08和0.25 mL质量百分浓度为0.5%的NaClO溶液,为保证CMs碱解产物反应完全,本实验选择加入0.25 mL 0.5% NaClO溶液。
2.1.3 NaNO2用量
加入0.1~1.0 mL质量百分浓度为30%的NaNO2溶液,测定0.3 mg·L-1甲胺标准溶液显色后的吸光度值。结果表明:当NaNO2溶液加入量小于0.5 mL时,显色体系吸光度保持稳定,继续增大加入量,吸光度出现小幅度下降,亚硝酸钠能与甲胺的氯代衍生物发生反应。本研究选择加入0.5 mL 30% NaNO2溶液,排除水中氧化性物质的干扰。
2.1.4 KI-淀粉溶液用量
加入0.05~0.50 mL KI-淀粉溶液,测定0.3 mg·L-1甲胺标准溶液显色后的吸光度值。结果表明:当KI-淀粉溶液加入量为0.20 mL时,吸光度值达到最大,I-加入过多会导致显色体系颜色偏紫,最大吸收峰的位置发生偏移。本实验选择加入0.20 mL KI-淀粉溶液。
2.1.5 显色反应时间
分别配制5 μg·mL-1西维因、5.9 μg·mL-1抗蚜威、5.6 μg·mL-1灭虫威、8.8 μg·mL-1硫双灭多威和10 μg·mL-1丙硫克百威标准溶液,测定不同显色时间得到的显色溶液的吸光度,结果表明5种CMs碱解产物最佳显色时间分别为9、3、5、5和5 min,故实验选取显色反应时间为5 min,且需在10 min内完成测定。
2.2 萃取条件影响
分别将50 μL西维因、20 μL抗蚜威、0.1 mL灭虫威、20 μL硫双灭多威和0.2 mL丙硫克百威标准储备液加入25 mL去离子水,加入5 mL二氯甲烷,涡旋提取5—60 s,分别测定萃取液在282、250、267、280、231 nm处的吸光度值,计算萃取率,得图2。结果表明:涡旋时间为30 s时,5种农药的萃取率均大于90%,因此本研究选取涡旋时间为30 s。

图2 涡旋时间对萃取率的影响Fig.2 Effect of vortex time on extraction rate
2.3 蒸发浓缩条件影响
5 mL CH2Cl2中分别加入50 μL西维因、12 μL抗蚜威、0.1 mL灭虫威、18 μL硫双灭多威和20 μL丙硫克百威标准储备液,加入0~0.5 mL乙二醇,蒸发浓缩完成后(丙硫克百威回收率需通过显色反应表征),分别测定样品溶液在280、245、262、236和585 nm处的吸光度,计算回收率,得图3。结果表明:一定范围内,乙二醇的加入能够提高抗蚜威和灭虫威的回收率,加入量过多会降低显色反应灵敏度,故本实验选取添加0.1 mL乙二醇,5种CMs的回收率均高于80%。

图3 乙二醇加入量对回收率的影响Fig.3 Effect of the amount of ethylene glycol on the recovery rate
2.4 碱解条件影响
2.4.1 NaOH用量
分别配制5 μg·mL-1西维因、5.9 μg·mL-1抗蚜威、5.6 μg·mL-1灭虫威、4.4 μg·mL-1硫双灭多威和10 μg·mL-1丙硫克百威标准溶液,分别加入0.025~0.250 mL物质的量浓度为0.01、5、0.01、0.01和1 mol·L-1NaOH溶液,灭虫威在室温(20℃)条件下碱解,其余4种农药在100℃水浴加热条件下碱解,分别测定西维因、抗蚜威和丙硫克百威碱解产物在333、290和290 nm处的吸光度,通过显色反应间接表征灭虫威和硫双灭多威碱解情况。结果如图4所示,加入0.2 mL 2 M NaOH,5种CMs均能实现完全碱解。

图4 NaOH加入量影响Fig.4 Effect of sodium hydroxide dosage
2.4.2 碱解时间
控制2 M NaOH加入量为0.2 mL,CMs标准溶液物质的量浓度设置同NaOH用量实验,100℃水浴加热条件下碱解,测定碱解不同时间得到的样品溶液的吸光度,结果如图5所示。结果表明:100℃水浴加热条件下碱解10 min,5种CMs均能完全碱解。本实验选取碱解时间为10 min。
2.5 标准曲线与检出限
配制物质的量浓度梯度为0、1.61、3.22、6.44、9.66、12.88 μmol·L-1混合农药标准使用液,进行碱解和显色反应,测定显色体系矢量色度值,将物质的量浓度换算为25 mL水中对应的物质的量浓度,以其为横坐标,矢量色度值为纵坐标,绘制标准曲线,得图6,利用二次多项式对数据进行拟合,得到标准曲线方程为y=0.233x2+17.6x-0.012 5(R2=1.00)。

图6 标准曲线Fig.6 Standard curve
用去离子水配制0.8和2.4 μmol·L-1CMs混合标准溶液,经萃取、蒸发浓缩、碱解和显色后,测定显色结果,每个加标浓度平行测定6次,计算得到RSD分别为2.86%和1.61%。取25 mL去离子水,重复上述步骤,平行测定21次,计算得到标准偏差Sb为0.417 9,依据IUPAC方法,LOD为0.07 μmol·L-1。
2.6 共存离子与物质影响
配制2.4 μmol·L-1CMs混合标准溶液,加入干扰物质(具体如表1所示),经过萃取、蒸发浓缩、碱解和显色,测定显色体系吸光度值,测定误差在 ±10%以内,表明表中所列物质不影响CMs的显色测定。
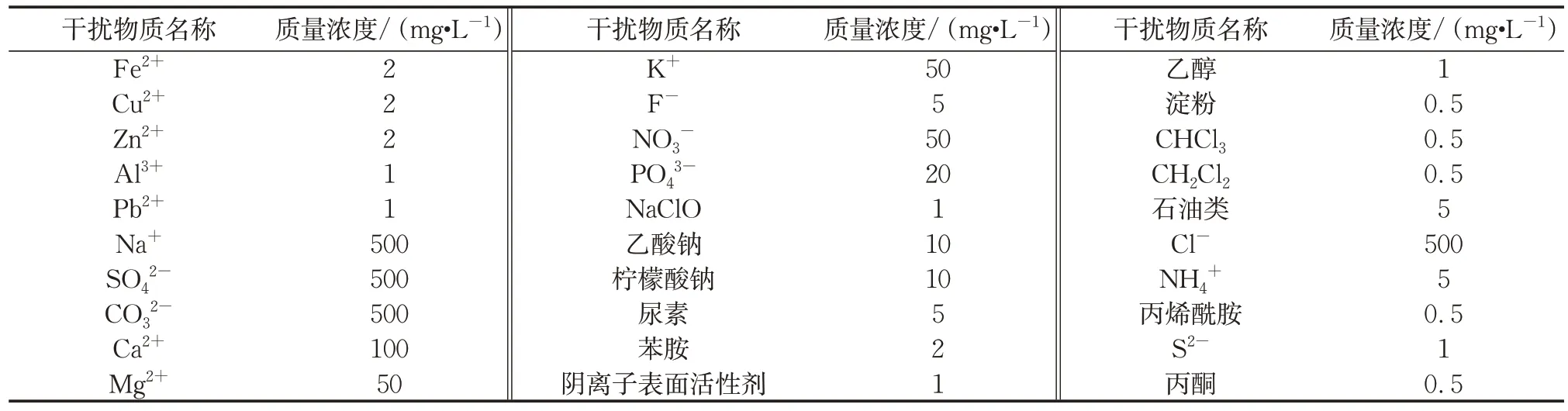
表1 干扰物质名单及浓度Tab.1 List and concentration of interfering substances
2.7 实际水样分析
取苏州河、太浦河和淀山湖水样进行实际水样CMs残留量分析和加标处理,加标物质的量浓度为2.4 μmol·L-1,检测所得结果如表2所示。结果表明:矢量色度法测定结果更加接近加标值。
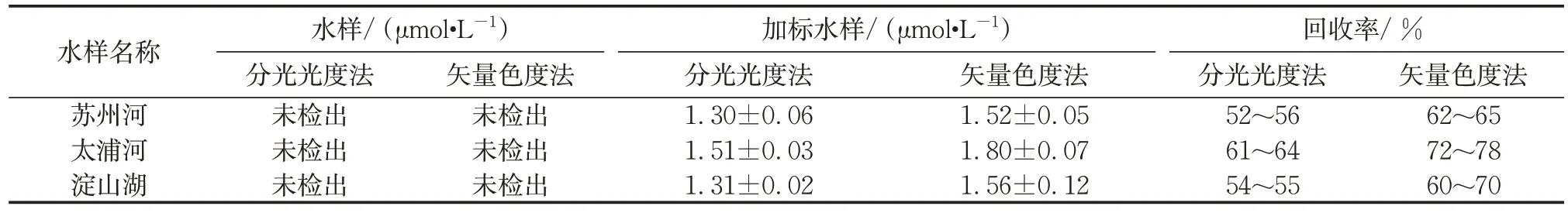
表2 实际水样和加标水样CMs测定结果Tab.2 CMs detection results of real water samples and spiked water samples
对太浦河单独加标,加标物质的量浓度为0.2 μmol·L-1,利用本研究建立方法和GC-MS方法进行测定,所得结果如表3所示。结果表明:矢量色度法测量值偏小,源于检测分析过程中CMs的损失,如蒸发浓缩过程,综合考虑,矢量色度法与GC-MS检测值具有较高的一致性。

表3 太浦河加标水样CMs检测结果Tab.3 CMs detection results of spiked water samples from Taipu River
3 结论
在分光光度法的基础上,利用矢量色度法,配合本实验室研发的多功能分析检测仪,建立了水体中CMs残留总量的快速检测方法,RSD为2.86%(0.8 μmol·L-1CMs)和1.61%(2.4 μmol·L-1CMs),LOD为0.07 μmol·L-1,检测一个水样仅需40 min,具有高效、成本低、易于操作等优点,便于基层单位和现场农残检测的开展,对操作人员的要求较低,仪器小巧轻便,无需复杂的日常维护工作。
作者贡献声明:
郜洪文:研究设计与开展,论文撰写与修改;
肖春红:研究开展,论文撰写,资料收集。

