基于真实生活情境的酸碱盐主题式复习课
——以“碱性电池中的化学”为例
张 静
(苏州工业园区金鸡湖学校 江苏 苏州 215000)
一、教学设计背景及教学现状分析
1.教学设计背景
本课题是对沪教版九年级化学第七章“应用广泛的酸、碱、盐”的复习提升。在《义务教育化学课程标准(2011 年版)》中[1],将“应用广泛的酸、碱、盐”这一内容归于“身边的化学物质”一级主题之下,要求引导学生认识一些常见酸碱盐的主要性质和用途,帮助学生了解它们对人类生活的影响,体会化学对人类生活的重要意义。实际教学过程中,该章节也是重点难点集中的章节,涵盖了物质的性质、用途、酸碱盐及氧化物间的转化、基础实验探究等内容,学生往往感到知识零碎、庞杂,面对实验探究问题无从下手等。因此教师往往会围绕这一章节进行系统复习。传统的复习课通常按照“基础知识梳理—重难点归纳—习题巩固”的教学模式进行展开[2],仍然以教师的“教”为中心,难以调动学生思考的积极性,导致复习效率低下,也很难使学生体验到问题探究的价值与意义。如何在复习阶段打通章节壁垒,构建知识体系,而又避免传统复习课程中的“炒冷饭”?主题式复习是一种较好的复习策略。通过选择合适的主题,创设学科相关的情境,激发学生学习的兴趣与愿望,让学生在情境中重温旧经验,获得新经验,并运用所学知识解决实际问题,发展应用能力,提升科学素养。
2.教学现状分析
主题式复习要求教师注重从日常生产生活中选取合适的主题,从化学学科与生活、社会的结合点入手创设真实的情境。实践证明,只有当学习内容被设置在该知识的社会和自然环境中时,有意义的学习才可能发生,所学的知识才易于迁移到其他环境中去再应用。以“酸碱盐*复习”为关键词在知网搜索,目前常见的酸碱盐复习情境素材主要如表1所示。

表1 酸碱盐复习课情境素材
分析现有教学设计,存在以下问题值得关注:(1)日常生产生活中蕴含着丰富的化学知识,但经由教师提取开发的生产生活类情境素材种类仍较少;(2)在一些主题式复习课中,以情境为引后,仍以纯粹知识性教学为主,缺少与生活、生产、环境、社会等的联系,学生较难体会到化学知识的价值和意义。基于此,本课题发掘了碱性电池中的化学这一新的教学情境开展主题式复习,由电池表面出现的白色固体产生疑问,引导学生用化学知识分析这一现象,借此展开对漏液成分、电池废液及固体废弃物处理、电池金属资源回收等一系列问题的探究,具有一定的创新性与实用性。学生在此过程中学会用化学的视角观察生活,感受化学的学科价值。
二、教学目标
本课题选择“碱性电池中的化学”为主题,尝试以碱性干电池为学习情境开展酸碱盐主题式复习,实现以下教学目标:
(1)将酸碱盐等物质的性质与电池知识相结合,让学生在复习化学知识的同时知道碱性干电池相关知识,激发学习兴趣,拓展视野;
(2)通过探究电池的“漏液”是否变质及其变质程度等活动,了解探究物质成分的一般思路,能利用所学物质的性质进行检验,初步学会设计方案并能完成相关实验操作;能归纳酸碱盐相关性质,自主构建知识网络;
(3)通过处理废弃电解液及回收废旧碱性干电池等活动,认识到化学在保护环境、节约资源方面作出的贡献,树立珍惜资源、爱护环境及合理使用化学物质的意识;了解电池研究新进展和瓶颈,树立为民族复兴和社会进步学习化学的志向。
三、教学重难点
教学重点:(1)知道碱性电池的基本结构及其漏液现象;(2)能设计方案探究碱性电池“漏液”是否变质及变质程度,并完成相关实验操作,掌握探究物质成分的一般思路。
教学难点:选择合适的试剂探究碱性电池漏液后析出固体的变质程度。
四、教学流程(见表2)
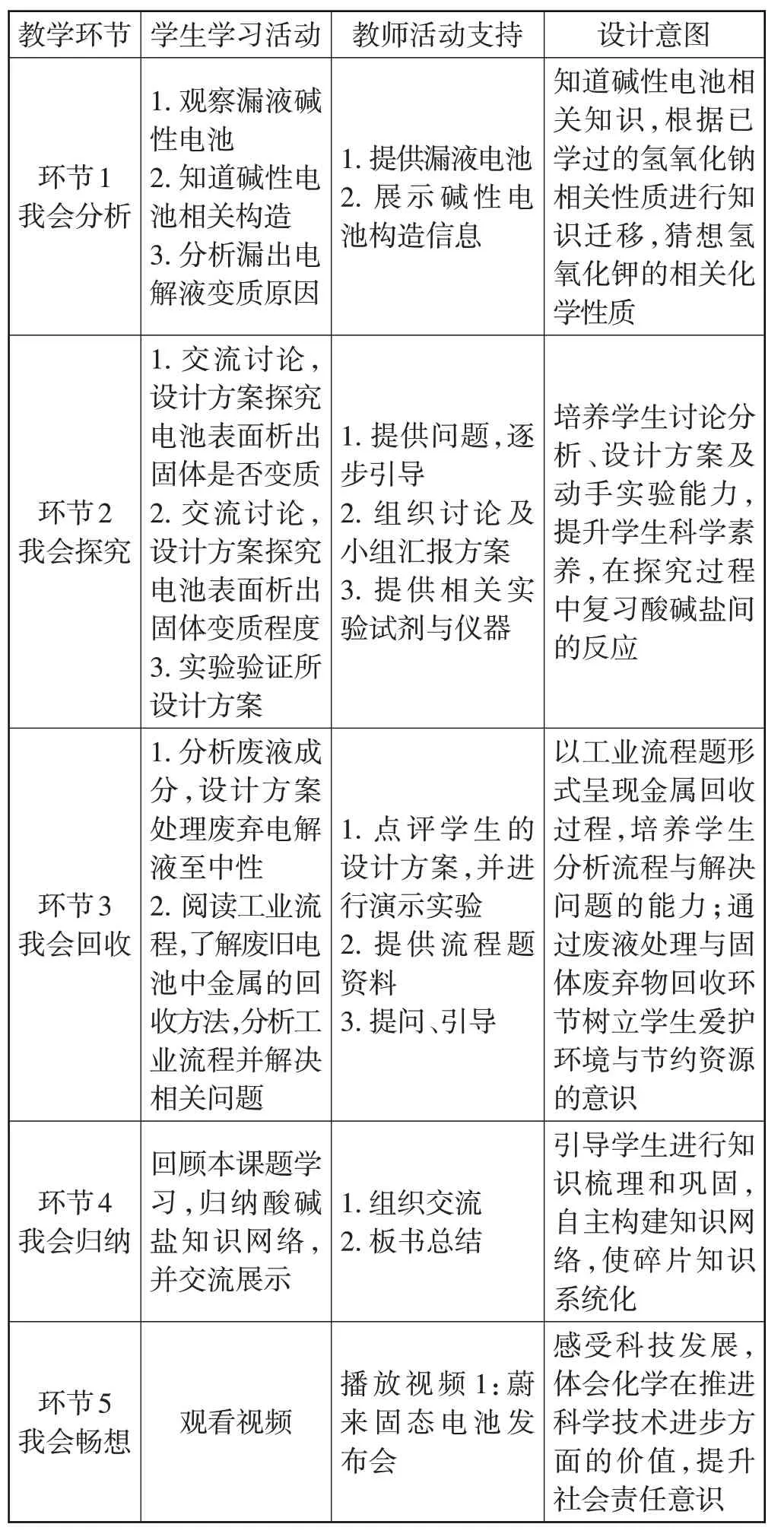
表2 教学流程
五、教学实录
1.分析碱性电池的漏液现象
【教师】随着社会的发展,干电池早已成为我们生活中不可缺少的日用品之一。老师在前几天取用干电池的时候,却发现了这样的现象(图1)。同学们第一反应是想做什么?

图1 碱性电池的漏液现象
【学生】扔掉;用手摸一摸……
【教师】对于未知物质我们要确定其成分才能判断是否能直接用手触摸。老师观察电池的外部包装,发现上方印有“碱性干电池”字样。同学们觉得为什么叫作碱性干电池呢?
【学生】可能是它内部含有碱性物质。
【教师】是否如大家所想呢?老师又进一步查阅了碱性电池相关资料,我们一起来看一下。
【多媒体】展示碱性电池资料(图2)。
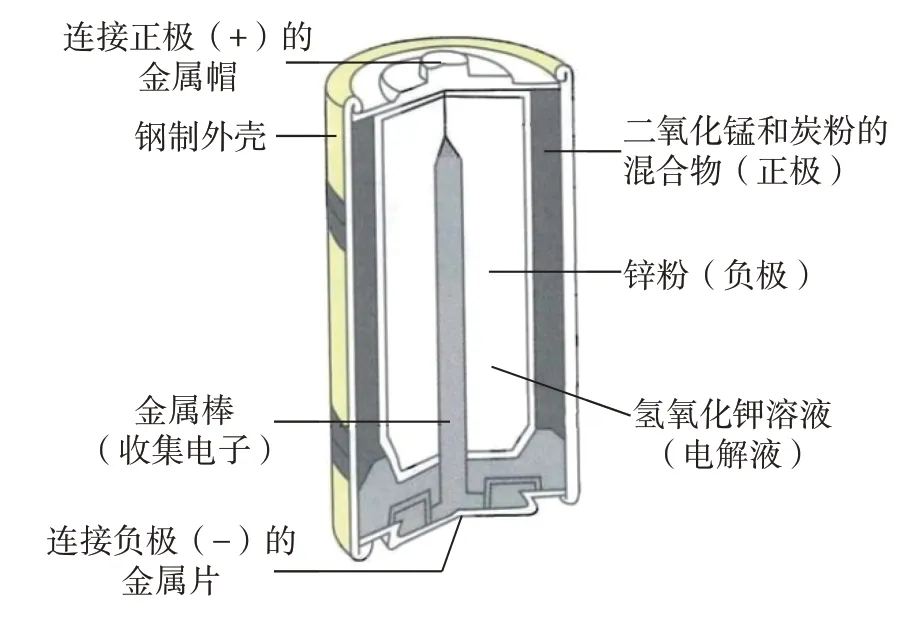
图2 碱性锌锰电池构造示意图
【教师】同学们的猜想很正确。我们一起来看一下,碱性电池又叫作碱性干电池,它的正极材料是二氧化锰,负极材料是锌,中间填充着氢氧化钾作为电解液,用于帮助导电。通过锌和二氧化锰之间发生化学反应,将化学能转变成电能。又叫作锌锰电池,是锌锰电池中性能最优异的品种。
【教师】但是电池外部怎么会出现固体物质呢?
【学生】有些电池会漏液。
【教师】那么你觉得这个固体是什么物质呢?
【学生】KOH。
【教师】还有别的可能吗?
【学生】KOH有可能变质了,还有K2CO3。
【教师】确实,氢氧化钾与氢氧化钠的性质相似,请同学们在学案上写出氢氧化钾变质的化学方程式。
【学生】书写化学方程式:2KOH+CO2==== K2CO3+H2O
2.探究碱性电池表面析出固体的成分
【教师】那我们如何设计实验确定KOH 是否变质呢?我们一起来分析一下,检验氢氧化钾是否变质其实就是检验其中有哪种物质?
【学生】K2CO3。
【教师】因此我们选择试剂的依据是什么?
【学生】该试剂能与K2CO3反应有明显现象。
【教师】同学们的思路是正确的,请大家讨论实验方案。
【学生1】加稀盐酸观察是否有气泡。
【教师】你利用的性质是?
【学生1】K2CO3是碳酸盐,若存在K2CO3,则会与盐酸反应产生CO2。
【教师】这位同学分析得十分到位。那么老师想问你对加入盐酸的量有没有要求?
【学生1】应该加足量稀盐酸,因为可能还有未变质的NaOH,盐酸优先与NaOH反应看不到明显现象。
【教师】这位同学考虑得很全面。还有其他方案吗?
【学生2】加入Ca(OH)2溶液,若产生白色沉淀则已变质。
【教师】这位同学想到了盐能与某些碱反应,很好。这里对Ca(OH)2溶液加入的量是否有要求?
【学生2】没有。
【教师】还有其他小组有不同的方案吗?
【学生】加入CaCl2溶液,若产生白色沉淀则已变质。
【教师】这组同学想到了加入盐溶液。除了CaCl2溶液是否还有别的盐溶液?
【学生3】还可以选择BaCl2溶液。
【教师】是的,BaCl2也能与碳酸钾反应产生白色沉淀。你觉得相比而言BaCl2溶液和CaCl2溶液哪种更适合?为什么?
【学生3】BaCl2溶液。因为CaCl2溶液和KOH结合会形成微溶于水的Ca(OH)2,干扰对K2CO3的检验。
【教师】非常好。同学们利用了盐能和酸、碱以及某些盐反应的性质,设计了各自的方案。记得我们还探讨过盐类物质溶液的酸碱性。碳酸钾溶液呈什么性?
【学生】碱性。
【教师】能否利用指示剂检验溶液的酸碱性来判断有无K2CO3?
【学生】不可以,因为氢氧化钾溶液也呈碱性。
【教师】非常好。接下来请同学们分别按照所设计的三种方案进行实验,探究我们面前的这份漏出电解液是否变质,并完成学案。
【学生】分组实验。
【教师】请同学们汇报你们的实验结果(图3)。

图3 学生学案示例
【学生】加入足量盐酸后观察到气泡,加入Ca(OH)2溶液和BaCl2溶液后观察到沉淀,说明已变质。
【教师】可见各组同学手中的KOH 均已变质。那么,同学们是否好奇,这些固体是否完全变质了呢?你觉得有哪些可能性?
【学生】可能只是部分变质,固体中有KOH 和K2CO3,也可能已经全部变质,则固体中只有K2CO3。
【教师】我们想要检验是否完全变质其实是想检验还有哪种物质的存在?从微粒的角度来说是想检验哪种离子的存在?
【学生】氢氧化钾,OH-。
【教师】请同学们根据老师提供的资料设计方案。
【学生】小组讨论,并试着设计实验方案。
【教师】我们发现碳酸钾的存在对于氢氧化钾的检验是干扰,因此应该先除去K2CO3。问题又回到选择合适的试剂与K2CO3反应。刚才我们所探讨的三类试剂是否均可行呢?能否用盐酸除去K2CO3?
【学生】不可以,因为盐酸也会与KOH 反应,把可能存在的KOH反应掉。
【教师】确实,那么能否用Ca(OH)2溶液呢?
【学生】不能用氢氧化钙,因为Ca(OH)2会和K2CO3反应产生KOH。
【教师】同学们注意到了,选择Ca(OH)2溶液会引入KOH,无法证明原固体物质中是否含有KOH。那么能否选择BaCl2溶液呢?
【学生】可以。既能除去K2CO3又不会干扰对KOH的检验。
【教师】请同学们在学案上完善实验方案。
【学生】完成实验方案(图4)。

图4 学生实验方案示例
【教师】同学们的方案上还应注意细节,为了除尽溶液中的K2CO3,所加BaCl2溶液的量应该如何?
【学生】过量。
【教师】是的,我们不仅要关注试剂的种类,还要关注试剂的用量。当我们除尽K2CO3后,再对滤液进行检验,这一步的目的是什么?
【学生】检验滤液中有无KOH。
【教师】同学们想到用什么试剂呢?
【学生】向滤液中滴加酚酞,若变红,则含KOH,固体部分变质。
【教师】这位同学想到利用KOH 溶液的碱性,还有别的方案吗?
【学生】也可以加入CuSO4溶液,若有蓝色沉淀则部分变质。
【教师】很好。同学还想到了利用某些盐和碱反应可以产生明显现象来检验。请同学们动手实验,探究析出固体的变质程度究竟如何。
【学生】实验,得出现有的析出固体均为部分变质。
【教师】老师有个问题,在同学们刚才的实验过程中,是如何确定BaCl2溶液已过量呢?
【学生】加BaCl2溶液到不再产生沉淀为止。
【教师】同学们真的看到不再产生沉淀了吗?大家手中应该是一份比较浑浊的悬浊液,如何清楚地看到有无沉淀继续产生呢?
【学生】疑惑。
【教师】我们往往会先静置一段时间,然后向上层清液中继续加BaCl2溶液,观察是否有沉淀继续产生。请同学们看老师的演示实验。
【多媒体】教师拍摄的演示实验视频。
(视频链接:https://v.youku.com/v_show/id_XNTE 2MjcxMzMwNA==.html;视频密码:123456)
3.废液及废弃碱性电池的处理
【教师】经过同学们的努力,我们发现电池上析出的固体已经部分变质。由于其水溶液是碱性的,我们往往不能直接排放,而要将其处理至中性后再排放,这又该如何处理呢?
【学生】向其中加入盐酸。
【教师】会涉及哪些反应,请同学们在学案上书写反应的化学方程式。
【学生】KOH+HCl==== KCl+H2O; K2CO3+2HCl====2KCl+H2O+CO2↑。
【教师】如何确定废液已经处理至中性呢?
【学生】可以测定溶液的pH。
【教师】是的,而且为了防止加酸过量,我们往往会边加酸边测定溶液pH,实现实时监测。
【教师】漏液后的干电池如果继续使用也会腐蚀电子器件,对于干电池这类固体废弃物,我们应该投放至哪一类垃圾桶呢?
【学生】其他垃圾。
【教师】是的,同学们可以看它的外包装,此类电池因为不含汞,我们将其投放至其他垃圾即可。那么,这些废弃的干电池是否毫无用处了呢?对,我们还能回收其中的金属、MnO2等物质。这就是一种回收电池金属的方案,请同学们利用所学知识完成方案中的一些问题。
【学生】解决从电池中回收金属铜的相关问题(图5)。

图5 从电池中回收金属铜的工艺流程
4.归纳酸碱盐知识网络
【教师】同学们,在今天认识碱性电池的过程中,涉及到了哪些酸碱盐的知识呢?同学们可以回顾自己所写的化学方程式,试着用思维导图归纳酸碱盐之间的相关性质。
【学生】完善思维导图(图6)。
图6 酸碱盐思维导图
5.畅想电池技术的发展
【教师】人类从未停止对电池技术的探索,例如我国的汽车公司蔚来发布了他们关于固态电池的畅想,我们一起了解一下。
【多媒体】剪辑视频:蔚来固态电池发布会。
(视频链接:https://v.youku.com/v_show/id_XNTE2 MjcxNDExNg==.html;视频密码:123456)
【教师】当然目前很多技术仍然只是一种概念,还有很多技术难题需要攻克。希望同学们学好化学知识,将来为社会贡献自己的一份力。
六、教学效果与反思
本节课从生活中常见现象之漏液的碱性电池入手,将对漏液成分、碱性废液的处理、金属回收等问题的探究置于实际生活情境中,激发了学生兴趣,让学生能运用所学知识解决实际问题,有助于学生感受化学在生活中的价值。在探究过程中,学生大胆猜想、设计方案、实验验证,初步掌握了探究问题的一般思路。探究完成后,与学生共同梳理多个探究环节中用到的酸碱盐知识,自主绘制思维导图,构建该章节知识网络,完成对酸碱盐知识的复习。从课堂效果看,学生专注力与听课效率明显高于传统复习课,既复习了相关化学知识,又初步了解了碱性干电池,感受到了化学在科技进步中的贡献,学科素养得以提升。

