微波辅助双水相提取百合多糖的工艺优化及其结构表征
田艳花,杨兆艳,罗爱国,张 玲,张立伟
(1.山西药科职业学院食品工程系,山西太原 030031;2.晋中学院生物科学与技术系,山西晋中 030619;3.山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室,山西太原 030006)
百合属于百合科植物卷丹(Lilium lancifoliumThunb)的肉质鳞片,它是卫生部批准的首批药食同源的产品之一。在我国的宜兴、莱阳、湖州、隆回、万载和兰州等地被广泛种植,其中湖州百合具有“太湖人参”的美誉[1]。据中药产业大数据平台统计在2021 年百合产量3 万吨,并预计2025 年超过8 万吨。因此,对百合深加工具有广阔的市场前景和利润空间。大量研究表明百合中富含多糖、生物碱、皂苷、膳食纤维、果胶和各种维生素等活性成分[2]。因此,百合具有很高的医学和药用价值,备受人们的喜爱。多糖是百合中最重要的活性成分之一,一般其含量在9%左右。大量研究已经证实百合多糖具有多种生物学活性,如抗氧化、抗肿瘤、调节免疫和抗衰老等[3-5]。百合多糖的高效提取是其开发和利用的最关键步骤。因此,寻找绿色高效的提取方式至关重要。
目前,针对天然多糖的提取主要采用传统的热水提取,该方式具有提取操作简单、无需特殊设备和提取成本较低等优点,但热水提取存在提取效率低和耗时长等缺点[6]。因此,该方式不适合大规模提取天然多糖。随着提取技术的不断发展,一些先进的提取技术被应用于天然多糖的提取当中。如超声辅助提取、微波辅助提取和超高压辅助提取等先进的方式。其中超声辅助提取利用超声产生的空化效应加速植物细胞壁的破裂,强化多糖的提取[7]。但该方式的机械振荡易造成多糖中糖苷键的断裂,不利于多糖的提取。微波辅助提取也可以破裂植物细胞壁,达到强化提取多糖的目的[8]。目前,微波辅助提取技术已成功地从橘皮[9]、莲子心[10]、刺梨[11]和板栗[12]中提取多糖。超高压辅助提取也可降低细胞内多糖的传质阻力,实现强化提取多糖的目的[13]。该方式提取效率高,但该方式提取成本较大,设备投入要求较高。因此,超高压辅助提取没有被大规模用于工业化提取天然多糖。随着科学技术的发展,提取技术也有了新的突破。近年来双水相提取技术作为具有发展潜力的绿色的提取技术在天然产物中已受到越来越多的关注。该技术提取成本较低、效率高、可以连续化提取天然活性成分[14]。因此,双水相提取技术已被成功用于天然多糖、多酚和总黄酮等活性成分的提取[15-17]。将微波提取与双水相提取相结合形成微波辅助双水相提取法(Microwave assisted aqueous twophase extraction,MATPE),该方式更有利于多糖的提取,同时可以一步完成多糖的提取和初步纯化,但该技术用于百合多糖的提取鲜见报道。
鉴于此,本文首先采用单因素和正交试验确定MATPE 法提取百合多糖的最佳工艺条件,并制备多糖粗提物;然后采用DEAE-52 纤维素柱和Sephadex G-100 柱层析法纯化多糖粗提物,并鉴定主要多糖馏分的结构。本文研究结果以期为百合多糖的高效提取提供绿色可行的方式,并为百合多糖的深度开发提供重要参考。
1 材料与方法
1.1 材料与仪器
湖州卷丹百合 2022 年6 月购买于浙江湖州;DEAE-52 纤维素、Sephadex G-100 北京北实纵横科学公司;葡萄糖、半乳糖、鼠李糖、阿拉伯糖、木糖、甘露糖、岩藻糖 标准品(纯度≥99%),成都成科汇博科技有限公司;硫酸铵、浓硫酸、苯酚、氯化钠、氢氧化钠 分析纯,天津金东天正精细化学试剂有限公司;透析袋 北京索莱宝科技有限公司。
MARS6 微波辅助提取仪 培安(中国)有限公司;VFD-1000 真空冷冻干燥机 北京博医康实验仪器有限公司;CARY 50 紫外分光光度计 美国瓦里安公司;650S 傅里叶变换红外光谱仪 天津港东科股份有限公司;GC7810 气相色谱 山东金普分析仪器有限公司;ROHS2.0 高效液相色谱仪 苏州博讯仪器有限公司;SNE-3200M 台式扫描电镜 深圳市武训科技有限公司;AXTG16G 高速离心机 无锡华卫德朗仪器有限公司;IKA RV10 Basic 旋转蒸发仪德国艾卡科技有限公司。
1.2 实验方法
1.2.1 样品前处理 首先将百合在50 ℃的真空烘箱中干燥,直到百合的含水率低于5%为止,然后利用小型的植物粉粹机将其粉碎成粉末,随后过40 目筛,即获得百合粉末样品,密封保存备用。
1.2.2 百合多糖提取物的制备 依据Li 等[14]制备乙醇-硫酸铵双水相体系,具体如下:精确称取一定质量的硫酸铵,加入至容积为15 mL 的具塞试管中,然后加入适量质量分数的乙醇溶液,超声使固体微粒全部溶解,然后静置直至体系形成双水相。在预实验的基础上,准确称取5 g 百合粉末样品,然后加入制备好的双水相体系,将百合样品充分混合,然后置于微波辅助提取仪中,通过微波提取仪的控制面板设定微波功率和提取时间,提取结束后,待两相分配达到平衡后,收集下相溶液,将其离心(6000 r/min,15 min)。利用硫酸-苯酚法测定上清液中百合多糖得率;另一部分上清液将其置于冷冻干燥机中冻干,制得百合多糖粗提物。
1.2.3 百合多糖得率测定
1.2.3.1 葡萄糖标准曲线绘制 精密称取10.00 mg葡萄糖标准品,置于100 mL 容量瓶中,利用去离子水定容,配成0.1 mg/mL 葡萄糖标准溶液。分别吸取0.2、0.4、0.6、0.8、1.0 mL 葡萄糖标准溶液于10 mL 试管中,去离子水补至1.0 mL,依次加入1.0 mL 6%苯酚溶液和5.0 mL 浓硫酸,振荡混匀,沸水水浴20 min,冷却至室温,在波长490 nm 处测定样品吸光度[18]。以吸光度(A)对葡萄糖质量浓度C(mg/mL)做线性回归,得线性方程为:A=8.1325C-0.0061,R2=0.9998,表明葡萄糖浓度在0.02~0.10 mg/mL 范围内线性关系良好。
1.2.3.2 多糖含量测定 参考Rostami 等[18]的方法测定多糖得率,首先吸取1.2.2 样品溶液2 mL,其余步骤参考1.2.3.1,并依据式(1)计算多糖得率(Y)。
式中:C 为样品中多糖的浓度,mg/mL;V 为样品体积,mL;m 为百合质量,mg。
1.2.4 单因素实验 本研究选择MATPE 法作为百合多糖的提取方法,操作同1.2.2。其中影响多糖得率最主要的因素包括微波功率、硫酸铵质量分数、乙醇体积分数和料液比,在本论文中分别选择上述实验因素条件进行多糖得率的单因素实验考察。
1.2.4.1 微波功率对多糖得率的影响 硫酸铵质量分数、乙醇体积分数和料液比分别固定在22%、50%和1:30 g/mL,考察微波功率(80、160、240、320、400 W)对多糖得率的影响。
1.2.4.2 硫酸铵质量分数对多糖得率的影响 微波功率、乙醇体积分数和料液比分别固定在240 W、50%和1:30 g/mL ,考察硫酸铵质量分数(18%、20%、22%、24%、26%)对多糖得率的影响。
1.2.4.3 乙醇体积分数对多糖得率的影响 微波功率、硫酸铵质量分数和料液比分别固定在240 W、22%和1:30 g/mL,考察乙醇体积分数(30%、40%、50%、60%、70%)对多糖得率的影响。
1.2.4.4 料液比对多糖得率的影响 微波功率、硫酸铵质量分数和乙醇体积分数分别固定在240 W、22%和50% ,考察料液比(1:10、1:20、1:30、1:40、1:50 g/mL)对多糖得率的影响。
1.2.5 正交试验 依据单因素实验结果,本研究选择微波功率(A)、硫酸铵质量分数(B)和乙醇体积分数(C)作为实验因素,以百合多糖得率为目标值。设计L9(34)正交实验,正交实验设计及因素水平编码如表1 所示。

表1 MATPE 法提取百合多糖的L9(34)正交实验因素及水平Table 1 L9(34) orthogonal experimental factors and levels of MATPE lily polysaccharides
1.2.6 百合多糖的纯化 称取一定量百合多糖粗提物,按照1:30 g/mL 加入80%乙醇沉淀过夜,收集沉淀,通过Sevage 法去除蛋白质,然后用透析袋(截留分子量为3500 Da)透析48 h,每12 h 更换一次去离子水。将获得的透析液置于-18 ℃冰箱中预冻12 h,然后将其置于真空冷冻干燥机中冻干。将冻干的样品用去离子水溶解,并离心(6000 r/min,15 min)以获得上清液,上清液质量浓度为2 mg/mL,以1.0 mL/min 的流速加入DEAE-52 纤维素柱(1.6 cm×70 cm)中,用去离子水和不同浓度的NaCl(0.1、0.2、0.4、0.6 mol/L)溶液依次进行洗脱,洗脱流速为1.0 mL/min。通过自动接样器收集洗脱馏分于试管中,每管5 mL 洗脱液。采用苯酚-硫酸法测定多糖含量。通过上述方法分离后获得2 种多糖馏分(LP1 和LP2),经测定比较,LP2 中多糖含量较高。然后通过Sephadex G-100 层析柱(1.6 cm×50 cm)进一步分离和纯化主要馏分(LP2)。洗脱参数如下:加载浓度为10 mg/mL,加载体积为4 mL,去离子水为洗脱剂,流速为0.4 mL/min。每个管收集2 mL 馏分,将纯化的多糖馏分冷冻干燥以获得均一的多糖馏分LP2-SG,用于多糖结构鉴定。
1.2.7 结构鉴定
1.2.7.1 紫外光谱 参考Kia 等[19]所述的方法,将LP2-SG 制备成0.1 mg/mL 的样品溶液,利用紫外分光光度计在200~800 nm 波长范围内进行扫描,以确定多糖溶液是否含有蛋白质和核酸。
1.2.7.2 单糖组成 参考Hui 等[20]的方法测定LP2-SG 的单糖组成。具体如下:a.配制单糖混合标准品溶液:准确称取7 种单糖标准品20.0 mg,分别溶于1 mL 0.3 mol/L NaOH 溶液中,得到浓度为20 mg/mL 单糖标准品溶液,于4 ℃密封保存。各取100 μL体积单糖标准品溶液混合,得到700 μL 单糖混合标准品溶液。b.多糖水解及衍生化反应:准确称取5 mg 多糖置于血清瓶中,加入1 mL 蒸馏水完全溶解后,加入1 mL 4 mol/L 三氟乙酸(TFA)中,混匀后密封,于110 ℃反应4 h。取出后冷却至室温,加入1 mL 甲醇旋蒸除去TFA。加入 1 mL 0.3 mol/L NaOH 溶液溶解,再加入 200 μL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(PMP)-甲醇溶液,70 ℃水浴反应2 h。取出后冷却 10 min,用0.3 mol/L 盐酸溶液中和。采用1 mL 氯仿萃取,弃下层,至下层无色。取上清液用0.22 μm 的微孔滤膜过滤后即可进样测定。c.单糖混合标准品衍生化反应:取800 μL 单糖混合标准品溶液,根据上述步骤中多糖衍生方式进行。d.高效液相色谱仪检测:采用ROHS2.0 高效液相色谱仪。色谱柱为 Gemini C18柱(4.6×250 mm,5 μm),检测器波长为 254 nm,柱温为30 ℃。流动相A:0.1 mol/L 磷酸盐缓冲溶液(pH6.7),流动相B:乙腈。进样量为10 μL,流速为1 mL/min。
1.2.7.3 分子量 利用去离子水将LP2-SG 和不同分子量标准品制备成1 mg/mL 的溶液,并以6000 r/min 将其离心15 min,通过0.45 μm 滤膜过滤,然后注入高效凝胶渗透色谱(HPGPC)中,进样量为20 μL,柱温为40 ℃,流动相为 0.05 mol/L NaCl 溶液,流速:0.6 mL/min。HPLC 系统配备有折射率检测器(RID)和超水凝胶线性凝胶过滤柱(8 mm×300 mm)。利用去离子水进行洗脱。利用多个单糖标准品构建校准曲线以测量平均分子量(Mw),标准曲线如式(2)所示:
式中:TR为保留时间,min;Mw为平均分子量。
1.2.7.4 红外光谱 利用红外光谱分析LP2-SG 的红外吸收特性。将LP2-SG 与KBr 以1:30(w/w)的比例混合并压缩成切片。LP2-SG 在波数4000~500 cm-1的范围进行红外光谱扫描。通过红外光谱仪的内置软件分析LP2-SG 的光谱特性。质量分数20%、22%、24%三个水平进行正交试验。
1.3 数据处理
每组实验重复3 次,结果用平均值±标准差表示;采用SPSS 22.0 软件对每一组数据进行方差分析(ANOVA),组间差异比较用Duncan 检测,P<0.05认为组间具有显著性差异;利用Origin9.0 进行绘图。
2 结果与分析
2.1 单因素对百合多糖得率的影响
双水相法提取百合多糖的单因素实验结果如图1 所示。
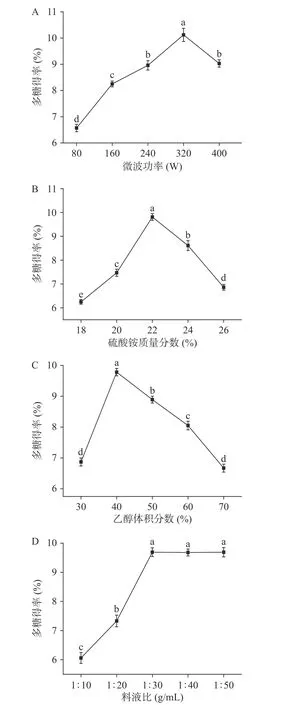
图1 提取因素对百合多糖得率的影响Fig.1 Effect of extraction factors on the yield of lily polysaccharides
由图1A 可知,当微波功率低于320 W 时,多糖得率随微波功率增加而显著增加(P<0.05)。这是由于微波功率越大,微波辐射导致百合细胞壁破裂,加快细胞内多糖的快速溶出,进而提高多糖得率[19]。但微波功率超过320 W 时,提取率反而下降。该研究结果与李乐等[21]在探究微波提取无花果多糖的结果一致。综上,本研究选择微波功率240、320 和400 W三个水平进行正交试验。
由图1B 可知,当硫酸铵质量分数在18%~22%范围内,随硫酸铵质量分数增加百合多糖得率显著增加(P<0.05)。这种现象归因于硫酸铵质量分数在一定范围内,下相中硫酸铵质量分数越高,多糖在硫酸铵溶液中的溶解度增加,同时扩散系数增加,从而提高多糖得率[14]。但下相中硫酸铵质量分数过高,下相中硫酸铵质量已经饱和,继续增加硫酸铵质量分数也不会提高多糖的溶解度,相反会提高多糖杂质溶解度,进而与多糖的溶解产生竞争,不利于多糖的提取。该研究结果与Xue 等[22]采用超声辅助双水相提取百合多糖的结果一致。综上,本研究选择硫酸铵
由图1C 可知,当乙醇体积分数在30%~40%范围内,多糖得率随乙醇体积分数的增加呈显著增加的趋势(P<0.05),即多糖得率与乙醇体积分数呈正相关。在乙醇体积分数在40%时,多糖得率取得最大值9.78%±0.12%。其原因是乙醇体积分数在40%时,乙醇和硫酸铵质量形成的双水相体系对多糖的溶解度和扩散系数最大,更有利于多糖溶解在双水相的下相中进而提高多糖得率[23]。当乙醇体积分数高于40%时,乙醇和硫酸铵质量形成的双水相体系对多糖溶解度降低。但当乙醇体积分数在50%~60%范围内,多糖得率仍显著高于乙醇体积分数在30%时所得的多糖得率(P<0.05)。该研究结果与Chen等[24]采用微波辅助双水相提取决明子多糖的实验结果一致。综上,本研究选择乙醇体积分数为40%、50%、60%三个水平进行正交试验。
由图1D 可知,当料液比在低于1:30 g/mL 范围内,百合多糖得率随料液比增加而显著增加(P<0.05)。其原因是较大的料液比会使得百合细胞内外的浓度梯度逐渐增加,浓度梯度作为多糖的传质驱动力,较高的浓度梯度促进多糖由内向外扩散,进而提高多糖得率[22]。当料液比超过1:30 g/mL 时,百合多糖得率随料液比增加无显著变化(P>0.05)。该结果与周小伟等[25]通过超声-微波协同辅助提取猴头菇多糖结果一致。因此,本研究选择料液比为1:30 g/mL,后续不再进行优化。
2.2 微波辅助双水相提取多糖的正交试验结果
百合多糖经MATPE 法提取后的正交试验结果如表2 所示。利用极差大小可判断实验因素对百合多糖得率的影响程度。由表2 可知,实验因素对多糖得率影响的主次顺序为:C>B>A,最优水平组合为A3B1C2,即微波功率400 W、硫酸铵质量分数20%和乙醇体积分数50%。利用优化得到的工艺参数进行3 次重复实验,所得百合多糖得率为10.15%±0.11%,说明利用正交试验使得MATPE 法提取百合多糖的工艺得到优化。
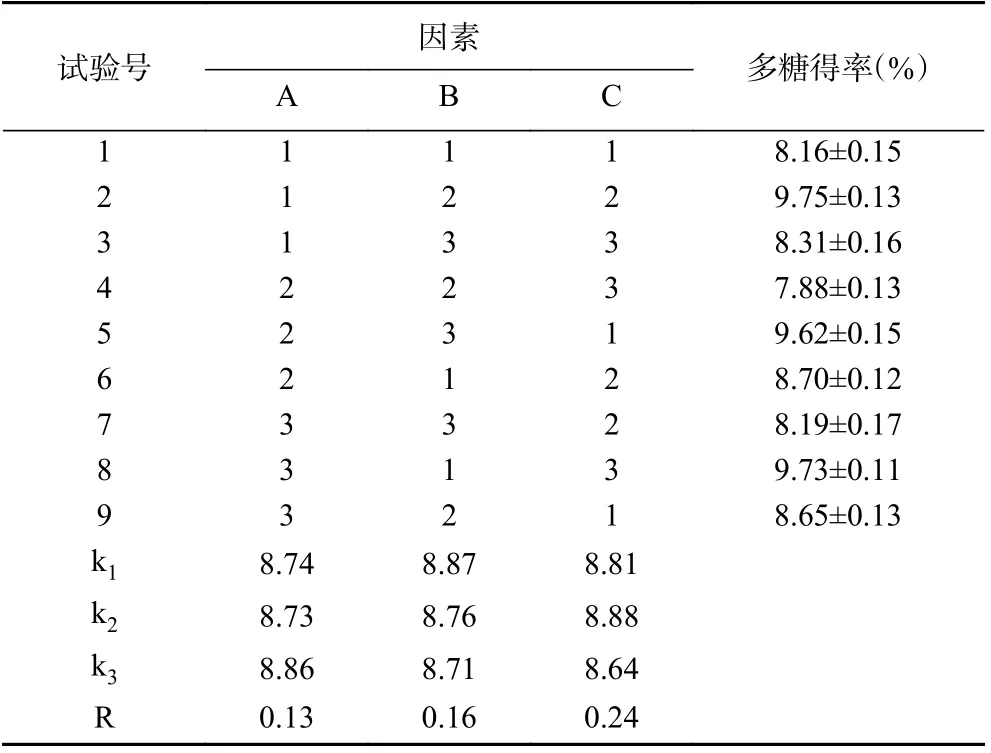
表2 MATPE 法提取百合多糖的L9(34)正交试验设计及结果Table 2 Orthogonal experimental design L9(34) and results of MATPE of lily polysaccharides
2.3 百合多糖纯化
利用80%乙醇沉淀在最优工艺参数组合下获得的百合多糖提取物,然后经透析和真空冷冻干燥后获得百合多糖粗提物。百合多糖粗提物首先通过DEAE-52 纤维素柱层析法分离,分别利用去离子水和0.1 mol/L NaCl 溶液洗脱获得两个馏分(命名为LP1 和LP2),其洗脱曲线如图2A 所示。经硫酸-苯酚法测定LP1 和LP2 得率分别为8.15%和12.73%。接下来本研究对主要馏分LP2 采用Sephadex G-100柱层析法(1.6 cm×50 cm)进一步纯化,浓缩和冷冻干燥,其结果如图2B 所示。由图2B 可知,LP2 经Sephadex G-100 柱层析法纯化后,获得单一峰,命名为LP2-SG,其纯度为98.13%,冷冻干燥后,进行结构表征。

图2 百合多糖粗提物的纯化Fig.2 Purification of crude extracts of lily polysaccharide
2.4 百合多糖的紫外分析
利用紫外分光光度计对LP2-SG 在200~800 nm范围内进行扫描,其结果如图3 所示。由图3 可知,LP2-SG 在260 nm 和280 nm 没有吸收峰,表明LP2-SG 不含蛋白质和核酸。

图3 LP2-SG 紫外图谱Fig.3 UV spectrum of LP2-SG
2.5 百合多糖的单糖组成和分子量
分子量是多糖的一个重要结构指标,它影响多糖的理化特性和生物学活性。通过HPGPC 法测定LP2-SG 的平均分子量,其结果如图4A 所示。由图4A 可知,LP2-SG 显示了一个单一且对称的峰,表明LP2-SG 是一种均一的多糖馏分。LP2-SG 的保留时间(TR)为16.83 min(图4A),通过标准方程(2)可计算LP2-SG 的平均分子量为530.51 kDa。该研究结果所得的百合多糖平均分子量大于Xue 等[22]文献中报道的。这种现象可能归于与百合原料的物种差异,提取、分离和纯化的方式有关。为判断LP2-SG 中单糖的组成,本研究利用GC 进一步分析LP2-SG 的单糖组成,其结果如图4B 所示。由图4B可知,LP2-SG 由甘露糖、葡萄糖和半乳糖组成,其摩尔比为11.63:29.85:8.46。结果表明,LP2-SG 属于一种具有不同单糖组成的杂多糖,其中葡萄糖是主要单糖。
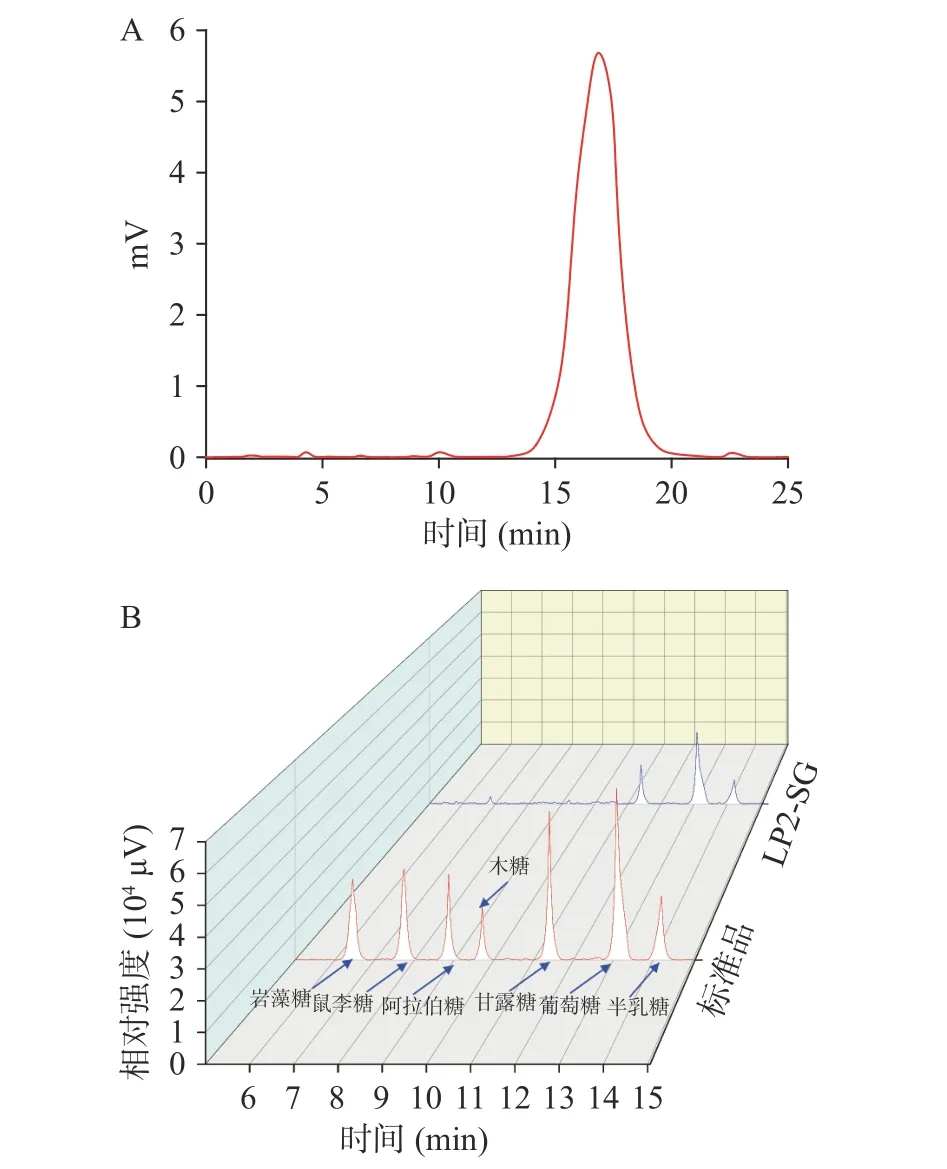
图4 LP2-SG 分子量分布(A)和单糖组成(B)Fig.4 Molecular weight distribution (A) and monosaccharide composition (B) of LP2-SG
2.6 红外光谱分析
利用红外光谱仪对LP2-SG 在500~4000 cm-1范围内进行红外光谱扫描,其结果如图5 所示。由图5 可知,LP2-SG 在3345 cm-1处出现吸收峰,说明该峰是由LP2-SG 结构中的O-H 伸缩振动引起的[14];LP2-SG 在2925 cm-1处出现吸收峰,说明该峰是由LP2-SG 结构中的C-H 伸缩振动引起的[20];LP2-SG在1732 cm-1处呈现出弱峰,这是由于LP2-SG 结构中C=O 伸缩振动引起的[22]。在1020、1080 和1151 cm-1处的三个拉伸峰表明LP2-SG 结构中存在C-O 键和糖的吡喃糖形式[23],进一步表明LP2-SG 属于均一的多糖馏分。

图5 LP2-SG 的红外图谱Fig.5 IR spectra of LP2-SG
3 结论
本研究在单因素实验的基础上,通过正交实验优化微波辅助双水相提取百合多糖的工艺,最佳的工艺参数组合为:微波功率400 W、硫酸铵质量分数20%、乙醇体积分数50%和料液比1:30 g/mL,百合多糖得率为10.15%±0.11%。粗多糖经依次通过DEAE-52 和Sephadex G-100 柱色谱法纯化最终得到均一多糖馏分(LP2-SG),其分子量为530.51 kDa,单糖组成为甘露糖、葡萄糖和半乳糖组成,其摩尔比为11.63:29.85:8.46。此外,LP2-SG 中无蛋白质和核酸,具有典型的吡喃糖形式多糖吸收特性。本研究结果为百合多糖高效提取和深度加工 提供重要的科学依据。

