黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的制备工艺优化及活性评价
胡 程,宋浩颖,常 聪,邱振鹏,郑国华,2,孟 燕,*
(1.湖北中医药大学药学院,湖北武汉 432500;2.湖北中医药大学中药资源与中药复方教育部重点实验室,湖北武汉 432500)
近年来,随着纳米技术的发展,许多金属及非金属的无机纳米颗粒被用于各种疾病的治疗。其中,纳米硒(Se NPs)因其毒性低、生物利用度高、活性高成为硒类物质研究和发展的焦点。但纯的 Se NPs 不稳定,在水溶液中容易聚集,因此为保持其良好的水溶性和稳定性,在制备过程一般要添加分散剂或保护剂使其在水溶液中稳定分散[1-4]。化学类表面活性剂虽然对纳米硒有较强的分散能力,但因其本身的毒性使纳米硒在生物活性方面的应用受限[5]。核酸、蛋白质和多糖等天然生物大分子,由于其本身的生物相容性好,被更为广泛地用于构建生物医用材料。如Meng 等[6]利用多糖-亚硒酸钠螯合法制得一种新型的水溶性黄芪多糖纳米硒(Se-APS)。结果表明,Se-APS 含硒量高、水溶性好、副作用小,不仅能够促进T 淋巴细胞的增殖,还能够抑制HepG2 细胞的恶性增殖,减少细胞的迁移和侵袭。Zhu 等[7]探讨了石笋多糖(ULP)稳定的Se NPs 对DSS 诱导的小鼠溃疡性结肠炎产生保护作用。因此,开发多糖-纳米硒复合物对临床疾病的治疗具有重要的意义。
黑木耳是生长在朽木上的一种腐生菌,具有补脾益气、止咳润肺、延缓衰老、辅助降血糖降血脂及抗癌等功效[8]。黑木耳的主要活性成分为多糖,目前已有多篇研究报道了从黑木耳中提取得到的不同结构的多糖,并证明了他们具有多种生物活性,如抗肿瘤、抗氧化、降血脂及免疫调节等功效[9-13]。在本课题组前期研究中,发现从黑木耳中提取的一种多糖,可在水中自组装成树枝状纳米管(DNTs)[14-17],这种中空纳米管结构可以负载多种客体分子,如DOX 药物、Pt(IV)前药、聚集诱导发光(AIE)染料以及金、银纳米粒子[14,16-18]。并在治疗中展现出优良的疗效[19]。然而,该复合物作为一种新型制剂,其制备工艺并未进行过系统研究,阻碍其作为药物的深入开发。
因此,本文拟通过系统的制备工艺考察来探索DNT-Se 复合物的最优制备条件。有研究表明,在纳米硒的制备工艺中,多糖浓度、维生素C 与亚硒酸钠的比例、反应温度等都是制备理想纳米颗粒的重要因素[20]。因此,本文对黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的制备工艺进行考察,主要研究黑木耳β-葡聚糖溶液浓度、维生素C 和亚硒酸钠配比、反应温度、反应时间、亚硒酸钠浓度等反应条件对DNTSe 复合物粒径的影响,采用单因素考察结合正交试验进行比例筛选,从而确定制备DNT-Se 的最佳工艺,并考察其对HepG2 肝癌细胞增殖的作用。
1 材料与方法
1.1 材料与仪器
黑木耳 湖北房县;乙酸乙酯 天津市富宇精细化工有限公司;氯化钠 天津市大茂化学试剂厂;甲醇、无水乙醇、维生素C、亚硒酸钠 国药集团化学试剂有限公司;氘代二甲基亚砜、溴化钾 上海阿拉丁生化科技股份有限公司;Cell Counting Kit-8东仁化学科技(上海)有限公司;DMEM 培养基、双抗(青霉素-链霉素溶液)、胰酶(0.25%)、磷酸盐缓冲液 美国HyClone 公司;胎牛血清(FBS) 美国Gbico 公司;二甲亚砜(DMSO) 美国Sigma 公司;人胚胎肾细胞株293T、小鼠正常肝细胞株AML-12 及人肝癌细胞株HepG2 购自中国科学院生物化学与细胞生物学研究所。
Implen N60 超微量紫外分光光度计 北京诺汇诚生物科技有限公司;Nicolet 6700 傅里叶红外光谱仪 赛默飞世尔科技有限公司;YP-2 压片机 上海山岳科学仪器有限公司;Mercury VX-300 核磁共振仪 Varian Mercury 公司;LC-10A 高效液相色谱仪、RI-10A 示差检测器 Shimadzu;色谱柱BRT105-104-102 串联凝胶柱 BRT105-104-102 (8 mm×300 mm) BoRuiSaccharide;Nano-ZS90 粒径测定仪 马尔文仪器有限公司;JEM1400 透射电镜 日本JEOL 有限公司;QUANTA200 扫描式电子显微镜 FEI 公司;XPertPro X 射线衍射仪 荷兰帕纳科公司;ESCALAB250Xi X 射线光电子能谱仪 Thermo FisherScientific。
1.2 实验方法
1.2.1 黑木耳β-葡聚糖的提取、分离及表征 按照参考文献[21]的方法,黑木耳粉碎后,分别使用丙酮、乙酸乙酯回流4 h 脱脂,将脱脂粉末烘干后使用70%乙醇溶胀24 h 后用0.9% NaCl 提取,收集上清,然后使用Sevage 法脱蛋白、H2O2脱色,透析7 d后冻干即得黑木耳多糖。按照参考文献[22]的方法,采用苯酚-硫酸法对黑木耳β-葡聚糖的总糖含量进行测定。将冻干的黑木耳多糖配制成多糖溶液,使用紫外分光光度计测定样品溶液在490 nm 处的吸光度值,利用标准曲线计算样品的总糖含量。使用傅里叶红外光谱仪,采用溴化钾压片法采集黑木耳β-葡聚糖的红外光谱,检测范围为400~4000 cm-1。另取30 mg 黑木耳β-葡聚糖冻干品溶于1 mL 氘代二甲基亚砜(DMSO-d6)中,置于核磁仪上进行测定以得核磁共振(NMR)谱图,测定温度为25 ℃。
1.2.2 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的制备 将β-葡聚糖于60 °C 溶于蒸馏水(1 mg/mL),冷却至室温,即可通过其在水中自组装得黑木耳β-葡聚糖纳米管,命名为DNTs。纯纳米硒对照组(Se NPs),采用VC还原法制备。将VC水溶液(1 mg/mL)以4:1(n/n)的比例逐滴滴加到亚硒酸钠水溶液中,即可得到纳米硒粒子,命名为Se NPs。DNT-Se 的制备方法类似,将黑木耳β-葡聚糖配制成终浓度1 mg/mL的多糖溶液,待完全溶解后逐滴滴加0.1 mol/L 的亚硒酸钠(Na2SeO3)水溶液,搅拌30 min 后再按照维生素C 与亚硒酸钠配比为4:1(n/n)逐滴滴加维生素C 水溶液(1 mg/mL),于25 ℃反应24 h。之后转入透析袋中(MWCO 3000)透析,冷冻干燥即得多糖/纳米硒复合物,命名为DNT-Se。
1.2.3β-葡聚糖/纳米硒复合物中纳米硒粒径的评价指标
1.2.3.1 双波长吸光度比值法 将浓度为1 mg/mL DNTs、1 mg/mL 维生素C 溶液以及1 mg/mL 维生素C+1 mg/mL DNTs(v/v=1:1)、1 mg/mL DNTs+1 mg/mL 维生素C+1 mol/L 亚硒酸钠溶液(v/v/v=1:1:1),进行紫外全波长扫描(200~800 nm),确定波长λ1(410 nm)、λ2(490 nm)的吸光度A1、A2,并计算A1/A2的值,以各因素为横坐标,以波长比(A1/A2)为纵坐标,绘制曲线图,以比值大小判断DNT-Se 复合物中Se NPs 的粒径大小,每个样品重复3 次。
1.2.3.2 粒径仪测定法 将所得的DNT-Se 置于马尔文激光粒度仪中,稳定120 s,于25 ℃下测定DNT-Se复合物中Se NPs 的粒径,每个样品重复3 次。
1.2.4 DNTs-Se 粒径的单因素考察 分别考察DNTs浓度、亚硒酸钠浓度、维生素C 与亚硒酸钠配比、反应温度、反应时间对DNT-Se 形成的影响。分别配制浓度为0.1、0.5、1.0、1.5、2.0 mg/mL 的DNTs 溶液,其他条件保持不变,考察DNTs 浓度对DNT-Se形成的影响;保持其他条件不变,考察0.6、0.8、1.0、1.2 mol/L 的亚硒酸钠溶液对DNT-Se 形成的影响;精密称取维生素C 与亚硒酸钠,使二者终配比为2:1、3:1、4:1、5:1、6:1(n/n 物质的量之比),考察维生素C 与亚硒酸钠配比对DNT-Se 形成的影响;分别考察反应温度为25、37、60、80 ℃时对DNTSe 形成的影响;在保持其他条件不变的条件下分别考察反应3、6、12、24、36 h 对DNT-Se 形成的影响。
1.2.5 正交试验优化DNT-Se 的制备工艺 以DNTs-Se 中Se NPs 粒径大小的单因素考察实验结果为依据,选取三种因素作为实验对象,将最适宜的条件作为中间水平,以L9(34)设计正交因素水平表为模板,按照表1进行正交试验,以对DNT-Se 的制备进行进一步的优化。
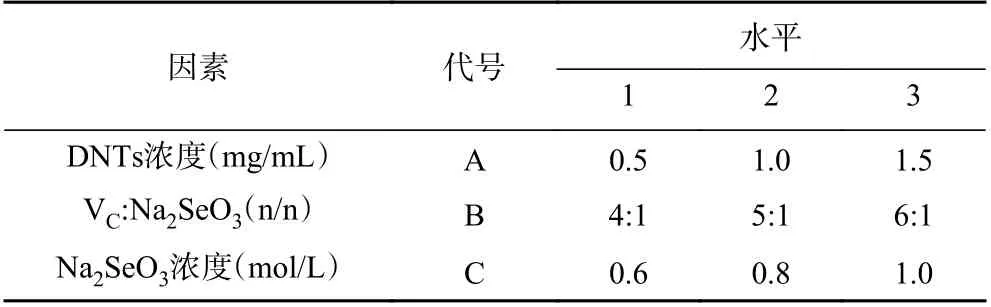
表1 正交设计中的因素与水平Table 1 Factors and levels in orthogonal design
1.2.6 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的形貌表征 DNT-Se 的形貌特征通过透射电子显微镜(TEM)来观察。取一滴新制备的DNTs、Se NPs及DNT-Se 溶液分别小心滴于100 目的铜网上,待样品被吸附10 min 后,用滤纸吸走各剩余样品溶液,室温下晾干铜网,通过TEM 观察依次各样品的微观形态。同时用能量色散光谱仪对其表面积断面进行观察,加速电压为5 kV,测试前均进行喷金操作。
1.2.7 细胞增殖实验 采用CCK8 法[23]检测DNTSe 等样品对各种细胞增殖抑制的情况。首先采用该法检测DNTs、Se NPs 及DNT-Se 对HepG2 肝癌细胞的增殖抑制情况。将处于对数生长期的HepG2细胞消化,加适量完全培养基轻吹散成细胞悬液,并用细胞计数器计数以便进行密度换算。将细胞混悬液稀释后以1.0×104个/孔的密度分别接种于96 孔板内,于细胞培养箱中待其贴壁。贴壁后将含有一定浓度梯度的DNTs、Se NPs、DNT-Se 培养基(6.25、12.5、25、50、100、200 μg/mL)分别加入到各孔中,同时建立无药物、无细胞的空白组和无药物、有细胞的对照组,每组设置4 个复孔,置于5% CO2、37 ℃的培养箱中继续分别培养24、48、72 h。
接着采用该法检测DNT-Se 对293T 人胚胎肾细胞及AML-12 小鼠正常肝细胞活性的影响,以进一步确定DNT-Se 的生物安全性。将293T 细胞和AML-12 细胞以1×105的密度接种于96 孔板,待其贴壁。之后加入含有一定浓度梯度的DNT-Se 培养基(6.25、12.5、25、50、100、200 μg/mL),同时建立无药物、无细胞的空白组和无药物、有细胞的对照组,每组设置4 个复孔,置于5% CO2、37 ℃的培养箱中继续培养48 h。
以上三种细胞终止培养后,每孔加入无菌PBS清洗细胞2 次以洗净培养基,再加入100 μL 含10%CCK8 培养基,于培养箱中继续孵育20 min,最后用酶标仪在450 nm 处检测每孔的吸光度OD 值。用下式计算各细胞的存活率,用Graphpad prism 7.0 计算药物的半数致死浓度(IC50):
细胞存活率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100
1.3 数据处理
采用 Graph Pad Prism 7.0 软件对数据进行统计分析,计量资料以平均值±标准差(±s )表示,多组间均数采用 One-Way ANOVA 检验。P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 黑木耳β-葡聚糖的理化性质表征
所得多糖采用苯酚-硫酸法测得总糖含量为94.1%,因前期[24-25]已通过色谱洗脱、甲基化分析等手段对黑木耳β-葡聚糖的平均高度、长度、分子量、链构象等进行了详细的表征,故本文仅对该多糖进行初步验证并与之对比,从而确证二者的相似性。红外光谱图如图1A 所示。由图1A 可知,黑木耳葡聚糖在890 cm-1处有明显的吸收峰,为β构型的特征峰[26],结合前期研究,该黑木耳多糖为β-葡聚糖。
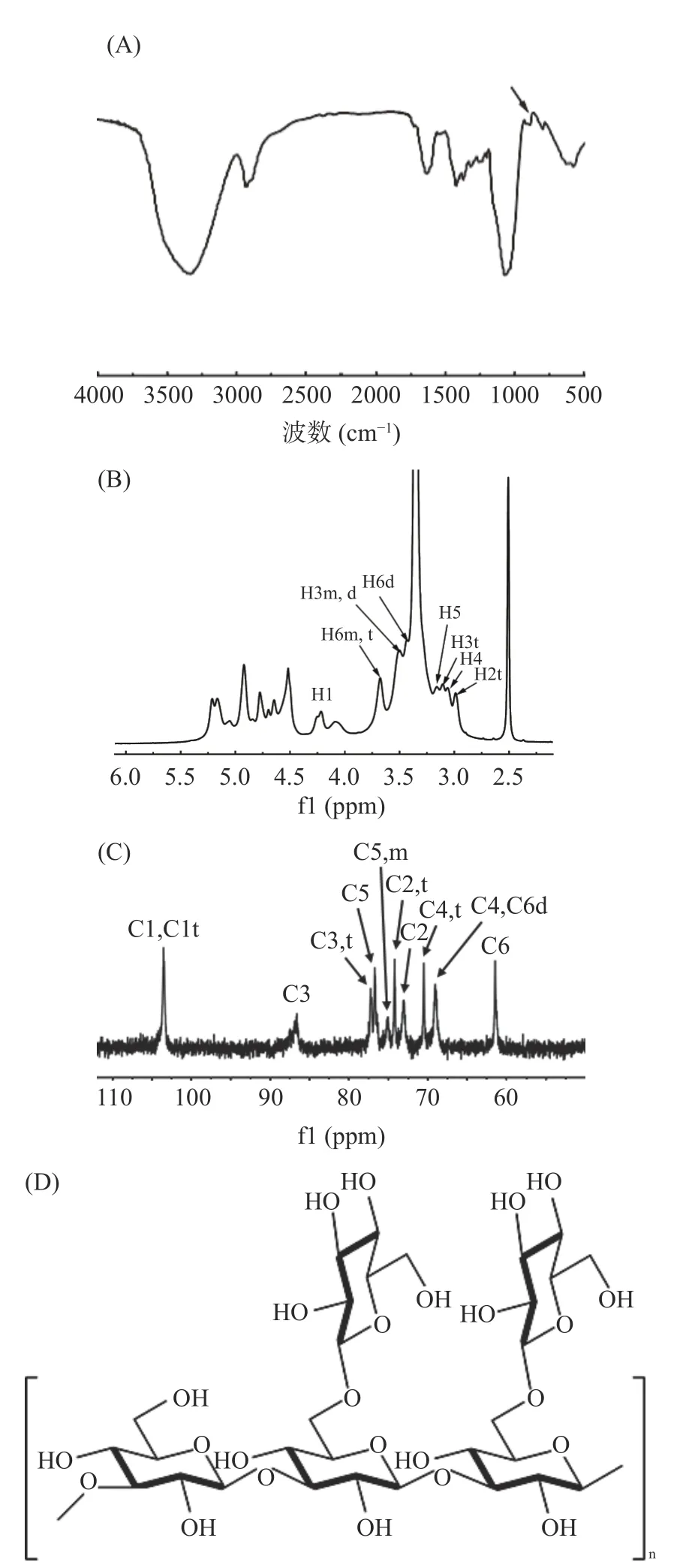
图1 黑木耳β-葡聚糖的近红外图谱(A)、核磁共振氢谱(B)、核磁共振碳谱(C)及其结构式(D)Fig.1 FT-IR spectrum (A) , 1H NMR spectrum (B) ,13C NMR spectrum (C) and structural formula (D) of β-glucan from Auricularia auricula
采用核磁共振氢谱和碳谱分析黑木耳β-葡聚糖的连接方式。如图1B 和图1C 所示,在13C 核磁共振谱中未发现典型的糖醛酸信号(176.5 ppm),表明β-葡聚糖是中性多糖。黑木耳β-葡聚糖在74.26 ppm处C2t 积分值(侧链)和在72.99 ppm 处C2(主链)积分值的比值为1:1.4,DNTs 的所有化学位移如表2所示。与前期报道黑木耳多糖[27-29]的NMR 特征峰等进行对比可确定其化学结构为主链上每三个β-(1,3)-葡萄糖主链带有两个β-(1,6)-葡聚糖的侧链,具体结构式如图1D 所示。

表2 黑木耳β-葡聚糖的1H 和13C NMR 化学位移Table 2 1H and 13C NMR chemical shifts of β-glucan from Auricularia auricula
2.2 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的制备工艺研究
2.2.1 不同溶液的全扫描吸收光谱 根据之前报道的胶体溶液双波长法[30-31]可知,硒纳米颗粒的粒径参数ε=lg(A2/A1) / lg(λ1/λ2),其中 A1、A2分别表示样品在波长λ1、λ2下的吸收值。可用A1/A2的比值来表征纳米硒的粒径变化,当比值不变时,纳米硒的粒径不再发生变化;比值越大,纳米硒的粒径越小,形貌越稳定。图2 为不同溶液的UV-Vis 全波长扫描吸收光谱。从图中可以看出,DNTs、VC及二者的混合样品在200~300 nm 范围内有明显的吸收峰,但在300~600 nm 范围内无明显吸收;而DNTs+VC+Na2SeO3(总反应介质)在200~600 nm 处均有吸收,且峰值较宽,说明在加入Na2SeO3后生成了一定的纳米硒,因此在300~600 nm 范围内选取410 和490 nm作为纳米硒的测定波长,并以A410/A490作为表征纳米硒粒径随时间变化的依据及指标。

图2 不同溶液的UV-Vis 全扫描吸收光谱Fig.2 Full-scanning UV-Vis absorption spectra of different solutions
2.2.2 单因素考察实验结果
2.2.2.1 DNTs 浓度对DNT-Se 形成的影响 本试验以黑木耳β-葡聚糖溶液DNTs 作为模板剂,研究了DNTs 浓度对DNT-Se 复合物中Se NPs 粒径的影响。各浓度下的吸光度比值及DNT-Se 复合物中Se NPs 的粒径如表3 所示。随着DNTs 浓度的增加,A410/A490的数值呈现先上升后下降的趋势,在DNTs 浓度为1.0 mg/mL 时A410/A490达到最大值2.549±0.025。同时,马尔文粒径仪测得的结果表明,DNT-Se 复合物中Se NPs 的粒径出现先减小后增大的趋势,在1.0 mg/mL 时Se NPs 的粒径最小。将各组溶液放置7 d 后,均未发现聚沉等现象,可初步说明各组的稳定性良好。因此,选择1.0 mg/mL DNTs作为反应体系中DNTs 的浓度。

表3 不同DNTs 浓度对纳米硒的粒径及A410/A490 的影响Table 3 Effect of different DNTs concentration on the size of Se NPs and A410/A490
2.2.2.2 维生素C 与亚硒酸钠的配比对DNT-Se 形成的影响 各配比下的吸光度比值及纳米硒的粒径如表4 所示。固定反应体系中亚硒酸钠的终浓度为0.1 mol/L,VC的量对反应的影响主要表现在体系中的亚硒酸钠是否得到完全反应,能否生成足够量的纳米硒。判断反应完全的程度的最直观的变化则是溶液颜色的深浅,越深表明纳米硒生成量越多,同时,A410、A490也可能会越大并且趋于稳定。从表4 中可以看出,随着VC/Na2SeO3的升高,A410/A490逐渐增加,这说明溶液中越来越多的亚硒酸钠参与了反应;而当比值达到5:1 之后,A410/A490呈现下降的趋势,这说明当VC/Na2SeO3达到5:1 之后,反应体系中的亚硒酸钠得到了完全反应,由于纳米硒生成过多,产生聚集导致A410/A490开始减小。接着测定了各体系中纳米硒的粒径,发现其在VC/Na2SeO3为5:1 时的粒径最小,该结果与双波长比值结果一致。将各组溶液放置7 d 后,均未发现聚沉等现象,可初步说明各组的稳定性良好。结合该实验结果,故选择VC/Na2SeO3=5:1 作为反应体系中维生素C 与亚硒酸钠的比例。

表4 不同VC 与Na2SeO3 的配比对纳米硒的粒径及A410/A490 的影响Table 4 Effect of different ratio of VC and Na2SeO3 on the size of Se NPs and A410/A490
2.2.2.3 反应温度对DNT-Se 形成的影响 反应温度不仅对纳米硒粒径的大小有影响,而且对作为稳定剂的多糖DNTs 也有影响。因此,确定一定的反应温度是至关重要的一环。本试验研究了不同的反应温度对纳米硒形成的影响,实验结果如表5 所示。从结果中可以得知,随着反应温度的升高,A410/A490逐渐降低,纳米硒粒径逐渐增加,甚至在80 ℃ 时出现了聚沉,因为温度过高会破坏多糖的链状结构,同时其自组装能力也会受到影响,导致整个反应体系不稳定,多糖稳定纳米硒的能力减弱[32-33]。尽管在25、37、60 ℃时均未发生聚沉,但25 ℃ 时DNT-Se 粒径最小,因此,选择25 ℃作为制备DNT-Se 的最佳反应温度。
2.2.2.4 反应时间对DNT-Se 形成的影响 与反应温度对纳米硒粒径大小的影响一样,反应时间对纳米硒的粒径也有着重要影响。因此,本试验也探究了反应时间对纳米硒形成的影响,实验结果如表6 所示。从结果中可以看出,反应时间在12 h 内,随着反应时间的增加,A410/A490也逐渐增加,纳米硒粒径逐渐减小;当反应时间大于12 h 时,A410/A490开始降低,纳米硒粒径增加。在反应温度一定时,随着反应时间的延长,体系中生成的纳米硒逐渐增多,溶液的颜色会出现浅黄色→橙色→红色的变化, A410/A490增加,DNT-Se 粒径减小[34-35]。但反应时间过长,纳米硒会发生集聚,硒纳米粒子的粒径增大,溶液的颜色会由红色变为砖红色,甚至出现红色沉淀。因此,反应时间不宜过长,故选择12 h 作为制备DNT-Se的反应时间。

表6 不同反应时间对纳米硒的粒径及A410/A490 的影响Table 6 Effect of different reaction time on the size of Se NPs and A410/A490
2.2.2.5 亚硒酸钠浓度对DNT-Se 形成的影响 本研究最主要的目的是在纳米硒分散且稳定的前提下,利用DNTs 负载尽可能多的纳米硒。因此纳米硒的浓度至关重要。不同亚硒酸钠浓度对粒径的影响如表7 所示。随着浓度的增加,A410/A490逐渐减小,纳米硒粒径也呈现增加的趋势;在浓度为1.2 mol/L时,样品出现了聚沉现象。实验数据表明,0.6、0.8、1.0 mol/L 的A410/A490与粒径相差不大,结合实验的目的,选择Na2SeO3为1.0 mol/L 作为反应体系中亚硒酸钠的浓度。

表7 不同Na2SeO3 浓度对纳米硒的粒径及A410/A490 的影响Table 7 Effect of different Na2SeO3 concentration on the size of Se NPs and A410/A490
2.2.3 正交试验优化DNT-Se 的制备工艺 基于前述单因素实验的结果及本研究的主要目的,选择DNTs浓度(A)、维生素C 与亚硒酸钠的配比(B)和亚硒酸浓度(C)作为因素,选择最适宜的条件作为中间水平,各设三个水平,第四个因素为空白组,作为本实验的误差列,采用四因素三水平L9(34)设计正交试验表,继续优化DNT-Se 的制备工艺,优化指标为纳米硒粒径。实验使用的因素水平如表1,实验结果如表8 所示。

表8 正交试验设计与结果Table 8 Orthogonal experimental design and results
对正交试验的结果,以DNTs-Se 中Se NPs 粒径大小为指标,进行直观分析及方差分析,如表8 和表9 所示,以空白组作为误差项,因素A、B、C 的F值与临界值比较后可知,因素A 不同水平对纳米硒的影响有显著性差异,即DNTs 浓度对纳米硒的影响显著(P<0.05)。各因素对纳米硒粒径的影响程度为A>C>B。根据正交试验结果,得出最佳方案为A2B3C3。

表9 正交试验结果方差分析Table 9 Analysis of variance of orthogonal experiment results
2.2.4 验证实验 运用正交试验所得的最优条件进行5 组实验对其进行验证,即DNTs 浓度1.0 mg/mL,维生素C 与亚硒酸钠配比6:1,亚硒酸钠浓度为1.0 mol/L。5 次验证试验的结果中纳米硒粒径分别为33.59、35.10、34.48、35.32、34.01 nm,5 次验证实验中纳米硒粒径的均值为34.50±0.72 nm。故选择A2B3C3作为最佳制备条件。
2.3 黑木耳β-葡聚糖/纳米硒复合物(DNT-Se)的形貌表征
DNTs 及Se NPs 的透射电镜结果如图3 所示。由图3A 所示,DNTs 在水中可自组装成为平均直径约为200 nm 的树枝状的中空纳米纤维。而没有分散剂的纯Se NPs 则聚集成团且粒径较大,约为220 nm(图3B)。图3C 和图3D 是DNT-Se 的透射电镜图、粒径分布图。显然,因DNTs 的存在,Se NPs 不再聚集成团,而是均一、单一地分散于DNTs 的中空纳米管中,与文献[17]报道相符。DNT-Se 形态良好,粒径较小,约为30.9 nm(图3C),而正交试验所得的粒径大小约为34.50 nm,这是因为正交验证时中测量粒径时DNT-Se 是以一个液体的状态存在,多糖在溶液中会有一定的体积膨胀。而透射电镜中,DNT-Se 是处于干燥状态的。此时的粒径确实会与溶液状态下粒径大小具有一定的差异。
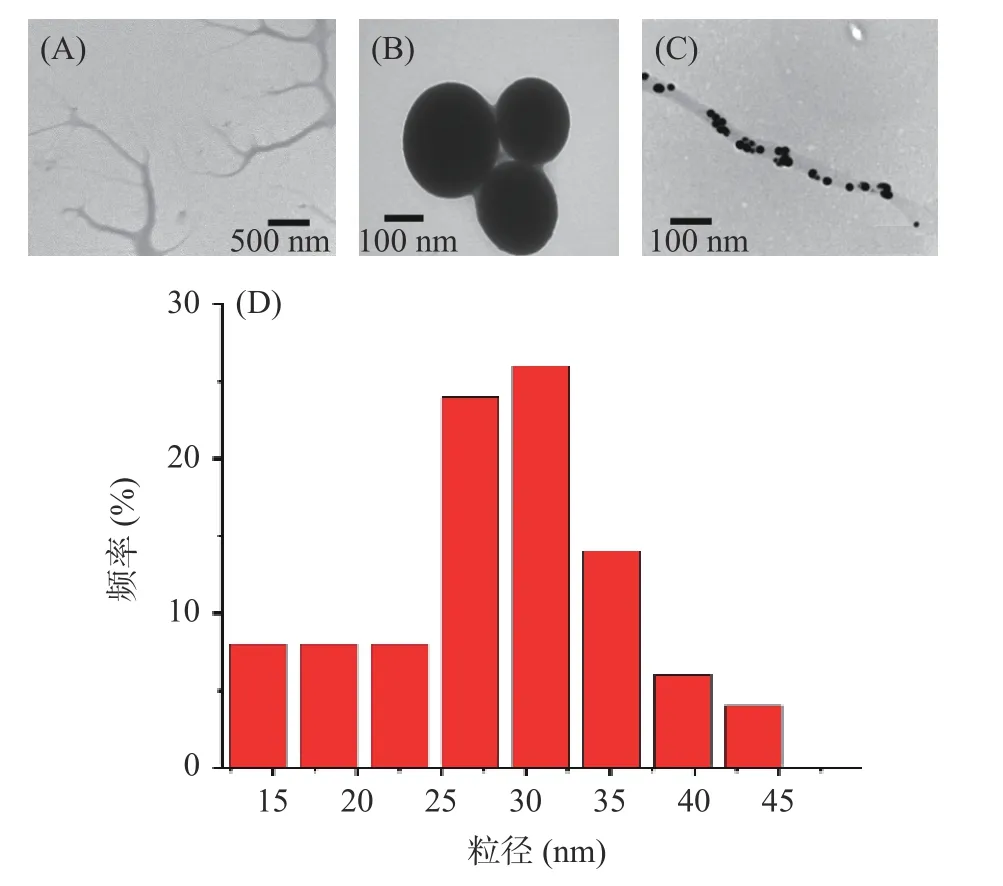
图3 DNTs、Se NPs、DNT-Se 的TEM 图像及DNT-Se 中Se NPs 的粒径分布图Fig.3 TEM image of DNTs, Se NPs and DNT-Se, and particle size distribution of Se NPs in DNT-Se
2.4 细胞增殖实验
有研究表明,含硒的材料通过诱导细胞凋亡而发挥抗癌活性[33]。故为考察各样品对肝癌细胞和正常细胞的作用,本研究采用CCK8 法对DNTs、Se NPs及DNT-Se 对HepG2 细胞的作用进行了探讨。结果如图4 所示,由图4A 可知,DNTs 与细胞作用72 h后,在最高浓度下存活率仍高于75%,说明DNTs 基本不杀死细胞,也可推测其基本不引起细胞凋亡;由图4B 可知,200 μg/mL 的Se NPs 与细胞作用48 h后,在最高浓度下存活率大于92%,而当其作用时间达72 h 时,其存活率显著下降且与48 h 时存在显著性差异(P<0.05);由图4C 可知,随着DNT-Se 与细胞共孵育的时间的增加,其存活率逐渐降低,对三个时间段的半数致死浓度进行计算,DNT-Se 在24、48、72 h 的IC50分别为412.81、125.64、42.54 μg/mL。可见,DNT-Se 对HepG2 细胞的作用具有时间依赖性,且在各时间段内,DNT-Se 组的IC50均低于Se NPs 组,可说明经DNTs 分散后的制剂(DNT-Se)能使更多的Se NPs 进入肝癌细胞,从而更好地发挥抑制癌细胞增殖的作用。考虑到制剂在体内的代谢情况,后续实验拟采用48 h 作为DNT-Se 及各组样品与细胞的作用时间。

图4 DNTs、Se NPs、DNT-Se 与不同细胞在不同孵育时间的存活率Fig.4 Survival rates of different cells at different incubation time of DNTs, Se NPs and DNT-Se
为了进一步考察DNT-Se 对正常细胞的影响,本研究采用293T 人胚胎肾细胞及AML-12 小鼠正常肝细胞的CCK8 实验以确证其安全性。如图4D 所示,DNT-Se 分别与293T 细胞和AML-12 细胞作用48 h 后,即使在最高浓度(200 μg/mL)时,其细胞存活率仍高于82%,说明DNT-Se 对正常细胞并无毒性作用,具有良好的生物安全性。
3 结论
本文采用原位还原法制备黑木耳β-葡聚糖/纳米硒复合物(DNT-Se),考察了DNTs 浓度、维生素C 与亚硒酸钠配比、反应温度、反应时间、亚硒酸钠浓度对DNT-Se 粒径大小的影响,最终确定DNT-Se的最佳制备工艺为DNTs 浓度1.0 mg/mL,维生素C与亚硒酸钠配比6:1,亚硒酸钠浓度为1.0 mol/L,反应温度为25 ℃,反应时间为12 h,所得DNT-Se粒径平均值为34.50 nm。细胞增殖实验结果表明,DNT-Se 对293T 人胚胎肾细胞及AML-12 小鼠正常肝细胞基本无毒性,但是对HepG2 肝癌细胞的增殖具有显著的抑制作用,且其对HepG2 肝癌细胞增殖的抑制作用明显优于Se NPs。本研究为多糖/纳米硒复合物的研究奠定了基础。

