3 株乳酸菌复合发酵制备的后生元对耐甲氧西林金黄色葡萄球菌的抑菌活性及机制
兰冬雪,瞿茜楠,于浩东,黄 天,彭传涛,姚国强,赵金山,李兆杰,*
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.青岛特种食品研究院,山东青岛 266109;3.内蒙古农业大学,乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018)
根据国际益生菌和益生元科学协会(ISAPP)2021 年发布的后生元共识声明,后生元是指“对宿主健康有益的无生命微生物和/或其成分的制剂”[1]。后生元含有多种活性成分,包括肽聚糖、磷壁酸等菌体成分,以及维生素、有机酸、细菌素、短链脂肪酸、酶和氨基酸等活性代谢产物[1]。根据微生物的类型、菌株和代谢产物的不同,后生元的效果也不同[2]。使用后生元有助于改善健康,已有研究表明,后生元具有免疫调节、预防感染、抗菌、抗病毒、抗氧化、抗肥胖、抗糖尿病、抗高血压、抗增殖、抗突变、抗肿瘤和减少食物过敏等作用[3-5]。后生元在宿主体内发挥预防和治疗双重作用,临床上使用后生元来缓解一系列疾病的症状,如婴儿绞痛、成人特应性皮炎和腹泻等。除具有多种功效外,后生元还具有多种优势:一是具有更高的安全性。后生元对一些特殊人群如新生儿、肠道手术人群以及一些敏感人群同样适应,而且后生元不受抗生素的干扰抑制,没有传递耐药基因风险;二是具有更高的稳定性。后生元可以耐受高温、氧气等环境,因此具有更长的保质期,运输储存也更方便;三是具有更广泛的作用靶点,不仅限于肠道,口腔、皮肤、泌尿生殖道或鼻咽等都可作为后生元的靶点,而且更易于被肠道吸收,提高利用率。后生元因其清晰的化学结构和安全剂量参数等,被认为是天然的免疫刺激剂、抗炎剂、抗氧化剂、抗菌剂以及生长促进剂[6]。
根据ISAPP 对后生元的定义,后生元不是单一的或纯化的化合物,是由多种活性成分组成的混合物。因此后生元通常是作为一个整体进行研究和开发应用。尽管如此,对其活性成分的解析、作用机制的研究仍是后生元研究的一个重要方向,这将为后生元的进一步研究和产业化提供重要的理论和科学依据。以抑菌功能后生元为例,根据文献报道,后生元中发挥抑菌作用的成分有胞外多糖、细菌素、有机酸等,对单核细胞增生李斯特氏菌、大肠杆菌、鼠伤寒沙门氏菌、铜绿假单胞菌等常见的致病菌具有较好的抑菌效果[7-8]。李书鸿等[9]通过对植物乳杆菌代谢产物的研究发现,其抑菌活性与植物乳杆菌菌株、病原指示菌及发酵碳源相关,且受上清液低pH 的影响,其中主要的抑菌物质有机酸。研究发现由鼠李糖乳杆菌L. 1.0320 中纯化出细菌素1.0320 在靶细胞细胞膜上形成孔洞,增加细胞膜通透性,增加质子动力势PMF(proton motive force)的耗散,破坏细胞膜的完整性,导致胞内内容物流出,诱导细菌死亡[10]。从微生物灭活方式来看,目前,制备后生元的方法通常有热处理、γ或紫外线照射、酶处理、超声处理、高压处理、溶剂萃取或它们的组合进行裂解等。大多数情况下,热处理是灭活益生菌菌体的常用方法,但作用时间和温度因微生物种类不同而不同,还取决于微生物自身的耐热性[11]。此外,2 株或者多株菌共发酵时不同菌株间会存在互作关系,从而引起菌株代谢活动发生变化[12-13],这给特定功能后生元的制备提供了思路。
近年来,抗生素耐药性的出现导致治疗失败的风险增加、复发和医疗保健系统成本增加[14]。耐甲氧西林金黄色葡萄球菌(MRSA)菌株是最常见的抗生素耐药菌之一,对大多数β-内酰胺类抗生素具有耐药性,包括甲氧西林、青霉素、碳青霉烯类、头孢菌素类及其衍生物。由于其分布广泛且具有多重耐药性,已成为令人担忧的超级细菌[15-16]。此外,MRSA还是一种常见的皮肤化脓感染致病菌,易通过接触传播形成流行传播,引起败血症、脓毒血症等疾病。MRSA 可形成具有保护作用的生物膜,阻挡抗菌剂,产生耐药性,使治疗效果变差。生物膜是附着在表面的微生物群落,它们由胞外聚合物基质的结构支持,该基质包含一种或多种胞外多糖、蛋白质和DNA,在细菌感染的持续存在中起重要作用[17]。MRSA 生物膜的存在致使其致病性和耐药性增加,因此开发针对MRSA 的绿色、不产生耐药性的天然抗菌制剂成为解决MRSA 致病性及耐药性的关键。
因此,本研究拟通过多株益生菌复合发酵,制备一种对MRSA 具有抑菌活性的后生元,研究其对MRSA 的抑菌活性及对MRSA 生物膜的影响,并探究其抑菌作用机制,为后生元在食品、医疗中使用提供理论依据。
1 材料与方法
1.1 材料与仪器
乳酸乳球菌乳亚种Postbio-F3、副干酪乳酪杆菌Postbio-P6、发酵粘液乳杆菌Postbio-Q7 来自青岛农业大学益生菌与后生元基础研究与开发应用创新实验室乳酸菌菌种库;耐甲氧西林金黄色葡萄球菌(MRSA)ATCC 43300 美国模式培养物集存库;甲氧西林 北京百奥莱博科技有限公司;LB 肉汤培养基、MRS 肉汤培养基、营养琼脂培养基(NA) 青岛海博生物技术有限公司;活性氧检测试剂盒 上海阿拉丁生化科技股份有限公司;胃蛋白酶(酶活力3 U/mg)、木瓜蛋白酶(酶活力600 U/mg)、蛋白酶K(酶活力30 U/mg)、胰蛋白酶(酶活力10 U/mg)、淀粉酶(酶活力100 U/mg)、脂肪酶(酶活力350 U/mg)TaKaRa 公司。
SU5000 扫描电子显微镜 株式会社日立制作所;TU-1810 型可见分光光度计 普析通用公司;Centrifuge 5810R 型冷冻离心机 艾本德公司;CLC111ECO 型恒温培养箱 MMM Medcenter Einrichtungen GmbH 公司;CMax Plus 酶标仪 美国MD 公司;SCIENTZ-WSQ 型全自动生长曲线分析仪 宁波新芝生物科技股份有限公司;Supcre G10 型全自动菌落分析仪 杭州迅数科技有限公司;BD FACSCalibur 流式细胞仪 美国BD 公司。
1.2 实验方法
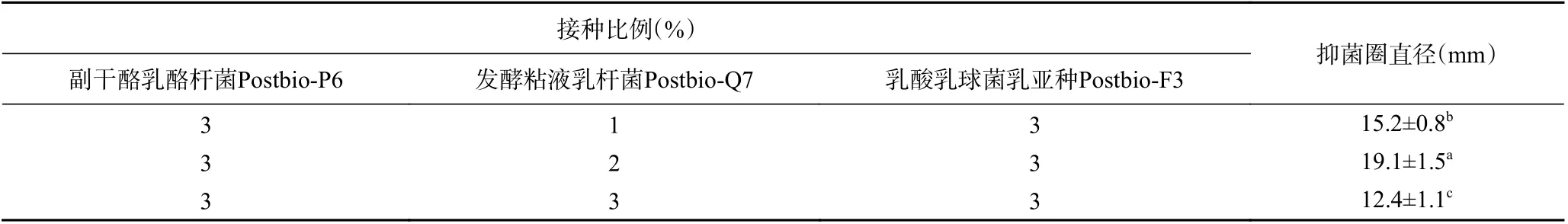
1.2.1 具有抑菌功能的后生元的制备 参考文献[18-19]报道方法并适当修改进行后生元的制备。将副干酪乳酪杆菌Postbio-P6、发酵粘液乳杆菌Postbio-Q7、乳酸乳球菌乳亚种Postbio-F3 按2%接种量分别接种MRS 液体培养基进行活化,培养条件为37 ℃好氧发酵24 h,pH 约3.8。将活化培养物按2%接种量分别接种MRS 液体培养基进行二代培养,培养条件同上。将二代培养物分别按3%、2%、3%接种量接种同一MRS 液体培养基进行复合发酵,发酵条件为37 ℃,好氧发酵24 h。发酵结束后首先进行镜检,通过菌落形态判断菌的增殖情况,然后将培养液于121 ℃高温高压灭菌30 min,通过菌落计数法确认是否完全灭活,将制备的后生元于-20 ℃保存备用。此外,通过测试3 种菌不同接种量下的抑菌活性,筛选确定3 种菌的最佳接种量。
1.2.2 抑菌实验
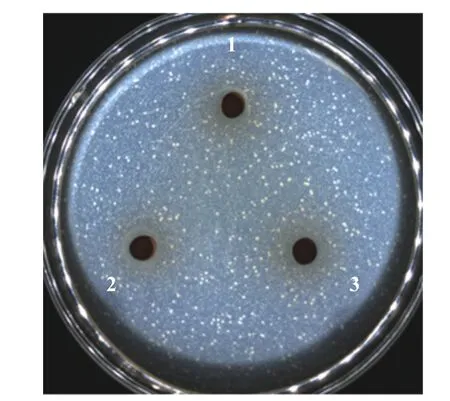
1.2.2.1 抑菌圈 将MRSA 接种到LB 液体培养基中,37 ℃培养16 h 活化备用。将最佳接种量条件下制备的后生元8000 r/min 离心10 min,分别收集上清液和沉淀(灭活菌体),上清液过0.22 μm 滤膜,沉淀用等量无菌水重悬。采用抑菌圈法分别验证后生元的上清液、沉淀以及未经离心的混合液对MRSA的抑菌活性。MRSA 用生理盐水稀释107CFU/mL的菌液后,吸取20 μL 菌液加入到30 mL 未凝固的LB 培养基(45 ℃以下)中,充分混匀后倾注到培养皿中。待培养基凝固后,用打孔器在培养基上打直径为 8 mm 的小孔。吸取上述后生元 200 μL 到琼脂孔,做3 个重复,对照孔加等量PBS(pH7.4,0.01 mol/L)。将培养皿置于4 ℃扩散4 h 后放入37 ℃恒温培养箱培养12 h,测量抑菌圈的大小[20-21]。
1.2.2.2 生长曲线的测定 将MRSA 用生理盐水稀释成1×105CFU/mL 的菌液,分别吸取100 μL 菌液加入到48 孔板的5 个孔中,然后吸取100 μL 浓度为12.5%、25%、50%和100%的YDFF 分别加入到孔中,对照孔中用等量PBS(pH7.4)代替,最后向每个孔中加入800 μL LB 培养基,组成1 mL 的培养体系,每个样品做3 个重复,37 ℃下振荡培养,每隔1 h 使用微生物生长曲线分析仪测量OD600值,24 h后对所有结果进行统计分析,并绘制成图。
1.2.3 后生元YDFF 对MRSA 的抑菌特性
1.2.3.1 酶对后生元YDFF 抑菌活性的影响 分别配置10 mg/mL 的胃蛋白酶、木瓜蛋白酶、蛋白酶K、胰蛋白酶、淀粉酶、脂肪酶溶液,与后生元按1:9混合,使酶的终浓度为1mg/mL。分别在酶最适宜pH 下置于 37 ℃水浴反应30 min,用相同体积的水与后生元混合作为对照,然后通过抑菌圈法测定各种酶对抑菌活性的影响。
1.2.3.2 pH 对后生元YDFF 抑菌活性的影响 用5 mol/L 的NaOH 和5 mol/L 的HCl 分别将后生元YDFF 的pH 调至3.0、4.0、5.0、6.0、7.0、8.0、9.0,按照1.2.2.1 的方法进行抑菌实验,测量并记录抑菌圈直径,分别测试不同pH 对 YDFF 抑菌活性的影响。根据实验结果选择合适的pH 用于后续实验。
1.2.3.3 后生元YDFF 中胞外多糖的抑菌活性判断参考文献[22]的方法,采用乙醇沉淀法对后生元YDFF 中的胞外多糖进行粗提。在后生元(pH7.0)中加入终浓度为 10%(质量体积分数)的三氯乙酸,充分混合,4 ℃静置过夜以沉淀蛋白,然后 4 ℃、12000 r/min 离心15 min 取上清,慢慢加3 倍体积的冰乙醇,4 ℃静置24 h,沉淀多糖。4 ℃、12000 r/min离心15 min 弃上清液,收集沉淀,挥发去除沉淀中的乙醇后进行冷冻干燥,得到胞外粗多糖提取物。配置12.5%、25%、50%胞外多糖溶液,通过抑菌圈法测试不同浓度胞外多糖的抑菌活性。
1.2.4 后生元YDFF 对MRSA 的抑菌机制
1.2.4.1 后生元YDFF 对MRSA 生物膜形成的影响参考文献[23]方法,通过结晶紫染色法测定后生元YDFF 对MRSA 生物膜形成的抑制作用。具体步骤如下:在96 孔平底培养板中每孔加入100 μL浓度为106CFU/mL 的MRSA 菌悬液和100 μL 浓度为25%、50%和100%的YDFF(pH7.0),对照组中加入等量的水,37 ℃恒温培养箱培养48 h 后,除净上层培养基以及游离细菌,用200 μL PBS 清洗3 次,再添加 200 μL 0.4%结晶紫染色15 min,吸走结晶紫;用无菌水清洗3 次洗去浮色,待干燥后用30%醋酸溶液脱色,用酶标仪测定OD600,按照以下公式计算后生元YDFF 对MRSA 生物膜形成的抑制率。
式中:ODc为对照组OD 值: ODt为后生元处理组的OD 值。
1.2.4.2 后生元YDFF 对MRSA 形态结构的影响将MRSA 活化并稀释至106~107CFU/mL,8000 r/min,离心10 min,用PBS 清洗3 次,除净上清液,加入100 μL 浓度100%的后生元YDFF(pH7.0),对照组加入等量的水。置于37 ℃水浴锅30 min 后,8000 r/min,离心10 min 收集沉淀,用PBS 清洗3 次,除净上清液,用 2.5% 的戊二醛溶液 4 ℃固定24 h;8000 r/min,离心10 min,用PBS 洗涤3 次,除净上清液;用浓度递增的乙醇(30%、50%、70%、80%、90%及100%)依次进行梯度脱水,脱水后对菌体细胞进行真空冷冻干燥,干燥后进行喷金包被,扫描电子显微镜观察细菌的细胞形态变化[24-25]。
1.2.4.3 后生元YDFF 对MRSA 胞内DNA 泄漏的影响 根据Yin 等[26]的方法,将MRSA 活化并稀释至106~107CFU/mL 后,8000 r/min,离心10 min,用PBS 清洗3 次,除净上清液,分别加入100 μL 浓度为25%、50%、100%的后生元YDFF(pH7.0),对照组加入等量的水。置于37 ℃水浴30 min 后,利用紫外分光光度计,通过比较阴性对照与后生元处理过后的MRSA 在260 nm 波长下吸光度值的变化,检测后生元处理MRSA 后的DNA 泄漏情况。
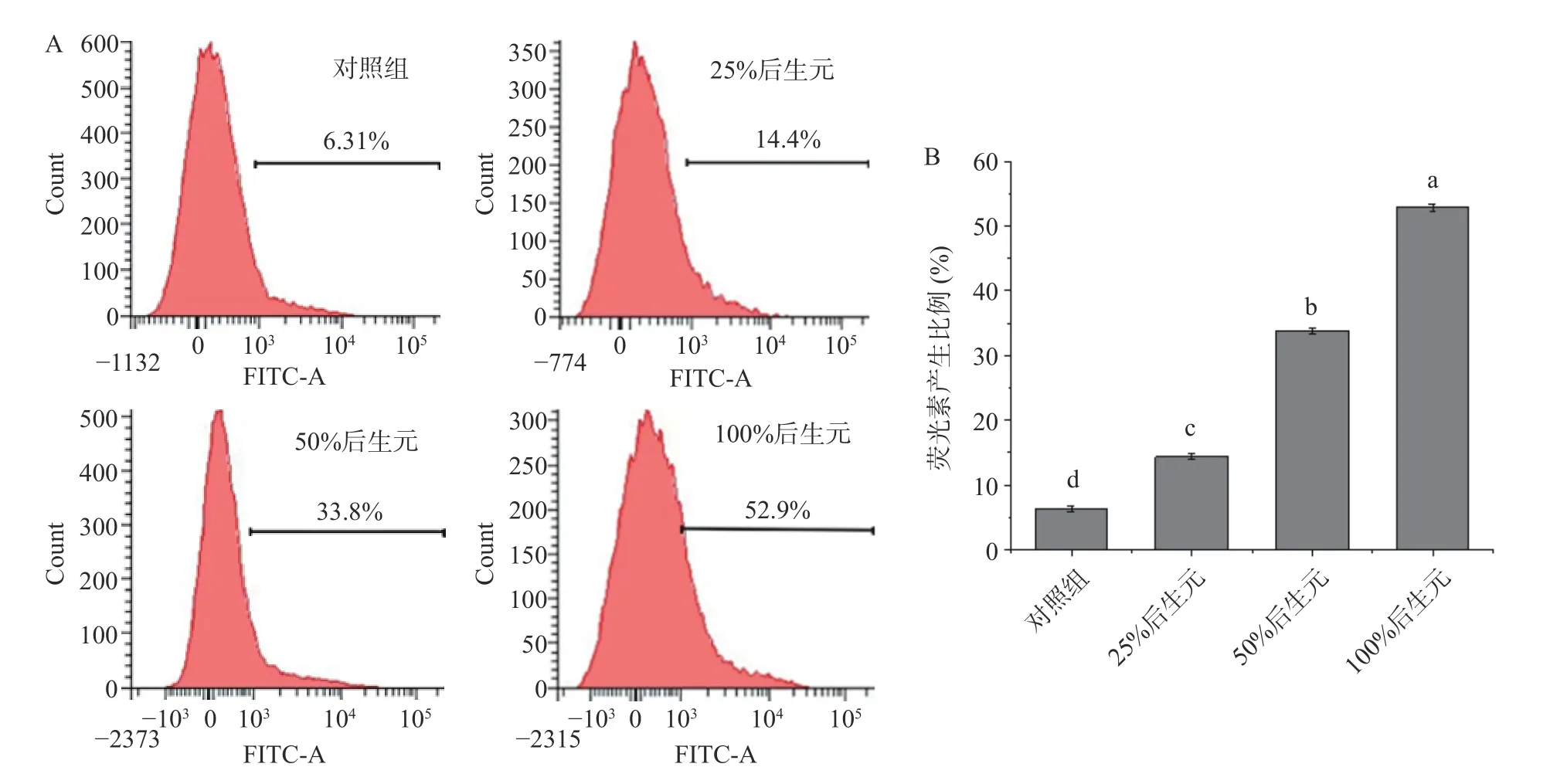
1.2.4.4 后生元YDFF 对MRSA 胞内ROS 产生的影响 采用活性氧检测试剂盒进行检测。试剂盒中的探针2',7'-二氯二氢荧光素二乙酸酯(H2DCF-DA)可以与细胞内产生的ROS 反应生成荧光素,通过流式细胞仪检测荧光素的荧光强度即可间接检测ROS 的产量[27]。离心收集106~107CFU/mL 的MRSA菌体,用 PBS 清洗3 次后重悬于 900 μL PBS 中,分别加入100 μL 浓度为25%、50%和100%的后生元YDFF(pH7.0),37 ℃水浴 30 min,未处理组用水做对照,分别加入终浓度为 10 mmol/L H2DCF-DA 37 ℃避光染色1 h,然后用PBS 清洗,最后用流式细胞仪检测后生元对MRSA 胞内ROS 产生的影响。
1.2.5 后生元YDFF 对MRSA 抗生素耐药性影响
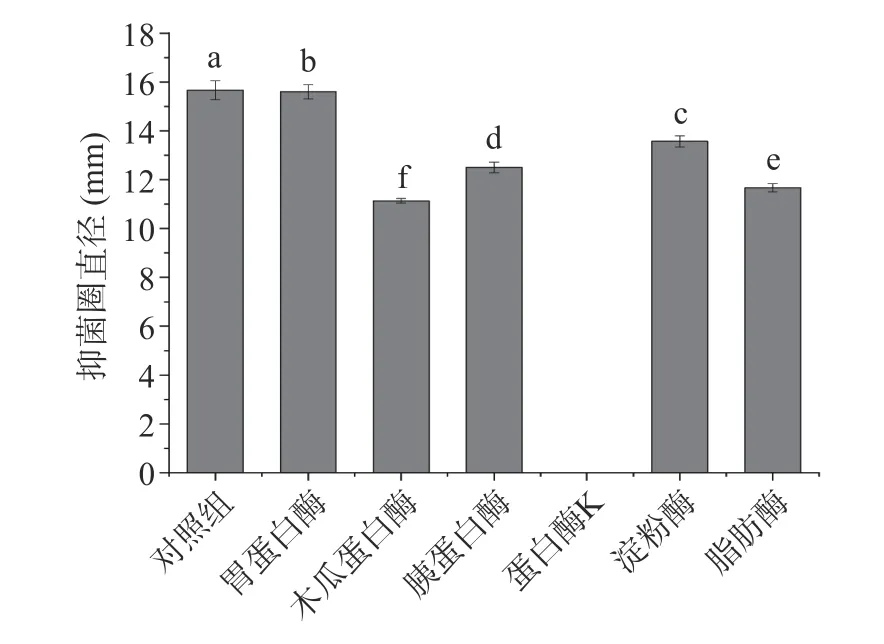
根据美国临床和实验室标准协会(CLSI)的标准并参考文献方法[28],使用棋盘式微量液基稀释法(简称棋盘法)检测后生元YDFF 对MRSA 的耐药性影响。首先测定后生元YDFF 和β-内酰胺类抗生素甲氧西林的最小抑菌浓度(MIC),并测定其对MRSA的分级抑菌浓度指数(FICI),FICI≤0.5 为两者抗菌具有协同作用,FICI>4 为拮抗作用,0.5 式中:MICa和MICb分别表示药物后生元和甲氧西林单用时的MIC 值,MICab是后生元在甲氧西林联合下的MIC 值,MICba是甲氧西林在后生元联合下的MIC 值[29]。 本文中所有实验均平行三次。所有数据均以平均值(mean)±标准差(SD)表示。采用 Origin 8.0 软件对实验结果进行数据统计,组间两两比较采用t检验法。 本研究对3 株菌的不同初始接种量进行了验证,由表1 可知,副干酪乳酪杆菌Postbio-P6、发酵粘液乳杆菌Postbio-Q7、乳酸乳球菌乳亚种Postbio-F3 在接种量分别为3%、2%、3%时所制备的后生元活性最高,说明在此接种比例下,菌株之间通过互作关系能够刺激相关代谢通路高量表达,从而产生更多抑菌活性物质,因此选用该接种量所制备的后生元用于后续实验。本研究采用高温高压方法制备后生元YDFF(含有死菌体和代谢产物),经测试抑菌活性未受影响,说明YDFF 中的抑菌活性物质耐受高温高压。此外,通过菌落计数法检测后生元YDFF 无活菌生长,证明高温高压方法灭菌完全。 表1 不同接种量对后生元抑菌活性的影响Table 1 Effects of different inoculated doses 2.2.1 抑菌圈实验 如图1A 所示,后生元YDFF 上清液和后生元YDFF 混合液对MRSA 均有明显的抑制作用。后生元YDFF 上清液对MRSA 的抑菌圈直径为19.1±1.5 mm,后生元YDFF 混合液对MRSA的抑菌圈直径为18.5±1.2 mm,而后生元YDFF 死菌体无抑菌活性。综上结果选用上清液进行后续的实验。 图1 后生元YDFF 对MRSA 的抑菌活性Fig.1 Antibacterial activity of postbiotic YDFF on MRSA 2.2.2 生长曲线的测定 不同浓度的后生元YDFF对MRSA 生长变化趋势影响如图1B 所示,未加后生元的空白对照组细菌生长呈现出典型的S 型生长曲线。添加浓度为50%和100%的后生元YDFF完全抑制了细菌的生长,OD 值基本不变;添加浓度为25%的后生元YDFF 在20 h 前细菌不生长,20 h开始轻微生长;而添加12.5%后生元尽管没有完全抑制细菌的生长,但细菌的对数生长期大大推迟,较对照推迟了12 h。上述结果说明后生元YDFF 可以显著抑制MRSA 的生长。 2.3.1 不同酶对后生元YDFF 抑菌活性的影响 实验验证了7种不同的酶对后生元YDFF 抑菌活性的影响,结果如图2 所示。从图中可以看出,后生元YDFF 对木瓜蛋白酶、蛋白酶K、胰蛋白酶、淀粉酶和脂肪酶较为敏感,对胃蛋白酶不敏感。其中,后生元YDFF 经蛋白酶K 处理后其活性完全丧失,由此可推断,后生元YDFF 中发挥抑菌作用的可能是蛋白类物质。 图2 不同酶对后生元YDFF 抑菌活性的影响Fig.2 Effects of different enzymes on the antibacterial activity of posttiotic YDFF 2.3.2 不同pH 对后生元YDFF 抑菌活性的影响由图3 可知,后生元YDFF 在pH3.0~9.0 范围内均具有抑菌活性。在酸性条件下(pH3.0~6.0),随着pH 降低,抑菌活性呈现增高趋势;而在中性和碱性条件下(pH7.0~9.0),抑菌活性呈现先升高后降低的趋势,在pH8.0 时活性达到最大。通常后生元成分中发挥抑菌作用的主要有细菌素和有机酸等物质[30-31],YDFF 在pH7.0 时仍保持较好活性,说明YDFF 中除了有机酸还有其他活性抑菌成分。上述结果说明YDFF 抑菌活性具有较宽的pH 耐受范围,这对YDFF的实际应用具有重要意义。 图3 不同pH 对YDFF 抑菌活性的影响Fig.3 Effects of pH on the antibacterial activity of YDFF 2.3.3 后生元YDFF 中胞外多糖的抑菌活性判断通过乙醇沉淀法粗提后生元YDFF 中的胞外多糖,并验证后生元中的胞外多糖是否具有抑菌活性。如图4 所示,12.5%、25%、50%的胞外多糖对MRSA均无抑菌作用,初步判断后生元中发挥抑菌活性的物质不是多糖。 图4 后生元YDFF 中胞外多糖的抑菌活性Fig.4 Antibacterial activity of extracellular polysaccharides in YDFF on MRSA 本论文通过结晶紫染色法测定了后生元YDFF对MRSA 生物膜形成的抑制作用。由图5 可知,后生元YDFF 对MRSA 生物膜的形成具有显著的抑制作用(P<0.001),100%、50%、25%后生元对MRSA生物膜的抑制率分别为81.2%、78.3%、76.8%,且呈现一定的浓度依赖性。据报道,细菌的生物膜与细菌的致病性、毒力密切相关,尤其与其抗生素耐药性相关[32]。由此推断,后生元YDFF 可能会通过破坏MRSA生物膜抑制细菌生长并降低细菌的耐药性。 图5 后生元YDFF 对MRSA 生物膜的形成的影响Fig.5 Effect of the YDFF on biofilm formation of MRSA 通过扫描电镜观察后生元YDFF 对MRSA 菌体形态结构的影响,如图6 所示,对照组中未经后生元处理的MRSA 菌体细胞为典型的细胞结构,菌体圆型,表面圆润光滑,细胞表面完全没有破损,结构完整,而且菌体生长良好,没有聚集皱缩;后生元YDFF处理的MRSA 细胞壁和细胞膜被破坏,菌体变形并有溶解现象,细胞完整性丧失,细胞整体结构坍塌。由此可见,后生元YDFF 可以有效地破坏MRSA 的菌体结构,对MRSA 具有损伤作用,能够引起细胞内容物的泄漏。 图6 后生元YDFF 对MRSA 的形态结构影响Fig.6 Effect of YDFF on the morphological structure of MRSA 当细胞膜通透性受到破坏时,细胞膜的选择性下降,DNA 等细胞内容物流出。因此通过测定DNA泄漏可以反映细菌细胞膜结构的完整性[33]。如图7所示,经后生元YDFF 处理后,MRSA 胞内DNA 出现了泄漏(P<0.001),且随着后生元浓度的增加,胞内DNA 泄漏量也逐渐增多,说明后生元YDFF 破坏了MRSA 细胞膜的完整性,导致细胞内容物外泄。 图7 后生元YDFF 对MRSA 的DNA 泄漏影响Fig.7 Effect of postibiotic YDFF on DNA leakage in MRSA 活性氧ROS 是一种可参与许多细胞的生理活动的重要分子,它能维持细胞内氧化还原平衡,与细胞的生长和死亡密切相关,但过量的ROS 会引发细胞内的氧化应激反应,从而导致细胞损伤[34-36]。本论文通过流式细胞仪检测后生元YDFF 对MRSA 胞内ROS 产生的影响,如图8A 所示,对照组检测到的产荧光素的细菌占比为6.31%,添加25%、50%、100%后生元检测到的产荧光素的细菌占比分别为14.4%、33.8%、52.9%,且随着后生元浓度升高,荧光强度也增加,具有显著的浓度依赖性(图8B),说明后生元YDFF 可以显著促进胞内ROS 升高,这可能也是后生元YDFF 对MRSA 产生抑菌活性的其中一个原因。 图8 不同浓度后生元YDFF 对MRSA 胞内ROS 产量的影响Fig.8 Effects of different concentrations of postbiotic YDFF on intracellular ROS production of MRSA 为验证后生元YDFF 对MRSA 抗生素耐药性的影响,本研究联合后生元YDFF 与β-内酰胺类抗生素甲氧西林,测定其对MRSA 的FICI。结果如表2所示,后生元YDFF 和甲氧西林联合用药后,后生元的MIC 由原来的0.78%降低至0.025%,甲氧西林的MIC 由原来的0.98 μg/mL 降低至0.25 μg/mL,而联用后FICI 降低至0.38(<0.5),说明YDFF 可以显著降低MRSA 对甲氧西林的耐药性,与甲氧西林联合具有协同增强作用。后生元YDFF 降低MRSA耐药性可能与其抑制MRSA 生物膜有关,这为有效缓解细菌耐药性问题、减少抗生素使用提供了新的解决思路。 表2 后生元YDFF 对MRSA 耐药性的影响Table 2 Effect of postbiotic YDFF on antibiotic resistance of MRSA to methicillin 本研究通过复合发酵多株益生菌制备得到一种对MRSA 具有显著抑菌活性的后生元YDFF。实验证明后生元YDFF 抑菌活性具有较好的pH 耐受性,在pH3.0~9.0 均可发挥抑菌作用,且在pH 中性条件下仍保持较高抑菌活性,说明后生元YDFF 中发挥抑菌作用的主要成分不只是有机酸;提取后生元YDFF 胞外多糖并验证其抑菌活性,结果发现胞外多糖无抑菌活性,表明后生元YDFF 中发挥抑菌作用的不是多糖类;酶敏感性实验发现蛋白酶K 可以使后生元YDFF 抑菌活性完全丧失。综上结果初步推断后生元YDFF 中发挥抑菌作用的主要成分可能为蛋白类物质。对后生元YDFF 的抑菌活性机制研究表明,后生元YDFF 通过破坏细胞膜结构增加细胞膜通透性、抑制生物膜形成、增加胞内ROS 浓度等多种方式发挥抑菌作用。另外,本研究通过测定FICI 值来验证后生元YDFF 对MRSA 耐药性的影响,实验结果显示后生元YDFF 和甲氧西林联用的FICI 降低至0.38,说明YDFF 和甲氧西林对MRSA具有协同抗菌作用,YDFF 可以显著降低MRSA 对甲氧西林的耐药性,这为有效缓解细菌耐药性问题、减少抗生素使用提供了新的解决思路。 本论文初步判断后生元YDFF 中发挥抑菌作用的主要物质可能是蛋白类的活性物质,这尚需对其抑菌活性成分进行进一步解析。另外,在抑菌机制方面,通过转录组学、蛋白组学等多组学技术,深入阐明后生元对细菌发挥作用的分子机制也是未来研究的重要方向。1.3 数据处理
2 结果与分析
2.1 具有抑菌功能的后生元的制备
2.2 后生元YDFF 对MRSA 的抑菌作用

2.3 后生元YDFF 对MRSA 的抑菌特性

2.4 后生元对MRSA 生物膜形成的影响

2.5 后生元对MRSA 形态结构的影响

2.6 后生元对MRSA 胞内DNA 泄漏的影响

2.7 后生元YDFF 对MRSA 胞内ROS 产生的影响
2.8 后生元YDFF 对抗生素耐药性影响

3 结论

