雪地茶内生真菌Apiospora malaysiana体外抑菌活性及稳定性研究
贺秋桦,刘梦龙,郭启新,丁海燕,*
(1.大理大学公共卫生学院,云南大理 671000;2.大理州质量技术监督综合检测中心,云南大理 671000)
由致病微生物污染导致的食源性疾病每年危害着数十亿人的健康,特别在经济欠发达国家,该现象更加严重,世界卫生组织(WHO)将食品安全定为本世纪优先解决的重大问题之一[1-2]。随着人们对食品安全的重视程度逐渐加深,开发新型安全高效的抗菌药物及食品防腐剂迫在眉睫。雪地茶(Thamnolia subuliformis(Ehrh.) W. Culb.)又名太白茶、石白茶,霜降衣科地茶属地衣,主要生长在高海拔、高寒地区的阴湿岩石和苔地上,是我国传统名贵中药之一[3]。作为天然的保健饮品和传统药物,雪地茶在民间常被人们以水煎服或泡饮以达到清热解毒、安神明目等目的[3-4]。近年来,关于雪地茶生物活性的报道逐渐增多,如抗菌、抗肿瘤、延缓衰老、降血压等[4-6]。在课题组前期研究中发现,雪地茶甲醇提取物对金黄色葡萄球菌、表面葡萄球菌等革兰氏阳性菌及甲型和乙型副伤寒杆菌、大肠杆菌等革兰氏阴性菌以及致病真菌白色念珠菌均具有较强的抑菌活性,且其提取物在高温、紫外照射等不良条件下抑菌活性稳定性较好[4],具有进一步开发的潜力。但由于雪地茶生长环境特殊、生长极其缓慢,持续大量采收导致了雪地茶资源的枯竭,其药用价值及作用机理还未被充分挖掘已步入濒危灭绝的境地,保证其资源的可持续利用是当务之急[7]。
研究发现雪地茶发挥抑菌活性的次生代谢产物大部分来自于其复合体中的真菌[8]。内生真菌是存在于雪地茶体内且不会对其造成伤害的一类真菌[9-10],可产生与宿主相同或相似的抑菌活性产物[11],因此可作为雪地茶替代物开发其抑菌活性成分以缓解雪地茶资源短缺的问题[12]。前期在建立雪地茶内生真菌资源库并进行抑菌活性初筛时发现,从雪地茶中分离得到的一株编号为202109-Ts-F017 的内生真菌对多种耐药菌均有较好的抑菌活性,经文献调研其抑菌活性的报道尚未查见,因此对内生真菌202109-Ts-F017 抑菌活性进行研究有重要的科学意义,但目前202109-Ts-F017 的抑菌谱及体外抑菌稳定性尚未明确。
因此文章将以202109-Ts-F017 为研究对象,在分别比较了几种常见的体外抑菌方法后,结合抑菌效果、操作便捷性以及经济性等因素,分别筛选出针对细菌和真菌的最优抑菌方法以进一步探究内生真菌202109-Ts-F017 对常见食源性致病菌、植物致病菌的体外抑制活性,根据抑菌活性的结果,选择对202109-Ts-F017 敏感性最高的致病菌作为指示菌,并对该内生真菌的体外抑菌活性稳定性进行研究,为雪地茶内生真菌资源的开发及利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
菌株202109-Ts-F017 为课题组从雪地茶中分离所得,经ITS 序列比对鉴定为炭角菌目梨孢假壳属Apiospora malaysiana(昆明擎科生物科技有限公司),菌种现保存于大理大学公共卫生学院微生物实验室;金黄色葡萄球菌(Staphylococcus aureusATCC 25923)、斯氏李斯特菌(Listeria seeligeriCICC 21671)、单增李斯特菌(Listeria monocytogenesCMCC 21633)、表皮葡萄球菌(Staphylococcus epidermidisATCC 12228)、甲型副伤寒杆菌(Salmonella paratyphi-ABNCC 336664)、大肠埃希氏菌(Escherichia coliCMCC(B) 441027)、福氏志贺菌(Shigella flexneriCMCC 21534)、肺炎克雷伯杆菌(Klebsiella pneumoniaeATCC 4352) 大理州质量技术监督综合检测中心提供;耐药型白色念珠菌(Drug-resistantCandida albicansATCC 10231) 大理大学基础医学院提供;耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcus aureus,MRSA ATCC 43300)、灰葡萄孢(Botrytis cinereaBNCC 119830)、立枯丝核菌(RhizoctoniasolaniBNCC 356048)、油菜菌核病菌(Sclerotinia sclerotiorumBNCC 122299)、西瓜专化型尖孢镰刀菌(Fusarium oxysporum f. sp. niveumBNCC 225899)
购自北京北纳创联生物技术研究院;营养琼脂北京陆桥技术股份有限公司;胰酪大豆胨琼脂培养基、LB 肉汤、沙氏葡萄糖液体培养基、马铃薯葡萄糖琼脂培养基(PDA 培养基)、马铃薯葡萄糖水培养基(PDB 培养基) 广东环凯微生物科技有限公司;乙酸乙酯、二甲基亚砜(Dimethyl sulfoxide,DMSO)、氢氧化钠(NaOH)、盐酸(HCL) 分析纯,上海麦克林生化科技有限公司;盐酸左氧氟沙星片 山东罗欣药业集团股份有限公司;氟胞嘧啶片 精华制药集团股份有限公司;98%异菌脲原药 上海阿拉丁生化科技股份有限公司。
VS-1300L-U 型超净工作台 苏净集团泰安公司制造;MJ-54A 型高压蒸汽灭菌锅 施都凯仪器设备(上海)有限公司;GHP-9270 型隔水式恒温培养箱、HWS-28 型电热恒温水浴锅 上海一恒科学仪器有限公司;MQL-61R 型震荡培养箱 上海旻泉仪器有限公司;RE-3000 型旋转蒸发仪 上海亚荣生化仪器厂;T6 新世纪型紫外可见分光光度计 北京普析通用仪器有限责任公司;SB-5200DTDN 型超声波清洗机、Scientz-ND 型系列冷冻干燥机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 雪地茶内生真菌Apiospora malaysiana体外抑菌活性筛查
1.2.1.1 三种体外抗细菌活性筛查方法比较Apiospora malaysiana发酵液粗提物的制备:参考周璇等[13]的方法并做一定修改。取平板上生长良好的Apiospora malaysiana菌饼接种于无菌PDB 培养基中,在振荡摇床中以150 r/min,28 ℃培养条件培养5~7 d 后,用等体积乙酸乙酯对内生真菌发酵液分别进行超声30 min(超声频率为60 KHz,温度为28 ℃)、抽滤、萃取等步骤,重复上述步骤3 次后,取各萃取液有机层减压浓缩得Apiospora malaysiana发酵液粗提物。
含菌悬液平板的制备:用接种环取适量4 ℃保存的金黄色葡萄球菌菌体于无菌生理盐水中,采用0.5 麦氏比浊将菌液浓度调整至108CFU/mL 后,以2%接菌量将调整好浓度的菌液接入10 mL 的无菌LB 肉汤中,37 ℃振荡培养过夜。培养好的菌液通过2 次离心弃去上清液后,采用麦氏比浊法将菌液浓度调整至106CFU/mL 备用。将无菌营养琼脂培养基与配制好的菌液按20∶1 的体积比混匀后倒入培养皿中,待其凝固后备用。
三种体外抗细菌活性筛查方法比较:平板打孔法[14]:用6 mm 的打孔器在培养基中打出4 个等距的孔,相邻两孔各加入20 μL 发酵液粗提物(100 mg/mL)作为处理组,另两孔分别加入20 μL 0.5 mg/mL 的盐酸左氧氟沙星溶液(用DMSO 配制)、DMSO 为阳性对照和阴性对照。滤纸片法[15]:将6 mm 的滤纸片灭菌干燥后,用无菌镊子夹取4 份滤纸片等距贴放在培养基表面,加样方式及其余处理同平板打孔法。牛津杯法[16]:用镊子夹取4 只无菌的6 mm 牛津杯等距轻放在含菌悬液的平板表面,轻轻按压,使之充分接触但不压迫琼脂表面,加样方法及其余处理同平板打孔法。三种处理方法的平板均在培养箱37 ℃正置培养18 h 后观察抑菌圈形成情况。
1.2.1.2 三种体外抗真菌活性筛查方法比较 菌种活化:将斜面生长良好的菌株接种在无菌PDA 平板培养基上,28 ℃培养7 d 备用。
三种体外抗真菌活性筛查方法比较:平板对峙法:参考Yu 等[17]的方法并进行一定的修改。用6 mm打孔器在Apiospora malaysiana与灰葡萄孢菌落边缘菌丝生长旺盛的地方打取菌饼,挑取两种真菌的菌饼放置在无菌PDA 培养基,两菌饼相距3 mm。以只接种灰葡萄孢的PDA 培养基、只含PDA 培养基的平板作为对照组。滤纸圆片扩散法[16]:将1.2.1.1 汇总到的发酵液粗提物用DMSO 复溶至100 mg/mL。用无菌镊子夹取3 份无菌干燥的滤纸片等距置于PDA 培养基表面,其中一滤纸片加入20 μL 发酵液粗提物,另两个滤纸片各分别加入20 μL 的5 mg/mL异菌脲溶液(用DMSO 配制)、DMSO 溶液为阳性对照和阴性对照。菌丝生长速率法[18]:称取适量1.2.1.1中得到的Apiospora malaysiana发酵液粗提物并加入PDA 培养基中混匀,使得培养基中发酵液粗提物终浓度为1 mg/mL,待其凝固后备用。用6 mm 打孔器在灰葡萄孢菌落边缘菌丝生长旺盛的地方打孔获取菌饼并将其置于制备好的培养基平板中央,将灰葡萄孢菌饼放置在含5 μg/mL 的异菌脲溶液培养基中作为阳性对照,以只含无菌PDA 培养基接种同样大小的灰葡萄孢菌饼作为阴性对照。处理完成后,在28 ℃培养箱中倒置培养5~7 d 后观察平板菌落生长情况。运用十字交叉法测量菌落直径,三种方法抑制率计算公式为[19]:
1.2.1.3Apiospora malaysiana 体外抑菌活性试验根据1.2.1.1 和1.2.1.2 试验结果,综合考虑各方面因素后,分别选择平板打孔法、菌丝生长速率法探究Apiospora malaysiana的体外抑制细菌及真菌活性。在抑制细菌部分的试验中,除菌液浓度调整中耐甲氧西林金黄色葡萄球菌(MRSA)为105CFU/mL,其余菌株菌液浓度均为106CFU/mL、白色念珠菌及大肠杆菌菌悬液平板的制备使用涂布平板法、白色念珠菌的阳性对照为5 mg/mL 的氟胞嘧啶溶液(用DMSO 配制)三项以外,其余操作方法同1.2.1.1 平板打孔法。处理完成后在37 ℃培养箱中正置培养18 h 后,观察并记录抑菌圈的大小,参考Li 等[20]的研究对Apiospora malaysiana体外抑菌活性进行判断。在菌丝生长速率法抑菌试验中,四种植物病原真菌的阳性对照均为98%异菌脲溶液(用DMSO 配制),浓度分别为灰葡萄孢、立枯丝核菌5 μg/mL,油菜菌核病菌、尖孢镰刀杆菌20 μg/mL。其余步骤及计算公式同1.2.1.2。
1.2.2 雪地茶内生真菌Apiospora malaysiana体外抑菌稳定性试验 根据1.2.1.3 的试验结果,以对Apiospora malaysiana敏感性较高的致病菌金黄色葡萄球菌作为指示菌,运用平板打孔法探究Apiospora malaysiana在不同的保存时间、温度、紫外照射时间以及pH 的影响下体外抑菌效果的稳定情况。
1.2.2.1 保存时间对Apiospora malaysiana体外抑菌活性的影响 参考郭星汝等[21]的方法并进行一定修改。将Apiospora malaysiana发酵液粗提物用DMSO复溶到浓度为100 mg/mL 后分别在4 ℃冰箱避光保存0(对照组)、3、7、14、21、28 d 后,采用平板打孔法测定其对金黄色葡萄球菌的抑菌圈大小,具体操作方法同1.2.1.1。
1.2.2.2 温度对Apiospora malaysiana体外抑菌活性的影响 参考Mao 等[22]的方法并进行一定的修改。将Apiospora malaysiana发酵液粗提物用DMSO 复溶到浓度为100 mg/mL 后再分别在4.0(对照组)、31.0(室温)、40.0、60.0、80.0、94.1 ℃(受云南大理地理海拔的影响,加热温度不能达到100 ℃)的水浴锅中分别避光水浴处理1 h,为保证发酵液量不改变,在水浴过程中均需加盖。采用平板打孔法测定其对金黄色葡萄球菌的抑菌圈大小,具体操作方法同
1.2.1.1。
1.2.2.3 紫外照射时间对Apiospora malaysiana体外抑菌活性的影响 参考王璇等[23]的方法并进行一定的修改。将Apiospora malaysiana发酵液粗提物用DMSO 复溶到浓度为100 mg/mL 后分别在紫外灯下(功率20 W,样品距紫外光源垂直距离20 cm)分别照射0(对照组)、15、30、45、60、75 min,采用平板打孔法测定其对金黄色葡萄球菌的抑菌圈大小,具体操作方法同1.2.1.1。
1.2.2.4 pH 对Apiospora malaysiana体外抑菌活性的影响 参考Zangeneh 等[24]的方法并进行一定的修改。将Apiospora malaysiana发酵液粗提物用DMSO 复溶到浓度为100 mg/mL 后分别用1 mol/L HCl 和1 mol/L NaOH 溶液将发酵液粗提物pH 调整至2.0、4.0、6.0、8.0、10.0,以未调整pH 的发酵液粗提物作为对照组(pH5.5),采用平板打孔法测定其对金黄色葡萄球菌的抑菌圈大小,具体操作方法同1.2.1.1。
1.3 数据处理
试验每个处理重复5 次,试验结果均以均数±标准差(Mean±SD)表示,采用SPSS 26.0 软件进行数据整理及分析,统计学方法采用单因素方差分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 雪地茶内生真菌Apiospora malaysiana 体外抑菌活性试验
2.1.1 三种抑制细菌方法的比较 试验以金黄色葡萄球菌为指示菌,探究3 种抑菌方法的抑菌效果,结果表明Apiospora malaysiana在三种抑菌方法试验中对金黄色葡萄球菌的抑菌圈大小无统计学差异(P>0.05)(表1),说明三种抑菌方法均可用于Apiospora malaysiana粗提物体外细菌抑制活性筛查。三种抑菌方法均属于琼脂扩散法,样品通过扩散均匀分布在琼脂中从而发挥抑菌作用,平板打孔法中样品接触琼脂的面积大于其余两种方法、样品接触琼脂的高度小于另两种方法,表明Apiospora malaysiana粗提物的扩散速度和范围与其接触培养基的面积、平板中接触培养基的高度均无关。但相较于另两种方法,平板打孔法在实际操作过程中操作更加便捷、污染可能性小、无需额外购买器材,且由于液体的表面张力作用,孔中样品不易流出,使得加样量可控,更能获得理想的抑菌圈[25],因此后续试验选用平板打孔法来进一步验证Apiospora malaysiana对致病细菌的体外活性。

表1 三种不同抑菌方法测定Apiospora malaysiana 对金黄色葡萄球菌的抑制效果Table 1 Inhibitory effect of Apiospora malaysiana on Staphylococcus aureus determined by three different antibacterial methods
2.1.2 三种抑制真菌方法的比较 试验以灰葡萄孢为指示菌,探究不同抑制真菌方法的抑菌效果(表2),结果表明Apiospora malaysiana在三种抑菌方法试验中对灰葡萄孢的抑菌效果都存在统计学差异(P<0.05),菌丝生长速率法>平板对峙法>滤纸圆片扩散法。在菌丝生长速率法中,Apiospora malaysiana发酵液粗提物对灰葡萄孢的抑菌率(100%)高于阳性对照异菌脲的抑制率(92.9%),猜测对Apiospora malaysiana发酵液粗提物继续分离纯化后可能得到数量较多的抑菌能力与异菌脲相似或者比其更强的单体化合物,并且可能与异菌脲抑菌机理(降低病原真菌侵染寄生植物重要的致病因子胞外多糖的含量从而达到抑菌的作用)相似[26],为Apiospora malaysiana抑菌机理及靶点的研究提供理论参考,表明Apiospora malaysiana有开发成农用杀菌剂的巨大潜力。另外,菌丝生长速率法的处理组抑制率远高于平板对峙法的抑制率,其原因可能是Apiospora malaysiana的作用形式不同导致抑菌效果的不同-其发酵液粗提物的抑菌效果远强于真菌菌块的作用,说明Apiospora malaysiana中存在的主要抑菌物质多溶于有机溶剂,且在提取浓缩后形成了较强的抑菌效果,除此之外,和菌丝生速率法可准确控制样品用量不同的是,平板对峙法只能作为定性研究[27],表明菌丝生长速率法优于平板对峙法。而相较于菌丝生长速率法,滤纸圆片扩散法则无抑制效果,尽管二者使用的样品均为Apiospora malaysiana发酵液粗提物,但滤纸圆片扩散法中样品的浓度远低于菌丝生长速率法,说明试验样品的抑菌活性与浓度呈正相关,且其效果的评判具有较高的阈值,这与翟娅菲等[28]的结果相一致,是滤纸片法所做不到的。综合上述结果,针对抑制真菌的活性筛查的试验方法的选择中,菌丝生长速率法更加敏感和准确,可反应待测物的真实抑菌情况,因此后续试验选用菌丝生长速率法进一步验证Apiospora malaysiana对植物致病真菌的体外抑菌活性。

表2 不同抑菌方法测定Apiospora malaysiana 对灰葡萄孢的抑制效果Table 2 Inhibitory effect of Apiospora malaysiana on Botrytis cinerea by different antifungal methods
2.1.3Apiospora malaysiana体外抑菌活性试验 在明确活性筛查方法的优劣后,试验采取最优方法进一步探究Apiospora malaysiana对多种致病细菌如金黄色葡萄球菌、斯氏李斯特菌、单增李斯特菌、表面葡萄球菌、MRSA 等革兰氏阳性菌,甲型副伤寒杆菌、大肠埃希氏菌、福氏志贺菌、肺炎克雷伯菌等革兰氏阴性菌及致病真菌白色念珠菌(表3)、灰葡萄孢、油菜菌核病菌、立枯丝核菌以及西瓜专化型尖孢镰刀菌的抑制活性(表4)。5 种致病菌对Apiospora malaysiana粗提物高度敏感,其抑菌圈直径排序为金黄色葡萄球菌>斯氏李斯特菌>单增李斯特菌>白色念珠菌>表面葡萄球菌,表明Apiospora malaysiana粗提物有广泛且良好的抑菌活性,有被开发成天然广谱抗菌先导化合物、食品保鲜剂的巨大潜力,特别是对危害广泛、临床耐药严重的金黄色葡萄球菌和单增李斯特菌两种食源性致病菌的防治药物的开发有重要的现实意义[29-31]。另外,Apiospora malaysiana发酵液粗提物对革兰氏阳性菌有较强的抑制作用而对革兰氏阴性菌无抑制效果,猜测是粗提物阻止了革兰氏阳性菌细胞壁中独有的磷壁酸结构的生成,导致细胞壁合成受阻,从而达到抑菌作用,粗提物抑菌对象的偏向性提示我们或可把研究热点放在破坏致病菌独有的细胞结构上,以为革兰氏阳性菌日益严重的耐药问题提供解决思路。另外,Apiospora malaysiana发酵液粗提物对不同细菌的抑制作用存在统计学差异(P<0.05),说明不同细菌的细胞壁成分及含量有细微差别,导致对粗提物的敏感性不同。与此同时,Apiospora malaysiana发酵液粗提物对灰葡萄孢、立枯丝核菌的抑制率达100%,对油菜菌核病菌也有很强的抑制率(90%),对西瓜专化型尖孢镰刀菌的抑制率也超过了50%,表明粗提物在子囊菌门及担子菌门致病真菌广泛的防治及应用潜力,另外有研究发现灰葡萄孢致病基因BcPDR1 可以调控病菌的生长、发育和致病力,推测BcPDR1 可以作为防治灰霉病药物筛选的新靶标[32],提示粗提物或影响了病原真菌致病基因的表达从而达到抑菌效果,为粗提物的单体化合物后续抑菌作用靶点的选择提供了新思路。综上,Apiospora malaysiana粗提物对不同的致病细菌、真菌均有较好的抑制作用,表明其有被开发成广谱抗菌药物及农用杀菌剂的巨大潜力。

表3 平板打孔法测定Apiospora malaysiana 的体外抑菌作用Table 3 Determination of in vitro antibacterial effect ofApiospora malaysiana by plate punching method
2.2 雪地茶内生真菌Apiospora malaysiana 体外抑菌稳定性试验
在2.1 实验结果的基础上,试验以敏感性最强的金黄色葡萄球菌为指示菌,进一步探究在不同的外界因素影响下Apiospora malaysiana的体外抑菌活性稳定性。以期为Apiospora malaysiana后续的抑菌活性物质开发利用提供理论基础。
2.2.1 保存时间对Apiospora malaysiana体外抑菌活性的影响 不同保存时间对Apiospora malaysiana体外抑菌活性的影响见表5。Apiospora malaysiana发酵液粗提物在4 ℃冰箱保存0、3、7、14、21、28 d 后,各处理组体外抑菌活性与对照组相比无统计学差异(P>0.05)。说明Apiospora malaysiana发酵液粗提物有较强的稳定性,抑菌活性物质在4 ℃环境中保存较长时间也不易发生变化,因此常规的保存方式及较长时间的保存对其抑菌活性不会造成影响。Apiospora malaysiana发酵液粗提物保存时间的稳定性是其后续的抑菌活性开发的基础与保障。组保持在同一水平,表明雪地茶内生真菌抑菌活性成分的性质较为稳定。已有研究证明雪地茶对紫外线有一定的耐受作用[6],且生活在雪域高原的人们也常以食用雪地茶以抵抗紫外线的照射[35],从而佐证了该试验结果。

表5 保存时间对Apiospora malaysiana 体外抑菌活性的影响Table 5 Effect of preservation time on in vitro antibacterial activity of Apiospora malaysiana
2.2.2 温度对Apiospora malaysiana体外抑菌活性的影响 由表6 可知,Apiospora malaysiana发酵液粗提物经过不同温度处理后,体外抑菌活性与对照组相比没有显著差异(P>0.05)。即使经过94.1 ℃的高温处理1 h 后,其抑菌活性依旧未发生明显变化,表明Apiospora malaysiana发酵液粗提物有较好的热稳定性。雪地茶中可能存在的某些抑菌活性物质如松萝酸有较高的熔点和沸点,高温处理下也不易发生分解[4,33],学者在对松萝酸提取条件的优化研究中发现,提取温度达95 ℃时对松萝酸的得率也无明显影响[34],进一步佐证了试验结果。因此常规的试验温度更加不会对其抑菌活性造成影响。

表6 温度对Apiospora malaysiana 体外抑菌活性的影响Table 6 Effect of temperature on in vitro antibacterial activity of Apiospora malaysiana
2.2.3 紫外照射时间对Apiospora malaysiana体外抑菌活性的影响 表7 显示不同紫外照射时间对Apiospora malaysiana体外抑菌活性的影响,Apiospora malaysiana粗提物经不同时长的紫外照射后,抑菌活性与对照组相比没有显著差异(P>0.05)。即使经过1 h 以上的紫外光照射后,其抑菌活性仍与对照
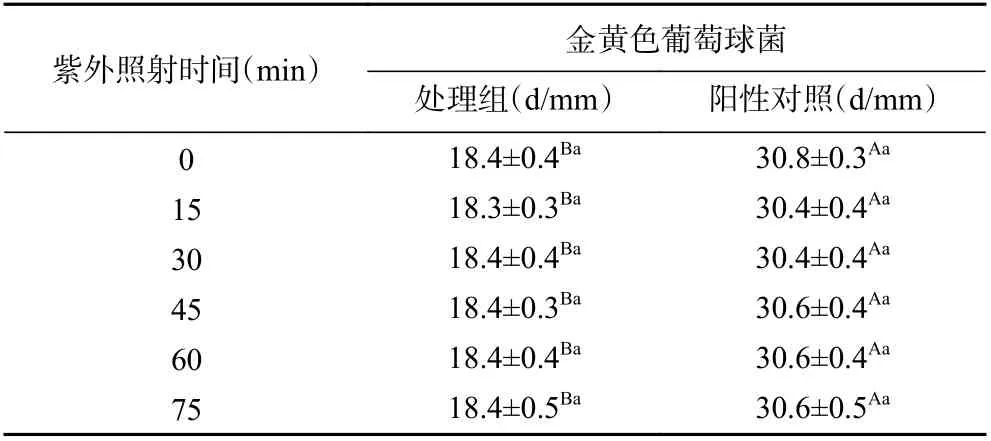
表7 紫外照射时间对Apiospora malaysiana 体外抑菌活性的影响Table 7 Effect of UV irradiation time on in vitro antibacterial activity of Apiospora malaysiana
2.2.4 pH 对Apiospora malaysiana体外抑菌活性的影响 不同pH 对Apiospora malaysiana体外抑菌活性的影响见表8。当pH 较低,为2、4 时,Apiospora malaysiana粗提物对金黄色葡萄球菌的抑菌活性较对照组略有降低(P<0.05),但整体来说抑菌活性仍保持在对照组的92%以上。但当pH 逐渐升高至6、8、10 时,Apiospora malaysiana对金黄色葡萄球菌的抑菌活性消失。上述结果表明Apiospora malaysiana粗提物对外界pH 的变化较敏感,pH 的升高或降低对其抑菌活性均有影响,但酸性环境影响较小,当外界pH 高于粗提物本底pH 时,其体外抑菌活性消失。原因可能是地衣内生真菌发酵液粗提物的抑菌活性物质如酚酸及缩酚酸类物质偏酸性,由于其苯环被多个酚羟基取代,导致结构不稳定,加之酚羟基呈酸性,容易与碱性物质发生反应导致内生真菌抑菌活性物质失活[36-37],因此在后续的试验及生产中应格外注意抗菌物质的酸碱特性与其活性的密切关系。

表8 pH 对Apiospora malaysiana 体外抑菌活性的影响Table 8 Effect of pH on in vitro antibacterial activity of Apiospora malaysiana
3 结论
本研究结果显示,常见的3 种细菌抑制方法没有差异,说明Apiospora malaysiana发酵液粗提物的扩散速度和范围与其接触培养基的面积、接触培养基的高度均无关,而常见的3 种真菌抑制方法存在统计学差异,表明Apiospora malaysiana中存在的主要抑菌物质多溶于有机溶剂,且在提取浓缩后形成了较强的抑菌效果,试验样品的抑菌活性与浓度呈正相关,且其效果的评判具有较高的阈值,上述抑菌方法筛选结果表明平板打孔法和菌丝生长速率法分别是最合适的两种抑菌方法。Apiospora malaysiana发酵液粗提物有广谱的抑菌效果,对革兰氏阳性菌、致病真菌都有较强的抑菌活性。以敏感性最强的金黄色葡萄球菌为指示菌,研究Apiospora malaysiana发酵液粗提物体外抑菌稳定性,保存时间、热处理及紫外照射时间对其体外抑菌活性无影响(P>0.05),当pH 调整至2、4 时,其抑菌活性较本底pH(5.5)略有降低,当pH 调整至高于其本底pH 时(pH6、8、10),其体外抑菌活性消失(P<0.05),表明在Apiospora malaysiana开发利用过程中,较长时间的低温(4 ℃)保存、常见的热处理不会对其抑菌活性造成影响,也能满足较长时间(75 min)的紫外光灭菌处理条件,也有较好的pH 稳定性,但酸碱处理中pH 应不超过其发酵液粗提物本底pH。以上结果表明雪地茶内生长真菌Apiospora malaysiana可用于天然抗菌先导化合物以及食品保鲜剂的开发,但限于目前对雪地茶内生真菌生物活性物质分离纯化鉴定的相关研究尚处于起步阶段,该部分可参考的内容较少,因此雪地茶内生真菌的分离鉴定、生物活性研究等基础工作需持续进行。

