食管鳞癌患者IMRT后发生食管瘘危险因素分析
刘怡 邰国梅 俞岑明 倪峰

[摘 要] 目的:分析食管鳞癌患者调强适形放疗(intensity modulated radiotherapy,IMRT)治疗后发生食管瘘的相关危险因素。方法:回顾性分析接受IMRT治疗的102例食管鳞癌患者临床资料,采用χ2检验和多因素Logistic回归模型分析影响食管瘘发生的危险因素。结果:102例食管鳞癌患者放疗后有16例(15.69%)发生食管瘘。单因素分析显示,T4期、溃疡型肿瘤、治疗前食管龛影、肿瘤靶区(GTV)最大横径>2.45 cm、GTV体积>50 cm3、二次放疗、体质量指数<20 kg/m2与放疗后食管瘘发生有关(P<0.05)。多因素分析显示,治疗前食管龛影、GTV最大横径>2.45 cm、二次放疗为放疗后食管瘘发生的独立危险因素(P<0.05)。结论:治疗前食管造影有龛影、GTV最大横径>2.45 cm、二次放疗是食管鳞癌患者IMRT后食管瘘发生的高危因素,对这类患者应高度重视,及时采取应对措施,降低食管瘘的发生率。
[关键词] 食管鳞癌;食管瘘;调强适形放疗;危险因素
[中图分类号] R735.1 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.04.014
食管癌病理类型以鳞癌为主,放疗是不可手术局部晚期食管鳞癌的主要治疗手段之一,调强适形放疗(intensity modulated radiotherapy,IMRT)能提高局部控制率,降低正常组织损伤,改善肿瘤预后[1]。但有研究指出,IMRT治疗不可手术局部晚期食管癌发生食管瘘的风险达到13%左右[2]。食管瘘是放疗很严重的并发症,容易继发感染、出血,预后很差,死亡率很高。本研究回顾性收集2020年1月—2021年12月在我院行IMRT治疗的食管鳞癌患者102例临床资料,对发生食管瘘的相关危险因素进行分析。
1 资料与方法
1.1 一般资料 行IMRT治疗的食管鳞癌患者102例,其中男性69例,女性33例,中位年龄71岁;上段食管癌28例,中段食管癌53例,下段食管癌21例;溃疡型39例,非溃疡型63例;共有16例(15.69%)IMRT后发生食管瘘,其中5例发生在放疗期间,11例发生在放疗后,放疗开始至发生食管瘘的中位时间为4.2个月。16例食管瘘中9例(56.25%)为食管纵隔瘘,7例(43.75%)为食管气管瘘。食管瘘患者中12例(75.00%)接受鼻饲胃肠营养管治疗,4例(25.00%)行胃造瘘治疗,同时辅以静脉营养及抗炎治疗。食管瘘患者中位总生存期(overall survival,OS)为3个月。随访截止时间为2022年12月31日。纳入标准:(1)经胃镜病理明确为食管鳞癌;(2)接受IMRT治疗并完成療程,联合或不联合化疗;(3)KPS评分大于60分;(4)签署知情同意书;(5)有完整的随访资料。排除标准:(1)放疗前已发生食管瘘;(2)已有远处转移;(3)有第二原发肿瘤病史者。本研究经医院伦理审查委员会批准。
1.2 治疗方法
1.2.1 IMRT:患者取仰卧位,热塑体膜固定。行颈胸上腹部CT扫描,层厚5 mm,采集图像数据,定位图像传输至治疗计划系统。放疗医生勾画靶区,原发肿瘤靶区(GTVnx):食管病灶;累淋巴结靶区(GTVnd):纵膈转移淋巴结;临床靶区(CTV):食管病灶上外放3 cm、下外放4 cm、前后左右不外放,纵膈转移淋巴结不外放;计划靶区(PTV):在CTV基础上前后、左右、上下外放1.5 cm。采用6MV-X射线,IMRI放疗技术,单次剂量1.8~2.0 GY/F,5F/W,30~33F,PTV处方剂量:54~66 GY。危及器官剂量限制:双肺V20<28%、V30<20%,心脏V30<40%、V40<30%,脊髓最大剂量<45 GY。
1.2.2 化疗:采用替吉奥联合铂类或紫杉醇联合铂类的双药化疗方案,21~28天为1个周期,放疗期间患者一般接受2个周期同步化疗。
1.3 食管瘘诊断标准 (1)患者饮水或进食后出现剧烈呛咳,胸骨后或背后明显疼痛,或伴有发热。(2)血常规白细胞计数、中性粒细胞百分比增高,C反应蛋白增高,也可见白蛋白、前白蛋白水平偏低。(3)上消化道碘油造影示瘘管形成,造影剂漏出,进入气管、纵膈、主动脉。(4)胸腹部CT显示食管内充气,伴相邻的纵隔或胸膜腔有积气积液影[3]。
1.4 统计学处理 应用SPSS 23.0统计学软件对数据进行分析处理。计数资料以频数和率表示,组间比较采用χ2检验;采用多因素logistic回归分析影响食管鳞癌患者IMRT后发生食管瘘的危险因素。P<0.05为差异有统计学意义。
2 结 果
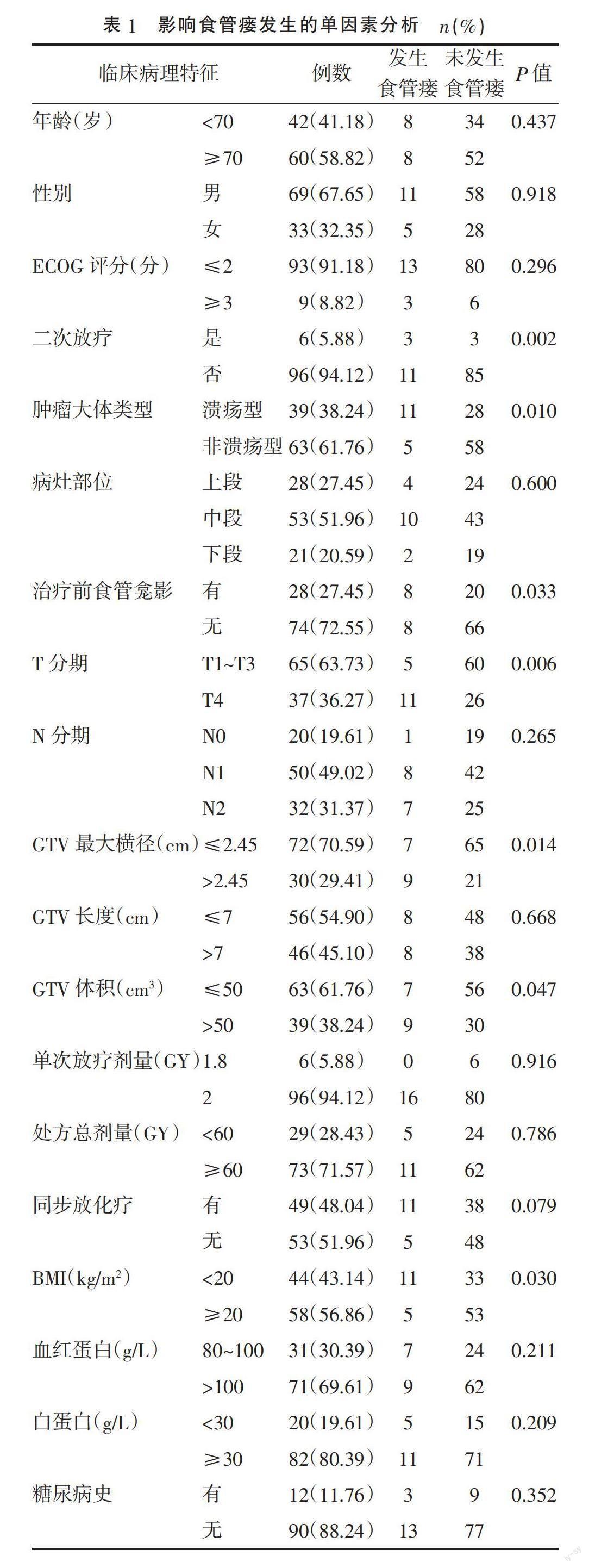
2.1 食管鳞癌患者IMRT后发生食管瘘的单因素分析 单因素分析显示,T4期、溃疡型肿瘤、治疗前食管龛影、GTV最大横径>2.45 cm、GTV体积>50 cm3、二次放疗、体质量指数(body mass index,BMI)<20 kg/m2与放疗后食管瘘发生有关(P<0.05),而年龄、性别、ECOG评分、病灶部位、N分期、GTV长度、单次放疗剂量、处方总剂量、是否同步放化疗、血红蛋白水平、白蛋白水平、糖尿病史与食管瘘的发生无关(P>0.05)。见表1。
2.2 食管鳞癌患者IMRT后发生食管瘘的多因素分析 对单因素分析中有统计学意义的7个因素纳入多因素Logistic回归分析,结果显示治疗前食管造影有龛影(OR:0.215,95%CI:0.051~0.912,P=0.037)、GTV最大横径>2.45 cm(OR:0.222,95%CI:0.050~0.984,P=0.048)、二次放疗(OR:0.042,95%CI:0.002~0.862,P=0.040)是影响食管瘘发生的独立危险因素。见表2。
3 讨 论
食管鳞癌行IMRT后发生食管瘘患者,如疗效评定为部分缓解(PR)或稳定(SD)可排除肿瘤进展所致。其发生食管瘘的原因主要为肿瘤对放疗较敏感、退缩速度较快;放疗容易使局部组织纤维化,受照部位血供变差,炎性细胞大量渗出,导致正常组织修复速度变慢,当肿瘤退缩速度与正常组织修复速度失衡时易发生食管瘘[4]。与三维适形放疗(3-dimensional conformal radiation therapy,3DCRT)相比,IMRT治疗能提高食管鳞癌的局部控制率,降低正常组织副反应,但食管瘘仍不可避免。接受首程放疗的食管癌患者发生食管瘘的概率为10.4%~13.9%[5-6]。本研究中患者放疗引起食管瘘的发生率为15.69%,略高于相关研究。单因素分析显示,T4期、溃疡型肿瘤、治疗前食管龛影、GTV最大横径>2.45 cm、GTV体积>50 cm3、二次放疗、BMI<20 kg/m2是影响食管瘘发生的危险因素。多因素logistic回归分析显示,治疗前食管龛影、GTV最大横径>2.45 cm、二次放疗是影响食管瘘发生的独立危险因素。
T4期表明食管肿瘤外侵明显,已侵犯气管、支气管、纵膈及主动脉等周围器官。T4期食管癌患者放化疗后食管瘘发生率为14.7%~29%[7-8]。PAO等[9]发现T4期食管癌患者发生食管瘘的风险较高,是食管瘘发生的独立危险因素。本研究显示T4期与食管癌放疗后发生食管瘘相关,但不是独立危险因素。
溃疡型食管癌底部深入肌层,容易穿孔[10]。SHI等[11]发现溃疡型肿瘤为食管癌患者发生食管瘘的独立危险因素。本研究纳入39例溃疡型患者,11例(28.2%)发生食管瘘,单因素分析显示溃疡型食管癌与放疗导致的食管瘘发生相关,但不是独立危险因素。
本研究结果显示,放疗前食管已有龛影是食管瘘发生的独立危险因素,与陈晨等[12]研究结果一致。对这类患者放疗期间应加强抗感染和营养支持,每周复查食管造影,动态观察并及时处理,以降低食管瘘的发生。
有研究表明,浸润较深、体积偏大的肿瘤,虽有代偿性新生血管生长,但结构紊乱,影响氧气交换,造成缺氧[13-14]。缺氧使得肿瘤生物学行为发生改变,糖酵解增强,更具有侵袭性。GTV最大横径越大,意味肿瘤浸润程度越深,缺氧和组织坏死越严重,食管瘘发生概率越大。路娜等[15]研究发现,GTV最大橫径与食管瘘的发生相关。王大权等[16]研究认为GTV最大横径>2.45 cm是影响食管瘘及出血发生率的危险因素。本研究结果显示,GTV体积>50 cm3与食管瘘的发生相关,GTV最大横径>2.45 cm是放疗引起食管瘘的独立危险因素。
食管癌放疗后局部可产生晚期放射性损伤,部分发生纤维化,当肿瘤复发需要二次放疗时,很可能因为既往的放疗损伤而发生穿孔。KIM等[17]分析17例行二次放疗的食管癌复发患者,其中3例(17.6%)出现食管瘘。XU等[18]研究表明二次放疗是食管瘘发生的高危因素,相较于首程放疗,二次放疗发生食管瘘的几率有所升高。本研究亦发现二次放疗是发生食管瘘的独立危险因素,与相关研究一致。对于食管癌复发二次放疗症状缓解较快的患者,尤其要密切关注是否会有食管瘘的发生。
低BMI与机体营养不良和免疫状态差相关,可能影响正常组织修复能力。本研究发现BMI<20 kg/m2与食管瘘的发生相关,但不是独立危险因素。XU等[18]也发现食管癌患者低BMI是食管瘘发生的高危因素。因此,放疗期间给予积极的营养支持,可能有助于减少食管瘘的发生。
本研究结果显示,年龄、性别、ECOG评分、病灶部位、N分期、GTV长度、单次放疗剂量、处方总剂量、是否行同步放化疗、血红蛋白水平、白蛋白水平、糖尿病史与食管鳞癌患者IMRT后食管瘘的发生无关,与目前一些研究结果有差异,考虑可能与本研究样本量较小、存在偏倚有关。
综上所述,食管瘘是食管癌严重的并发症,预后极差,目前各种治疗效果均不理想。本研究显示治疗前食管造影有龛影、GTV最大横径>2.45 cm、二次放疗是食管鳞癌患者IMRT后发生食管瘘的高危因素,应高度重视这类患者,及时采取应对措施,降低食管瘘的发生率。
[参考文献]
[1] LIN S H,WANG L,MYLES B,et al. Propensity score-based comparison of long-term outcomes with 3-dimensional conformal radiotherapy vs intensity-modulated radiotherapy for esophageal cancer[J]. Int J Radiat Oncol Biol Phys,2012,84(5):1078-1085.
[2] LIN S H,HOBBS B P,VERMA V,et al. Randomized phase IIB trial of proton beam therapy versus intensity-modulated radiation therapy for locally advanced esophageal cancer[J]. J Clin Oncol,2020,38(14):1569-1579.
[3] BACKER CARL L,JOSEPH L,HARTZ RENEE S,et al. Computed tomography in patients with esophageal perforation[J]. Chest,1990,98(5):1078-1080.
[4] HAN X,ZHAO Y S,FANG Y,et al. Placement of transnasal drainage catheter and covered esophageal stent for the treatment of perforated esophageal carcinoma with mediastinal abscess[J]. J Surg Oncol,2016,114(6):725-730.
[5] SUGAHARA S,OHARA K,OKUMURA T,et al. Patterns of initial treatment failure of esophageal cancer following radiotherapy[J]. Nihon Igaku Hoshasen Gakkai Zasshi,1999,59(13):754-759.
[6] BIANCARI F,D′ANDREA V,PAONE R,et al. Current treatment and outcome of esophageal perforations in adults:systematic review and meta-analysis of 75 studies[J]. World J Surg,2013,37(5):1051-1059.
[7] TANIGUCHI H,YAMAZAKI K,BOKU N,et al. Risk factors and clinical courses of chemoradiation-related arterio-esophageal fistula in esophageal cancer patients with clinical invasion of the aorta[J]. Int J Clin Oncol,2011,16(4):359-365.
[8] NISHIMURA Y,SUZUKI M,NAKAMATSU K,et al. Prospective trial of concurrent chemoradiotherapy with protracted infusion of 5-fluorouracil and cisplatin for T4 esophageal cancer with or without fistula[J]. Int J Radiat Oncol Biol Phys,2002,53(1):134-139.
[9] PAO T H,CHEN Y Y,CHANG W L,et al. Esophageal fistula after definitive concurrent chemotherapy and intensity modulated radiotherapy for esophageal squamous cell carcinoma[J]. PLoS One,2021,16(5):e0251811.
[10] 殷蔚伯,余子豪,徐國镇,等. 肿瘤放射治疗学[M]. 4版. 北京:中国协和医科大学出版社,2008:551.
[11] SHI Y J,LIU C,WEI Y Y,et al. Quantitative CT analysis to predict esophageal fistula in patients with advanced esophageal cancer treated by chemotherapy or chemoradiotherapy[J]. Cancer Imaging,2022,22(1):62.
[12] 陈晨. 食管癌放疗后食管穿孔的预测模型构建及验证[D]. 福州:福建医科大学,2020.
[13] GACCHE R N,ASSARAF Y G. Redundant angiogenic signaling and tumor drug resistance[J]. Drug Resist Updat,2018,36:47-76.
[14] HUIJBERS E J M,VAN BEIJNUM J R,THIJSSEN V L,et al. Role of the tumor stroma in resistance to anti-angiogenic therapy[J]. Drug Resist Updat,2016,25:26-37.
[15] 路娜,王鑫,李晨,等. T1~2N0M0期食管癌根治性放疗的预后分析:泛京津冀食管肿瘤多中心协作组多中心回顾性研究(3JECROG R-01H)[J]. 中华肿瘤杂志,2020,42(2):139-144.
[16] 王大权,庞青松,章文成,等. 食管癌IMRT食管瘘及出血危险因素分析[J]. 中华放射肿瘤学杂志,2016,25(11):1182-1186.
[17] KIM Y S,LEE C G,KIM K H,et al. Re-irradiation of recurrent esophageal cancer after primary definitive radiotherapy[J]. Radiat Oncol J,2012,30(4):182-188.
[18] XU Y,HE B,LI W,et al. Nomogram for individual prediction of radiotherapy-related esophageal fistula in esophageal cancer[J]. Int J Radiat Oncol,2019,105(1S):E204.
[收稿日期] 2023-03-11
(本文编辑 赵喜)

