腹主动脉瘤发病机制的单细胞转录组生物信息学研究△
王玉涛,赵 莉
1 济南市中医医院周围血管病科,山东 济南 250012
2 山东第一医科大学第一附属医院检验科,山东 济南 250014
腹主动脉瘤(abdominal aortic aneurysm,AAA)是血管外科重症之一,具有病程长、起病隐匿等特点,漏诊率高。大多数AAA 患者为查体时偶然发现,部分患者于出现腰腹疼痛症状后确诊。AAA 破裂的首发症状多为腰腹疼痛,预后极差,病死率为60%~90%[1-2]。动脉粥样硬化、炎性反应、遗传因素是近年来关于AAA 形成的主要学说[3]。随着转录组测序技术的发展,通过分析AAA 样本的差异性表达基因,提高了对其发病机制的认识[4],但AAA 相关的细胞亚群及相关基因表达变化仍未明确。随着单细胞组学技术的快速发展,高分辨率的组学信息能够更为精确地挖掘疾病的潜在机制,基于单细胞转录组数据的AAA 发病机制探索结果更为可信[5]。本研究拟通过单细胞转录组生物信息挖掘思路,探索AAA 发生的潜在机制,为其基础研究提供依据,现报道如下。
1 资料与方法
1.1 数据来源与质控
以“abdominal aortic aneurysm”为关键词,从高通量基因表达数据库中检索AAA 样本的单细胞测序数据集,选取单细胞转录组数据集基因表达序列(gene expression series,GSE)166676为研究对象。选取单细胞数据集中4例AAA 患者(AAA 组)和2例健康者(nonAAA 组)的腹主动脉样本单细胞测序数据,使用R语言的Seurat数据包的“Normalizedata”和“LogNormalize”函数对数据进行标准化处理。使用Seurat数据包的“ScaleData”函数过滤计数﹥5000或﹤200的细胞,从而过滤线粒体基因比例高于15%的细胞。
1.2 细胞聚类
使用Seurat 数据包的“ScaleData”函数过滤具有特殊分子标识的细胞,使用“RunPCA”函数进行降维分析,筛选特征基因并将单细胞聚类。使用t-分布邻域嵌入算法(t-distributed stochastic neighbor embedding,tSNE)对各细胞亚群数据进行降维整合处理,并将转录组信息降维投影到二维,直观地观察细胞簇的转录多样性,将类似基因表达模式的细胞分群。
1.3 细胞注释
使用Seurat数据包的“FindAllMarkers”函数寻找每个细胞亚群的特异性基因,利用R语言SingleR数据包的“HumanPrimaryCellAtlasData()函数”对不同的细胞亚群进行注释。
1.4 细胞提取和差异基因
根据tSNE聚类和细胞注释结果,利用Seurat数据包筛选出两组单细胞转录组数据中差异显著的细胞亚群,同时借助FindMarkers函数筛选差异显著细胞亚群中两组单细胞转录组数据的差异表达基因。
1.5 蛋白-蛋白相互作用分析
将筛选获得的差异表达基因导入STRING 数据库(https://cn.string-db.org/),挖掘差异表达基因的蛋白-蛋白相互作用(protein-protein interaction,PPI)网络,导入Cytoscape 3.9.1软件,绘制PPI网络,利用Cytoscape软件中的cytoHubba功能筛选PPI网络中的核心基因,提取核心靶点的表达量并进行可视化。
1.6 功能富集分析
登陆欧易生信分析平台(https://cloud.oebiotech.cn/task/),将筛选出的差异基因进行基因本体功能注释(gene ontology,GO)富集和京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)富集分析通路分析,并对结果进行可视化。
2 结果
2.1 数据质控
本研究分析了GSE166676数据集的单细胞测序数据,其中,基因表达矩阵(gene expression series matrix,GSM)5077727、GSM5077728、GSM5077729、GSM5077730为AAA组测序数据,GSM5077731、GSM5077732为正常腹主动脉样本(nonAAA组)测序数据。根据线粒体基因过滤低质量数据,经主成分分析(principle component analysis,PCA)去批次处理,质控并过滤后得到12 307个细胞测序数据,其中AAA组细胞7432个,nonAAA组细胞4875个。(图1)
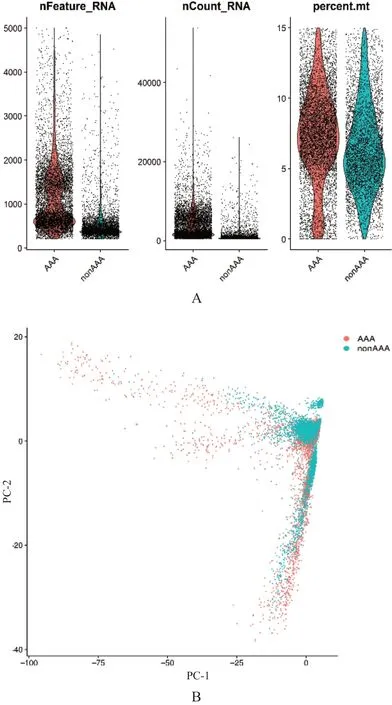
图1 单细胞测序数据清洗与质量控制
2.2 细胞聚类
筛选具有特殊分子标识符的细胞,利用“RunPCA”函数进行降维分析,筛选各基因群的特征基因绘制小提琴图,筛选各基因群前3位标志性基因表达量绘制热图。12 307个细胞聚类成18个亚群,使用tSNE法对细胞亚群进行降维整合处理,并将转录组信息降维投影到二维,直观地观察到细胞簇的转录多样性,将类似基因表达模式的细胞分群。(图2)
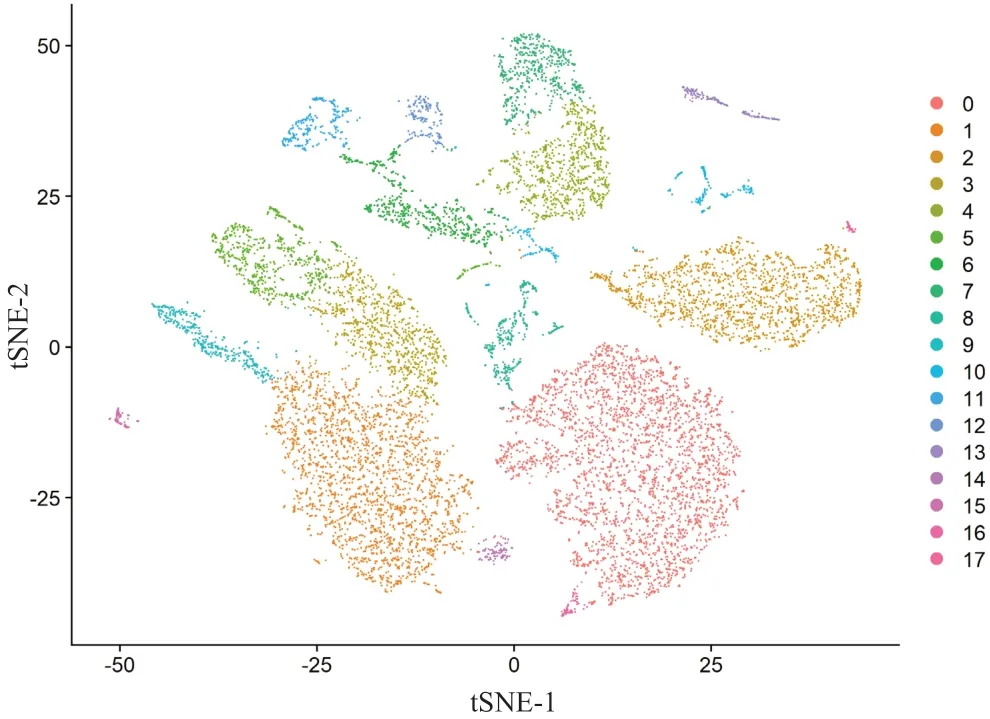
图2 各细胞亚群单细胞簇分布
2.3 细胞注释
利用Seurat数据包的“FindAllMarkers”函数和SingleR数据包的“HumanPrimaryCellAtlasData()函数”对细胞亚群进行注释并绘制比例柱状图,结果显示,两组样本细胞类别存在显著差异,AAA 组样本细胞类别包括T细胞、B细胞、巨噬细胞、单核细胞、内皮细胞、自然杀伤细胞等;nonAAA 组样本类别包括上皮细胞、巨噬细胞、单核细胞等。T细胞、B细胞在AAA 组样本中占比较高,可能在AAA 发病中发挥重要调节作用。(图3)
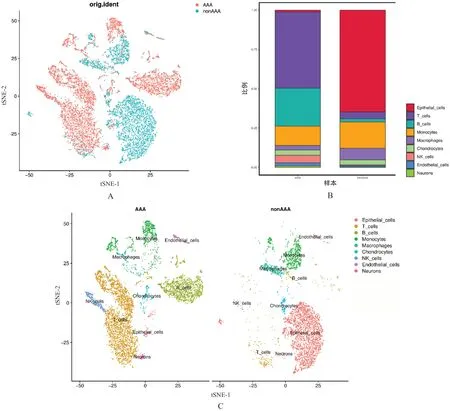
图3 两组样本细胞亚群相关情况
2.4 PPI 网络绘制和潜在核心基因筛选
根据tSNE聚类和细胞注释结果,利用Seurat数据包FindMarkers函数筛选两组单细胞转录组数据中T细胞、B细胞相关的差异表达基因,其中差异表达上调基因120个,差异表达下调基因200个。利用STRING数据库和Cytoscape 3.9.1软件绘制差异表达基因PPI网络,筛选潜在核心基因,结果显示,C 型蛋白酪氨酸磷酸酶受体(protein tyrosine phosphatase receptor type C,PTPRC)、T细胞受体复合物CD3δ 亚基(CD3 delta subunit of T-cell receptor complex,CD3D)、B细胞抗原受体复合物相关蛋白β链(B-cell antigen receptor complex-associated protein beta chain,CD79B)、T细胞受体复合物的CD3 ε亚基(CD3 epsilon subunit of T-cells receptor complex gene,CD3E)、T细胞表面糖蛋白CD3 ζ 链(T-cell surface glycoprotein CD3 zeta chain,CD247)是差异表达上调基因的潜在核心基因;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、纤维连接蛋白1(fibronectin 1,FN1)、组织蛋白酶D(cathepsin D,CTSD)、膜连蛋白A5(annexin A5,ANXA5)、半胱蛋白酶B(cathepsin B,CTSB)是差异表达下调基因的潜在核心基因,提取潜在核心基因的表达量进行可视化。(图4)
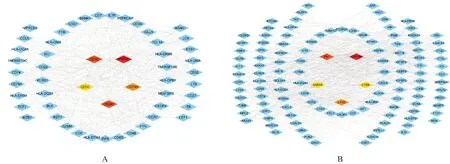
图4 差异表达基因PPI网络及核心基因
2.5 差异基因功能富集分析
登陆欧易生信分析平台(https://cloud.oebiotech.cn/task/),将筛选出的差异基因进行GO 功能富集和KEGG信号通路分析,结果表明,差异表达上调基因共富集得到106条信号通路,以P﹤0.05为条件,筛选获得39条信号通路;差异表达下调基因共富集得到217条信号通路,以P﹤0.05为条件,筛选获得37条信号通路。根据富集强度,取排名前10位的信号通路进行可视化,结果表明,AAA 形式可能与辅助性T 细胞(helper T cell,Th)1细胞分化、Th2细胞分化、Th17细胞分化、细胞黏附分子、细胞凋亡、流体剪切应力和动脉粥样硬化、白细胞介素(interleukin,IL)-17信号通路、雌激素信号通路等途径相关。(图5)

图5 T细胞和B细胞相关差异表达基因GO和KEGG信号通路富集分析
3 讨论
3.1 T 细胞在AAA 形成中的作用
研究显示,随着AAA病程进展,淋巴细胞、巨噬细胞、中性粒细胞逐渐向腹主动脉外膜浸润,其中淋巴细胞占比较高,且超过50%的淋巴细胞为CD4+和CD8+T细胞[6]。T细胞对AAA的调节作用依赖于Th1细胞因子(如干扰素-γ、IL-2和肿瘤坏死因子β)以及Th2细胞因子(如IL-4、IL-5、IL-6和IL-10)[7],上述细胞因子均与巨噬细胞激活、血管平滑肌细胞凋亡和腹主动脉管壁破坏有关[8]。血管平滑肌细胞是主动脉壁的主要细胞成分,Th可通过自身免疫途径参与血管平滑肌细胞的凋亡。Th1释放的肿瘤坏死因子和干扰素-γ可抑制胶原蛋白的合成,Th2表达的Fas配体可加速血管平滑肌细胞凋亡[9],调节性T细胞功能受损可能会促进AAA 的发展[10]。Zhou 等[11]研究发现,调节性T 细胞可以释放IL-10,抑制炎症细胞的趋化作用,参与动脉壁重塑和血管生成。另有研究表明,AAA 患者外周血单个核细胞中调节性T 细胞的比例明显低于对照组[12]。本研究发现,T 细胞在AAA 组样本中占比较高,可能是治疗AAA 的潜在靶细胞。
3.2 B 细胞在AAA 形成中的作用
B 细胞通过分泌抗体在体液免疫中发挥重要作用,B细胞可分为3个亚群,包括B-1、B-2和调节性B细胞[13]。Schaheen等[14]研究发现,使用CD20抗体耗尽B1和B2细胞可显著限制AAA 模型小鼠瘤体的生长。B细胞还可以分泌免疫球蛋白,免疫球蛋白广泛沉积在小鼠AAA 组织中,这些自身抗体不仅能诱导T 细胞和巨噬细胞分泌白细胞介素6和基质金属蛋白酶-9,导致主动脉壁破坏[15],还可以与其他免疫细胞相互作用,如免疫球蛋白(immunoglobulin,Ig)E可以影响巨噬细胞的极化,并诱导被激活的肥大细胞合成各种弹性蛋白酶[16]。B 细胞还可直接诱导基质金属蛋白酶产生,与T细胞相互作用,参与AAA 形成。B细胞可通过表达基质金属蛋白酶直接促成血管壁基质层的蛋白水解[17]。Meher等[18]研究证实B-2细胞可通过上调调节性T细胞和减少单核细胞的数量来抑制B细胞缺陷模型小鼠AAA 形成。本研究发现,B细胞在AAA 组样本中占比高,可能在AAA 形成中发挥重要调节作用。目前,B细胞在AAA 中作用的相关研究较少,B细胞、免疫球蛋白的调节与AAA 的相关性可能是新的研究热点。
3.3 AAA 形成的潜在信号通路
本研究信号通路富集结果表明,AAA 形成可能与Th1和Th2分化、Th17细胞分化、细胞黏附分子、细胞凋亡、流体剪切应力和动脉粥样硬化、IL-17信号通路、雌激素信号通路等途径相关。研究发现,在人AAA 样本和AAA 模型动物样本中,Th1、Th17的数量增多,Th2、调节性T细胞的数量下降,提示Th1/Th2、Th17/调节性T细胞的失衡与AAA 的形成和发展有关;IL-17主要来源于Th17细胞,参与中性粒细胞募集等免疫过程,调节氧化应激反应[19]。氧化应激是AAA 的主要致病因素之一,提示通过控制IL-17的合成和Th17细胞的活性来抑制氧化应激可能是AAA的潜在治疗靶点[20]。胡杰等[21]研究证实,黏附相关基因FKKMT2、ROCK1和LAMA5可能通过介导血管平滑肌细胞与细胞外基质间黏附作用参与AAA 形成。剪切应力参与动脉粥样硬化和血栓形成病理过程,当动脉管腔狭窄时,内皮细胞感知到血流对管壁作用力的改变,可调节血管平滑肌细胞表型,促进基质金属蛋白酶释放,使动脉管壁重塑、变薄,导致AAA 形成[22]。雌激素水平是心血管疾病的保护因素,与AAA 形成存在关联,研究证实,女性AAA发生率低,且病情进展缓慢[23]。另有研究证实,吸烟女性AAA 发生风险高于吸烟男性,可能与吸烟损伤了雌激素的保护作用有关[24]。
综上所述,T细胞、B细胞在AAA样本中占比较大,与AAA形成关系密切,Th1、Th2、Th17细胞分化、细胞黏附分子、细胞凋亡、流体剪切应力和动脉粥样硬化、IL-17信号通路、雌激素信号通路等是AAA潜在的干预通路,但由于此类研究方法尚未在AAA机制探索中大范围应用,且样本量较小,本研究挖掘得到的AAA潜在核心靶点PTPRC、CD3D、CD79B、CD3E、CD247、GAPDH、FN1、CTSD、ANXA5、CTSB与AAA的相关性有待进一步明确。

