m6A 甲基化修饰在骨质疏松症中的研究进展
谢景春 李洪亮 金奇 袁贤赟 谢保平
骨质疏松症 (osteoporosis,OP) 是一种全身性骨代谢负性失衡疾病,其特征是骨量减少和骨组织微结构破坏,临床表现为骨骼疼痛和骨折[1]。骨量的动态平衡主要是由破骨细胞 (osteoclast,OC)、成骨细胞 (osteoblast,OB)、骨细胞和骨髓间充质干细胞 (BMSCs) 调控[2]。其中 OC 是机体内惟一具有骨吸收功能的多核巨细胞,OB 和 OC 则在骨重建中扮演了重要的角色[3]。因此,OP 的发病机理主要由骨组织内的 OC 和 OB 的功能活动失衡所致[4]。OP是一致退行性疾病,随着年龄的增加和人口老龄化问题的加剧,OP 患病率呈现上升的趋势,已成为危害居民公共卫生安全的关键问题。
RNA 甲基化修饰广泛存在于脊椎动物、植物、酵母菌、细菌、古细菌和病毒中,主要包括 m6A (N6-methyladenosine) 甲基化、5 甲基胞嘧啶甲基化 (m5C)、N1-甲基腺嘌呤甲基化 (m1A) 等[5]。其中 m6A 甲基化是真核生物中最普遍且最丰富的 RNA 修饰,大约占到了 RNA 甲基化修饰的 80% 左右,目前,m5C 和 m1A 的研究还处于起步阶段,其修饰酶、动态调控和生物学功能需要进一步研究[6-7]。m6A 甲基化修饰是发生在腺嘌呤第 6 位 N 原子上的甲基化修饰,并在 m6A 甲基转移酶 (Writers)、m6A 去甲基化酶 (Erasers) 和甲基化识别蛋白 (Readers) 共同调节 (图1) 下影响着 mRNA 的剪接、转录、翻译和降解,进而影响基因的表达,并参与调节细胞分化、胚胎发育和疾病发生的细胞生物学功能[8-9]。同时除 mRNA 外,m6A 修饰还对 miRNA、LncRNA,rRNA、tRNA、snRNA等具有重要的调节功能[10]。近年来,越来越多的研究表明 m6A 甲基化修饰在 OP 的调控中扮演了重要的角色,特别是在调控骨稳态和骨量方面[11-12]。有学者发现条件敲除骨髓间充质干细胞 (MSCs) 中的 m6A 甲基转移酶样 3(methyltransferase-like 3,METTL3) 可诱导小鼠 OP 的发生,METTL3 功能丧失导致骨形成受损、成骨分化潜能降低,且 MSCs 中 METTL3 过表达可以抑制小鼠雌激素缺乏诱导的 OP[10]。Zhang 等[12]研究发现 RNA 去甲基化酶脂肪与肥胖相关蛋白 (fat mass and obesity-associated protein,FTO) 是维持骨量和降低 OB DNA 损伤和凋亡率所必需的基因。因此,笔者综述了 m6A 甲基化修饰调节酶和识别蛋白,以及 m6A 甲基化修饰调控 OC 和 OB 分化的机制,特别是 m6A 对 BMSCs 向 OB 和脂肪细胞分化的机制,以期为 OP 的诊断和治疗寻找新的分子标志物。
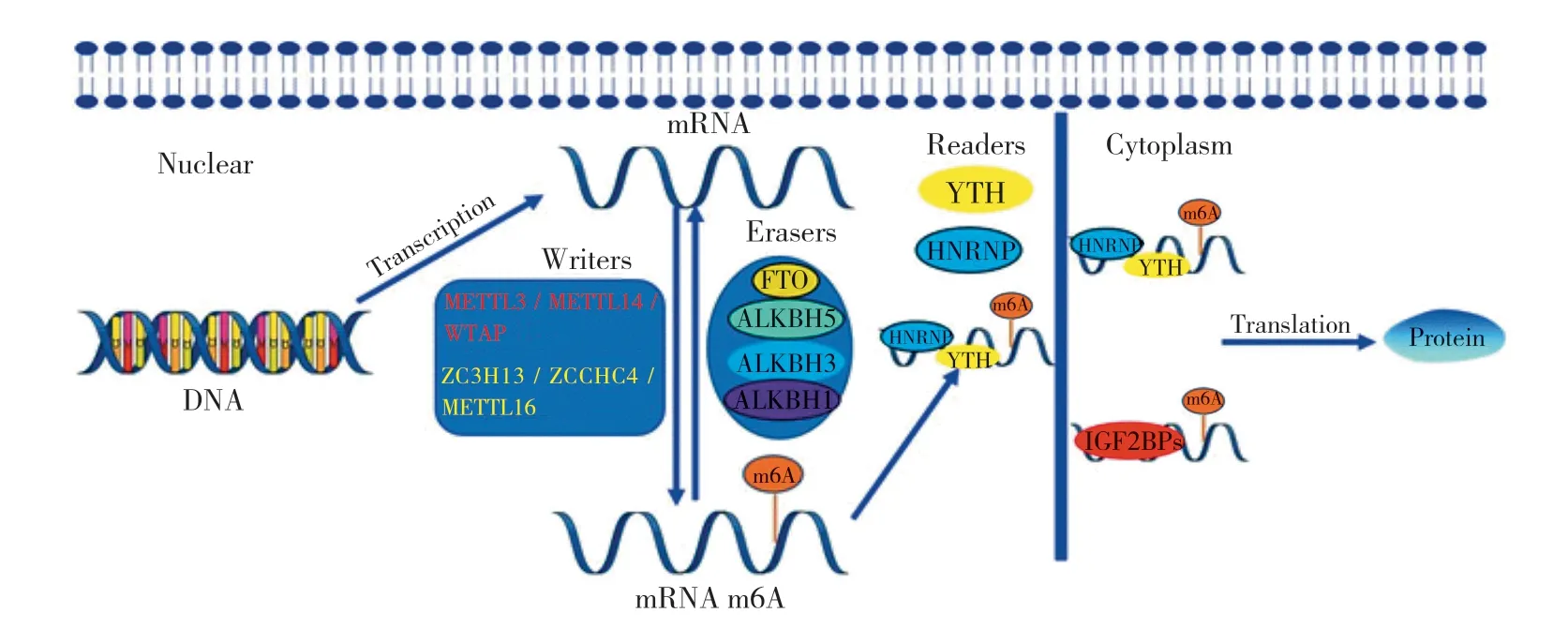
图1 m6A 甲基化修饰的生物学调节过程Fig.1 Regulatory process of m6A methylation modification
一、调节 m6A 甲基化修饰的酶和蛋白
1.m6A 甲基转移酶:m6A 修饰由甲基化转移酶复合物催化,主要包括 METTL3、METTL14 以及 Wilms 肿瘤 1 结合蛋白 (Wilms tumor 1 associated protein,WTAP)(表1)[13]。其中 METTL3 是第一个被鉴定的 m6A 甲基转移酶,METTL3 N 端包含两个 Cys-Cys-Cys-His (CCCH)型锌指结构域和一个催化结构域,它在 RNA 生命周期的所有阶段都发挥作用,包括前 mRNA 剪接、核输出、翻译、衰变等[14]。METTL14 具有和 METTL3 几乎相同的拓扑结构,但 METTL14 不具备催化功能,通常 METTL3与 METTL14 相互作用形成催化复合物,催化甲基从 S-腺苷甲硫氨酸转移到特定的 RNA 腺嘌呤上[15-16]。WTAP 是m6A 甲基转移酶复合物的关键成份,由于其缺乏催化结构域,WTAP 本身不具有甲基化修饰的活性,但在 WTAP 敲低的细胞系中的整体 m6A 水平显著降低,提示 WTAP 在mRNA 甲基化中具有重要意义[17]。
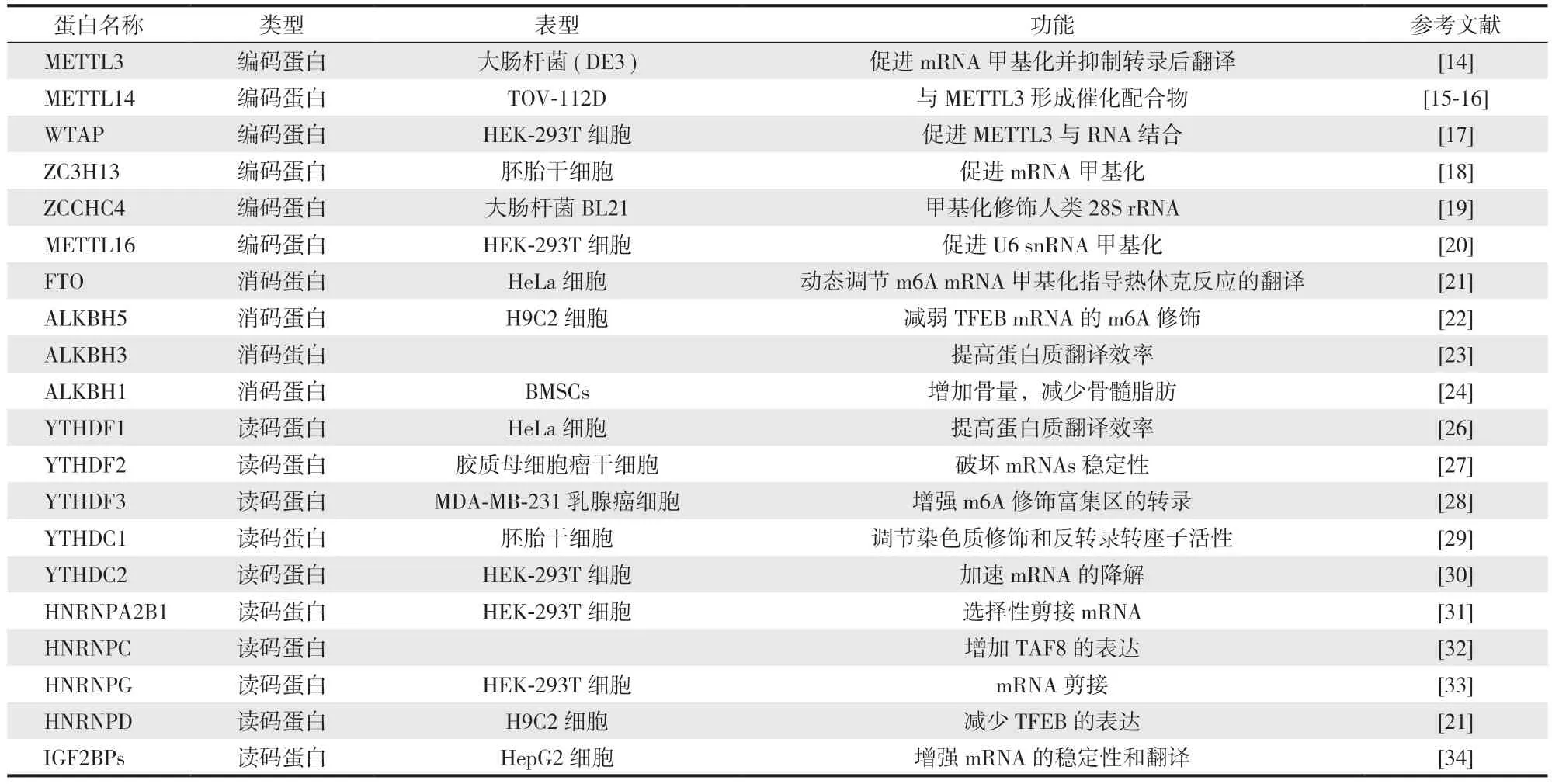
表1 m6A 修饰调节蛋白Tab.1 Enzymes and proteins in m6A modification
此外,除了 METTL3、METTL14 和 WTAP 的核心复合物外,其它几种蛋白质也参与甲基转移酶复合物的形成。如 CCCH 型锌指蛋白 13 (ZC3H13)[18]、CCHC 型锌指蛋白 4 (zinc finger CCHC-type containing 4,ZCCHC4)[19]和METTL16[20]等 (图1)。
2.m6A 去甲基化酶:m6A 去甲基化酶包括 FTO[21]、AlkB 同源蛋白 5 (AlkB homologue 5,ALKBH5)[22]、ALKBH3[23]和 ALKBH1[24](表1)。其中 FTO 是第一个被发现的去甲基化酶,也称为 ALKBH9,在热休克应激状态下 FTO 被抑制,mRNA 甲基化水平升高[21]。FTO和 ALKBH5 都属于 α-酮戊二酸依赖性双加氧酶家族蛋白,并以 Fe2+和 α-酮戊二酸依赖性方式促使 m6A 去甲基化[25]。有研究表明 ALKBH5 可以逆转 METTL3 的对转录因子 TFEB 的甲基化水平的影响,减轻缺氧诱导的心肌凋亡,增加心肌细胞自噬水平[22]。ALKBH3 是最近发现的一种 m6A 去甲基化酶,ALKBH3 介导的 tRNA 去甲基化可提高蛋白质翻译效率[23]。
3.m6A 甲基化识别蛋白:m6A 甲基化识别蛋白包括 YT521-B 同源 (YT521-B homology,YTH) 结构域蛋白家族 (YTHDF1~3、YTHDC1~2) 和异质核糖核蛋白 (heterogeneous nuclear ribonucleoprotein,HNRNP) 家族(表1)。其中 YTHDF1、YTHDF2 和 YTHDF3 主要存在于细胞质中,YTHDF1 可以与 mRNA 中终止密码子周围的 m6A位点结合,并通过招募 eIF3、eIF4E、eIF4G、PABP 和 40S核糖体亚基促进蛋白质的翻译[26]。YTHDF2 是第一个被鉴定的具有选择性识别 m6A 甲基化的蛋白,YTHDF2 的结合位点主要位于富含 GAC 序列的 3’-UTR,从而加速 mRNA底物的降解[27]。YTHDF3 可以与 YTHDF1 和 YTHDF2 相互作用,增强 YTHDF1 或 YTHDF2 与 m6A 修饰底物的结合能力[28]。YTHDC1 和 YTHDC2 则主要存在于细胞核内,YTHDC1 调节 mRNA 的剪接,YTHDC2 再进一步加速mRNA 的降解[29-30]。
HNRNP 家族成员主要包括 HNRNPA2B1[31]、HNRNPC[32]、HNRNPG[33]和 HNRNPD[21]是潜在的 m6A 甲基化识别蛋白 (表1)。有研究表明 METTL3 可以通过催化TFEB pre-mRNA 的 m6A 甲基化,促进心肌细胞中 HNRNPD与 TFEB pre-mRNA 的结合,从而降低 TFEB mRNA 表达并促进心肌细胞凋亡[22]。此外,胰岛素样生长因子 2 mRNA结合蛋白 (insulin-like growth factor 2 mRNA binding proteins,IGF2BPs) 是一种只在细胞质中表达的新型 m6A 识别蛋白,可识别 mRNA 上保守的 GG (m6A) C 序列,增强目标mRNA 的稳定性,增强 mRNA 稳定性,提高 mRNA 翻译效率[34]。
二、m6A 甲基化修饰与 OP
骨组织中直接参与骨代谢调控机制的细胞有:骨源性始祖细胞 (osteogenic progenitor cell,OPC)、OB、骨衬细胞 (bonelining cells,BLC)、骨细胞 (osteocyte,OS)、OC 等5 种。OP 主要是骨组织内的 OC 和 OB 的功能活动平衡被破坏所致。因此,OC 和 OB 常作为抗骨质疏松研究的靶细胞,且进一步的了解 m6A 甲基化修饰在 OC 和 OB 分化中扮演的角色为对抗 OP 临床研究和药物研发具有重要的意义。
1.m6A 对甲基化修饰与 OC 分化:OC 是机体内惟一具有骨吸收功能的多核巨噬细胞,OC 最典型的特征是由单核破骨细胞的细胞 -细胞融合产生的多核化,OC 前体的细胞融合是重组细胞骨架和发挥骨吸收功能所必需的,OC 通过分泌酸性水解酶和蛋白水解酶来溶解骨骼中的矿物质和细胞外基质,常作为骨代谢疾病临床治疗和药物研发的靶细胞[35-36]。近年来,有研究发现 METTL3 上调非编码 RNA circ_0008542 的 m6A 水平,促进 Circ_0008542 与miRNA-185-5p 的竞争性结合,上调 miRNA-185-5p 靶基因RANK 的表达,促进 OC 分化,增强骨吸收功能,且这一作用可被去甲基化酶 ALKBH5 逆转,其中 RANK 是 OC 分化必须因子 RANKL 的受体[37-38]。提示 RANKL/ RANK 可能是 m6A 甲基化修饰调控 OC 分化的主要通路之一。
OC 分化受多种炎症因子和炎症信号通路的调控,业已证实炎症因子 IL-6、IL-1β、TNF-α 是 OC 分化的负性调控因子[39-40]。YTHDF2 在 LPS 和 RANKL 诱导的破骨细胞前体 (RAW264.7、BMMs) 中的表达显著增加,且YTHDF2 敲低显著提高了 LPS 诱导的 IL-6、TNF-α、IL-1β和 IL-12 的表达,以及 NF-κB 和 MAPK 信号传导中 p65、ERK1/ 2、IKKα/ β、IκBα、P38 和 JNK 的磷酸化,促进了MAP4K4 和 MAP2K4 表达,并激活 MAPK 和 NF-κB 信号通路,增强 LPS 诱导的 RAW264.7 向 OC 分化的潜能[41-42]。Li 等[43]研究发现在 OC 分化过程中 RNA m6A 水平和METTL3 的表达显著增加,METTL3 敲低提高了 Atp6v0d2 mRNA 稳定性,降低了 MAPK、NF-κB 和 PI3K-AKT 信号通路中关键分子的磷酸化水平降低。因此,NF-κB 和MAPK 等炎症信号通路可能是 m6A 调控 OC 生成和炎症反应的主要机制。
2.m6A 甲基化修饰与 OB 分化:OB 是骨形成的主要功能细胞,能特异性分泌多种生物活性物质,负责骨基质的合成、分泌和矿化,调节并影响骨形成和骨重建过程。有研究表明条件敲除 OB 中 FTO 的情况下,在 12 周龄时小鼠与野生型小鼠的骨体积没有差异,而 FTO 敲除 30 周龄小鼠的骨体积比野生型小鼠低,提示 m6A 在 OB 分化中扮演了重要的角色[12]。目前,研究较多的成骨细胞诱导模型是 MC3T3-E1 细胞和 BMSCs 细胞[44-45]。其中 m6A 调控 BMSCs 向 OB 分化的机制将在下节论述。有研究表明METTL3 在 OB 分化中显著上调,METTL3 抑制 Smad 信号传导,以及 Smad7 和 Smurf1 mRNA 表达和稳定性,促进OB 分化[46]。Miao 等[47]报道 METTL3 促进淋巴增强因子-1(LEF1) m6A 水平,并激活 Wnt/ β-catenin 信号通路,其中Wnt/ β-catenin 信号通路是 OB 分化的关键通路[48]。此外,也有研究表明 m6A 可能通过 miRNA 调控 OB 分化,Mi等[49]报道 METTL3 促进 miR-7212-5p 的成熟靶向 FGFR3 抑制 MC3T3-E1 细胞的 OB 分化,Sun 等[50]报道 miR-103-3p靶向 METTL14 抑制 OB 形成。
3.m6A 甲基化修饰与 BMSCs 分化:BMSCs 具有向OB 和脂肪细胞分化的潜能,且 OP 的一个重要特征是脂肪组织在骨髓中的积累。因此,调节 BMSCs 向 OB 分化和脂肪细胞分化的动态平衡是抗 OP 的新策略。有研究表明 METTL3 是调控 BMSCs 向 OB 分化的关键去甲基化酶[12,51-54]。在 METTL3 敲低的小鼠中,小鼠骨髓中脂肪组织积累加剧,抑制成骨分化和骨矿化相关基因表达,且 BMSCs 向脂肪细胞分化潜能增加,成骨分化潜能降低,且 METTL3 敲低抑制甲状旁腺激素受体-1 (parathyroid hormone receptor-1,Pth1r) 和 p-Akt 的表达,降低 PTH 诱导 BMSCs 向 OB 分化的潜能[12,51]。METTL3 还可以通过JAK1/ STAT5/ C/ EBPβ 通路抑制 BMSCs 向脂肪细胞分化,且 YTHDF2 参与 METTL3 对 JAK1 表达的调控,促进了 JAK1 的 mRNA 的降解,进而激活 JAK1/ STAT5/ C/EBP 通路[52]。Yan 等[53]通过基因芯片测序发现在 METTL3敲低的 BMSCs 中 pre-miR-320 的 m6A 水平显著升高,miR-320 可以抑制 BMSCs 中成骨分化转录因子 Runx2 表达,从而抑制 BMSCs 向 OB 分化。有研究发现 METTL3 可能是诱导促进 BMSCs 向 OB 分化正向调节因子。此外,也有研究表明 METTL3 通过增强 m6A 对 MYD88-RNA 的修饰来上调 MYD88 的表达,从而导致 NF-κB 的激活,NF-κB 是一种成骨抑制因子,且 METTL3 对 NF-κB 的调控作用可被 ALKBH5 动态逆转[54]。
通常认为单独的 METTL14 不具有催化 RNA 甲基化修饰的能力。然而,近年来有研究表明,METTL14 在 BMSC中的过表达增强了细胞增殖和成骨分化能力,mRNA 测序结果表明 PTPN6 是 METTL14 的下游靶标,METTL14 通过m6A 增加 PTPN6 mRNA 稳定性,调节 PTPN6 的表达[55]。此外,有研究表明 OP 患者的 BMSCs 中 m6A 甲基化 RNA水平显著升高,而去甲基化酶 FTO 的水平在 BMSC 中持续下降,同时去甲基化酶 ALKBH1 敲除促进 BMSC 的脂肪生成分化,而骨髓中 BMSCs 中 ALKBH5 的条件敲除增强了小鼠的骨量,提示去甲基化酶 FTO、ALKBH1 和ALKBH5 广泛参与了调节 BMSCs 向成骨分化[24,56-57]。在机制上,FTO 靶向 PPARγ mRNA 去甲基化,上调 PPARγ 表达,抑制转录因子 Runx2 的表达,促进 BMSCs 向脂肪细胞的分化,且 miR-149-3p 通过靶向 FTO 抑制 BMSCs 向脂肪细胞分化,并增强其成骨分化能力,ALKBH5 则通过提高蛋白精氨酸甲基转移酶 6 (PRMT6) 的 mRNA 衰变率,抑制 BMSCs 向 OB 分化[57-59]。综上所述,m6A 修饰在调节BMSCs 向 OB 分化和脂肪细胞分化之间的转换中发挥着重要作用,METTL14 和 METTL3 促进 BMSCs 向 OB 分化,而 FTO 则相反 (图2)。

图2 m6A 甲基化修饰调节 BMSCs 细胞向 OB 和脂肪细胞分化Fig.2 Mechanisms of m6A regulating BMSCs differentiation
三、小结与展望
m6A 甲基化修饰在 OP 调节中具有重要的作用,能够调节 OC、OB 分化以及 BMSCs 分化谱系,且 m6A 甲基化修饰能够提高 RNA 的稳定性,改变 RNA 的剪切和翻译,在众多生物样品中用作指导诊断、预后、治疗的生物标志物的潜力。但目前仍无 OP 甲基化检测的试剂盒,以及外周血 RNA 甲基化标记用于 OP 患者的临床筛检和疗效监测的可行方法,特别是针对 m6A 甲基化修饰的药物研发较为滞后。因此,致力于开发 OP 中 m6A 甲基化修饰检测试剂和药物研发可能成为 OP 研究的热点。

