Gorham-Stout 综合征股骨近端骨溶解行人工全髋关节置换术治疗一例报告
王广林 郑连杰 杨梁
Gorham-Stout 综合征 (Gorham-Stout syndrome,GSS)又称骨溶解病、特发性大块骨溶解骨病等,特征是骨基质中血管结构的增殖与进行性骨破坏和骨吸收[1],且无新的骨形成[2-3]。到目前为止,所见报道约 300 例[1]。GSS 迄今病因未明。多位学者提出过可能的多因素病理机制。组织病理学标志是扩张性、侵袭性的毛细血管组织或纤维组织非肿瘤性增殖取代正常骨骼[4-7]甚至骨周软组织[7]。临床表现可出现受累部位的疼痛或功能障碍。
2018 年 6 月,我科收治 1 例骨溶解病的病例,病程已进展至右股骨近端彻底溶解,动态观察至其病程无进展,为其进行了人工全髋关节置换手术治疗,术后效果良好。报告如下,供同道参考借鉴,以提高对 GSS 的认识。
临床资料
一、病史
患者,女,55 岁,汉族,停车场保安人员。因“右下肢‘力弱’2 周,右下肢立位‘无力’2 天”入院。现病史:2 周前无明显诱因出现右下肢力弱并逐渐加重,就诊于当地医院,诊断为“右髋关节炎”未治疗,2 天前开始出现右下肢立位“无力”而无法行走。既往史:20 年前外伤至腰椎骨折,行腰椎骨折切开内固定术。20 年前外伤至腰椎骨折行腰椎骨折切开内固定术,10 年前因发热伴双下肢疼痛于外院取出腰椎内固定物,术后发热症状消失,双下肢疼痛症状持续至今,当时手术相关病历资料患者无法提供,具体不详,患者曾因双下肢持续疼痛症状就诊于全国各大骨科顶级专科均被告知未发现确切病因无有效治疗方式,故长期靠镇痛药物减轻疼痛。患者本次发病于我院就诊前曾就诊于当地医院并被其诊断为“右髋骨关节炎”,患者无法提供当时就诊的病历或影像学资料。否认相关疾病家族史。
二、体格检查
脊柱四肢发育正常,未见明显肌肉萎缩。右髋局部无压痛。仰卧体位:右髋屈髋、后伸、外展、内收肌力均为3 级,右髋主动活动范围:0° (伸)~90° (屈),5° (内收)~10° (外展)。双足背动脉搏动良好。
三、诊断与治疗
入院第 2 日 (图1)、第 7 日 (图2)、第 15 日 (图3),X 线片复查。
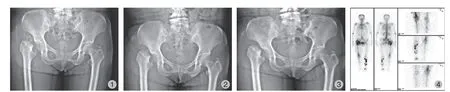
图1 右股骨近端骨质缺失,股骨颈残缘略不规整,右髋周多发高密度 (骨碎片) 影图2 右股骨近端骨质缺如,股骨颈残端骨质进一步吸收,残缘平滑,右髋周高密度影较图1 明显减少图3 右股骨近端骨质残端较前无明显变化,右髋周高密度影基本消失图4 显示右髋尤其右股骨上端局部核素分布增浓Fig.1 Osteolysis in the proximal right femur,the femoral neck stump is slightly irregular,and there are multiple high-density (bone fragments)shadows around the right hipFig.2 The proximal bone mass of the right femur is absent,the bone mass of the femoral neck stump is further absorbed,the residual margin is smooth,and the high-density shadow around the right hip is significantly reduced compared with the anterior film (Fig.1)Fig.3 There was no significant change in the bony stump of the proximal right femur,and the high-density shadow around the right hip basically disappearedFig.4 Local nuclide distribution is thickened in the right hip,especially at the upper end of the right femur
入院后完善血常规、C 反应蛋白、血沉、风湿系列等化验指标,结果均在正常范围。肿瘤标志物全项:仅 Fbe升高,余全部阴性。血、尿 Kappa 清链、免疫固定电泳等血液系统疾病相关指标均在正常范围;梅毒非特异性抗体(+),复查梅毒抗体滴度 1∶16 阴性。CT 检查示:右股骨近端缺如,右髋周多发高密度影。增强 MRI 示:右髋滑膜炎,右髋部肌肉水肿。未见骨破坏改变或局部富血运信号等。核素全身骨显像显示右髋尤其右股骨上端局部核素分布增浓 (图4)。腰椎 CT 示:L4~5节段间盘突出、相应节段椎管狭窄。CT 引导下右股骨近端残端穿刺行组织学检查。结果镜下可见多个纤维细胞,未见肿瘤细胞。病理检查显示纤维组织内血管丰富,多数血管壁薄,可见单层扁平内皮细胞衬附等 (图5)。确定诊断为 GSS。

图5 见增生的纤维和血管组织,纤维组织内血管丰富,团簇状分布,血管管径较小,成毛细血管或细静脉形态,多数血管壁薄,可见单层扁平内皮细胞衬附。纤维血管组织表面见层状纤维素样渗出物,见少量死骨。病理报告未见成骨现象,未见肿瘤细胞,未见炎性细胞浸润 (HE×100)图6 右股骨近端骨质残端较入院第 15 日 (图3) 无明显变化,右髋周高密度影基本消失图7 术后第 2 天 X 线片图8 增生的滑膜组织,伴肉芽组织增生及异物肉芽肿形成,淋巴细胞和浆细胞浸润,滑膜表面可见纤维样物沉积 (HE×100)Fig.5 hyperplastic fibers and vascular tissue,fibrous tissue is rich in blood vessels,cluster distribution,vascular diameter is small,capillary or venous morphology,most blood vessels have thin walls,and a single layer of flat endothelial cells can be seen.Laminated cellulose-like exudate on the surface of fibrovascular tissue and a small amount of dead bone are seen.There was no osteogenesis,no tumor cells,and no inflammatory cell infiltration in the tissues sent for examination (HE × 100)Fig.6 There was no obvious change in the bony stump of the proximal right femur,and the high-density shadow around the right hip basically disappeared,and there was no difference from the anterior film (Fig.3)Fig.7 X-rays on the second postoperative dayFig.8 Hyperplastic synovial tissue,with granulation tissue hyperplasia and foreign body granuloma formation,lymphocyte and plasma cell infiltration,fibrous deposition on the synovial surface (HE × 100)
给予患者唑来膦酸 5 mg 静脉输液一次,并在用药前告知患者应用此药可能对此病治疗有帮助、属超常规适应证给药。并给予钙剂和阿法骨化醇口服治疗。鉴于患者骨质溶解进程尚未停止,预约患者出院,嘱其定期复查,待病程稳定后择期手术。治疗后 2 个月 (发病后第 70 日) 患者再次入院,复查 X 线片 (图6) 较入院第 15 日 (图3) 无明显改变,判断患者骨溶解病程已停滞,次日行右侧人工全髋关节置换术,术后复查 X 线片 (图7),常规予预防切口感染、预防下肢静脉血栓等处置并指导其常规下肢功能锻炼。术后查体:右下肢肌力 5 级。术后病理显示:(右股骨颈) 骨组织变性、溶解,骨髓腔内可见溶解的骨碎片及粉染蛋白或纤维样物,未见破骨反应或成骨征象;(右髋关节囊) 可见增生的滑膜组织伴肉芽组织增生及异物肉芽肿形成等 (图8)。术后病理检查再次印证 GSS 诊断。术后出现人工关节脱位,手法复位后反复脱位,行人工关节翻修术,术后 4 个月于当地医院复查 (图9)。术后 2 年10 个月电话随访时术侧肢体功能良好。

图9 翻修术后 4 个月随访,关节假体位置良好,骨质无明显变化Fig.9 Post-operation ollow-up X-ray taked in the 4th month after revision surgery: the joint prosthesis stained good position and there was no significant change in bone quality and morphology
讨论
GSS 是一种非常罕见的疾病,其特征为血管增殖和进行性骨溶解且不伴新骨形成[2-3]。1838 年首次报道[8],GSS 发病率性别差异不明显 (男∶女比例约为 1.6∶1),在不同地域和种族之间发病率亦没有明显差异,大多无创伤史,也没有相关疾病的家族史,病灶通常是单心的,在局部具有侵袭性,受累区域发生骨吸收,病灶甚至可延伸到骨周围的软组织中。
本病发病机制尚不清楚,可能的病理机制是多因素的,触发因素至今未知。血管内皮细胞生长因子 (vascular endothelial growth factor,VEGF) 和淋巴管生成相关的生长因子如血小板衍生生长因子 (platelet derived growth factor,PDGF-BB) 与 GSS 的发病有关[1,7],但病灶处这些血管生长因子来源于哪里?是哪种细胞产生的?可能是基因缺陷的结果,也可能是原有的骨细胞发生功能紊乱的结果,这些问题迄今没有确切答案,仍须进行深入的研究与探索。位于第 7、第 12、第 20,三个染色体上的基因重组尤其是包括 ATG101 基因在内的基因融合可能导致了 GSS 的发生[9]。
GSS 症状发生在病变局部,通常不伴全身症状。病灶多为单个或可发展为多个病灶,并可累及任何骨骼区域,但主要分布于肩部、颅骨、下颌和骨盆、股骨[10-13]。典型症状包括受累区域的肿胀、疼痛和 (或) 功能障碍[14]。本例 GSS 发生于右股骨,表现为右股骨无诱因的“肌力”减弱。
GSS 无特异性体征,甚至病灶局部无水肿,皮色也正常。也无特异性的化验检查。
GSS 在 X 线和 (或) CT 表现为没有任何骨修复迹象的骨的渐进性、大规模破坏。破骨和溶骨始于髓内或皮质下骨区域,骨进行性破坏并伴随骨质的溶解[15-17]。MRI 是评估 GSS 病程进展程度的首选影像学检查,它对软组织病变的显示比 CT 更敏感,病程的初期 GSS 病灶通常在 T1加权自回旋序列上显示异质高信号,在 T2加权序列上显示甚至比 T1加权序列更高的异质信号[16]。在 GSS 病程的后期,由于纤维组织替换原有的骨或血管组织,病灶通常在T1WI 和 T2WI 上都表现出低信号。在 GSS 病程的初期,放射性同位素全身骨显像上显示出局部核素摄取的增加;当病程进展,相应区域核素摄取减少。所有的影像学检查并不具特异性,须结合放射学和组织病理学,最终以组织病理学结果作为诊断 GSS 的金标准。其组织病理学表现为:非特异性的异形血管增殖,局部可存在血管瘤,内衬扁平上皮的薄壁血管,由皮质和海绵状骨组成的囊性的骨骼组织、骨小梁不规则,多个溶骨性病变区,不存在异型性细胞核。
1983 年,Heffez 等[18]提出了诊断 GSS GSD 的八项标准:(1) 组织病例活检阳性 (具有异常淋巴通道和大量破骨细胞的血管瘤组织);(2) 不存在细胞异型性;(3) 极少或没有成骨细胞,无营养不良性钙化;(4) 局部进行性骨吸收的证据;(5) 非扩张性、非溃疡性病变;(6) 无内脏受累;(7) 影像学显示溶骨性改变;(8) 排除遗传、代谢、肿瘤、免疫或感染性病因。
GSS GSD 的诊断非常困难,须排除所有其它潜在的骨质溶解原因,如癌症,感染,炎症和一些遗传性疾病。须鉴别的主要疾病有:多发性骨髓瘤、淋巴管瘤病、全身任何部位原发性肿瘤的骨转移,Hajd Cheney 综合征,佩吉特病,类风湿性关节炎、纤维发育不良,朗格汉斯细胞组织细胞增多症、温彻斯特综合征 (骨溶解类疾病 Hardegger分类的 Ⅴ 型),腕跗骨骨溶解症 (骨溶解类疾病 Hardegger分类的 Ⅰ~Ⅲ 型)、特发性多中心骨质溶解症、骨质溶解伴肾病和嗜酸性肉芽肿病、动脉瘤骨囊肿、骨肉瘤等Johnson 等[19]将 GSS 病程大致分为两个阶段:第一个阶段是血管增殖并侵袭破坏骨组织,第二阶段是被破坏和吸收的骨组织被纤维组织填充。
尚无循证医学证据证明,任何单一治疗方式可以有效治疗这种疾病。双膦酸盐因其抑制破骨活性的作用而在治疗 GSS 中被广泛使用[20-22]。干扰素 α-2b (Ifn-a2b) 是另一种可抗血管生成的药物也被较广泛用于 GSS 治疗,但其很少作为单独的治疗方式,通常与其它治疗方案结合使用,如结合应用双膦酸盐[23-25]或放射治疗[26-28]。西罗莫司作为免疫补充剂抑制细胞增殖和血管生成,也被用于 GSS 的治疗,其通过抑制 mTOR (哺乳动物的雷帕霉素靶标) 来阻断可刺激细胞生长和血管生成的 IL-2 信号通路而起到上述作用[29]沙利度胺是新用于治疗 GSS 的药物,能够降低 VEGF 水平以阻止血管增殖和多核巨噬细胞的形成[30]。β-受体阻断剂普萘洛尔也已被用于 GSS病例的治疗,其原理是下调丝裂原活化的蛋白激酶信号通路以降低 VEGF-A 的表达。多数情况下,骨移植物在GSS 病程进展阶段常常会被溶解吸收,无法达到预想的治疗效果[31]。放射治疗可减小 GSS 病灶大小[18]、阻止骨吸收[32]。须根据患者的发病部位和具体病情采取合适的治疗方式。对于发生于关节部位且骨质溶解缺失范围大的病例,关节置换可作为其有效的治疗手段。

