膝关节骨关节炎患者关节软骨 T1 rho 的影响因素分析
卢世鑫 张格日乐 付庆鹏
膝关节骨关节炎[1](knee osteoarthritis,KOA) 是一种以关节软骨退变损伤和继发性骨质增生为主要特点的慢性退行性疾病,病理类型主要包括膝关节软骨病变、滑膜病变、骨赘、半月板损伤、韧带损伤和关节积液等[2]。临床症状主要为关节局部疼痛、僵硬、活动受限,晚期可使患者下肢瘫痪,严重影响患者的生活质量。目前,中国 40 岁以上人群 KOA的发病率约为 17%,其中 60 岁女性约占 50%[3],如能在 KOA 发生早期进行诊断和干预治疗,对患者预后具有重大意义。临床治疗 KOA 主要以保护和修复受损关节软骨为主。磁共振生理学成像 (magnetic resonance imaging,MRI) 方法已经成为膝骨关节炎早期诊断和定量评估的重要研究方法之一[4],其中自旋晶格弛豫时间 (the spin lattice relaxation in the rotating frame,T1 rho) 成像技术可以对软骨的生化改变进行定量分析,对运动受限的水分子质子及正常关节软骨细胞外基质中的蛋白多糖大分子间的相互作用比较敏感。T1 rho 值随着水分子与蛋白聚糖结合而增加,不仅能提供量化蛋白多糖丢失的方法,还能判断关节软骨是否进入不可逆的 KOA 后期阶段,具有设备简单易操作、成像时间短、图像分辨率高等优点[5],广泛应用于关节软骨退变和膝关节半月板等纤维软骨的结构上,是目前研究的重点关注对象。因此,本研究通过比较分析影响 KOA 患者T1 rho 值变化的危险因素,并探讨关节软骨 T1 rho值与 KOA 患者临床症状、关节软骨缺损和骨髓病变之间的关系,以期为临床诊疗提供理论依据。
资料与方法
一、实验组纳入标准与排除标准
1.纳入标准:(1) 2019 年 3 月至 2021 年 5 月,因关节疼痛、肿胀来院就诊的 KOA 患者;(2) 年龄 ≥ 50 岁者;(3) 近 1 个月内膝关节反复疼痛者;(4) 站立或负重位 X 线片显示关节间隙变窄、关节缘骨赘形成和软骨下骨囊性变者;(5) 晨僵 ≤30 min 者;(6) 活动时有骨摩擦音者;(7) 关节液(至少 2 次) 清亮、黏稠,WBC <2000 个/ ml,符合(1)+(2、3、4、5、6 条中的任意两条) 可诊断为KOA 者。
2.排除标准:(1) 使用过影响软骨药物的慢性疾病史者;(2) 膝关节先天或后天畸形者;(3) 存在膝关节外伤及手术史者;(4) 急性或慢性传染性疾病者;(5) 精神疾病者;(6) BMI ≥ 28 者。
二、研究对象
本研究实验组共纳入 160 例均符合《骨关节炎诊治指南》[6]的 KOA 诊断标准。其中男 83 例,女77 例,年龄 52~75 岁,平均 (54.11±6.38) 岁;对照组 (来院体检的健康成人) 165 例,男 80 例,女85 例,年龄 50~65 岁,平均 (52.38±5.11) 岁。两组患者在性别、年龄、体质量指数 (body mass index,BMI) 等方面比较,差异无统计学意义 (P>0.05)。
本研究经我院伦理委员会审核批准通过,所有患者及其家属对本研究知情同意并签署知情同意书。
三、方法
1.一般资料的收集:通过医院电子病历单收集患者一般资料,包括年龄、性别、BMI。
2.MRI 检查仪器与方法:采用 GE Discovery MR750 3.0 T MRI 设备及膝关节专用线圈 (HD TR knee)进行 KOA 患者膝盖 MRI 检查,检查前 3 h 患者无明显剧烈运动。以髌骨下方作为扫描中心,扫描参数设置为:矢状位 T1 rho,TR 80 ms,TE 4.0 ms,层厚3.0 mm,层距 1.5 mm,视野 180 mm×180 mm,重建矩阵 512×512,自旋锁定频率 (the frequence of SL,FSL) 500 Hz,延迟 1700 ms,扫描时间 10 min。
3.图像处理方法:由 2 位影像学诊断医师对MRI 图形进行评估,意见一致为标准。将扫描图像传至 GE ADW4.6 工作站 Functool 软件,经处理分析生成 T1 rho 伪彩图。继而勾画 4 个大小为 1 mm2的感兴趣区 (region of interest,ROI),ROI 邻近半月板后角中心的关节软骨处,将髌骨分为内、外、中3 部分,股骨分为内外 2 部分,胫骨分为内外 2 部分,共 7 部分,在研究过程中按照软骨厚度分区方法将其分为深、浅两层。
4.具体操作方法:于原始图像上找出髌骨、股骨和胫骨的最大显示面,由临床经验丰富的放射科医师勾画出膝关节软骨边缘,计算中轴线及中轴线法线,沿法线区域方向等间距分为深、浅层,根据中轴线长度选择两条合适法线将软骨区域分为内、中、外 3 部分,股骨和胫骨各选一条法线将其分为内外 2 部分 (图1)。将分层后的图像传入 Image J 软件,软件自动计算各位置 T1 rho 值。

图1 a:膝关节软骨正常成人 T1 rho 图;b:膝关节软骨正常成人 T1 rho 后处理伪彩图;c:KOA 患者 T1 rho 图;d:KOA 患者 T1 rho 后处理伪彩图 (箭头为患者病变部位)Fig.1 a: T1 rho of adults with normal knee cartilage;b: Pseudo-color T1 rho post-processing for adults with normal knee cartilage;c: T1 rho chart of patients with knee osteoarthritis;d: Pseudo-color T1 rho post-treatment for patients with knee osteoarthritis
四、评分标准
由 2 位具有 5 年以上,在骨关节科工作经验的医师根据影像学资料确定患者病变位置并对软骨缺损程度和病变程度进行评分。
1.加拿大西安大略和麦克玛斯特大学 OA 指数(Western Ontario and McMaster Universities Osteoarthritis Index,WOMAC)[7]:利用 WOMAC 量表进行自我评定,包括 5 项疼痛、2 项僵硬及 17 项关节功能,评分均采用视觉模拟评分 (visual analogue scale,VAS)[8](表1)。
表1 WOMAC 量表评分Tab.1 WOMAC scale score
2.国际关节软骨修复协会 (the International Cartilage Repair Society,ICRS) 评分[9]:按照 ICRS分级标准将软骨病变分为 5 级 (表2)。

表2 软骨病变的 ICRS 分级标准Tab.2 ICRS grading criteria for cartilage lesions
3.全膝关节磁共振成像积分 (Whole organ magnetic resonance imaging score,WORMS)[2]:髌骨病变依据 WORMS 标准共分为 3 级,0 级:未发现骨髓病变;1 级:髌骨病变累计面积 <25%;2 级:髌骨病变累计面积 25%~50%;3 级:髌骨病变累计面积 >50%。
五、治疗方法
所有入组患者均由同一组医师进行全膝关节表面置换术治疗。入室后采用腰硬联合麻醉法对仰卧位患者进行麻醉,在膝正中作 1 个长约 15 cm 的切口,髌骨旁内侧入路切开关节囊,暴露关节腔后,电灼去神经化处理并将关节周围增生骨赘、脂肪垫和交叉韧带进行切除,显露胫骨面,选择合适假体用骨水泥进行固体,置入衬垫并止血,放置引流管屈曲位进行加压包扎。
六、观察指标
选取人工膝关节表面置换术截取下来的软骨组织,利用咬骨钳将磨损部位裁剪成 1.0 cm×0.5 cm×0.5 cm 的组织块,经生理盐水冲洗多次,直至表面血液和髓核组织去除干净,将其放入 4% 甲醛溶液中,常温下固定 12 h 进行脱钙处理,石蜡包埋切片,采用阿尔新蓝染色观察蛋白多糖的含量变化 (图2)。
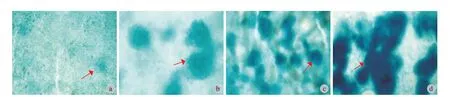
图2 红色箭头所指为阳性异常部分,多糖含量在不断增加 (阿尔新蓝染色×400) a:细胞培养第 3 天;b:细胞培养第 5 天;c:细胞培养第 7 天;d:细胞培养第 9 天Fig.2 Alcian blue staining (Bar=50 μm) a: Cell culture at day three;b: Cell culture at day five;c: Cell culture at day seven;d: Cell culture at day nine
七、随访
1.随访时间及方式:所有入组患者于出院后6 个月内,以门诊随访的方式运用 Shahariarre 评分标准进行评估,至少由 1 名家属陪同并协助完成监督量表。
2.Shahariarre 评分标准[10]:按照 Shahariarre 评分标准将患者分为优:疼痛感消失,肿胀消退,关节功能正常;良:疼痛和肿胀明显减轻,无压痛,关节功能基本正常;差:疼痛、肿胀及关节功能均无明显改善。预后良好为:Shahariarre 评分优 +良;预后不良为:Shahariarre 评分差。
八、统计学处理
采用 SPSS 22.0 对数据进行统计学分析。计数资料以例数和率 (%) 表示,组间比较采用χ2检验;符合正态分布的计量资料采用±s表示,组间比较采用两独立样本组间t检验,组内比较采用配对t检验;采用多因素 Logistic 回归方法分析影响 T1 rho值增加的危险因素;SPSS 22.0 软件构建箱式图分析关节软骨 T1 rho 值与患者软骨缺损及骨髓病变的关系;Kaplan-Meier 法绘制生存曲线分析 T1 rho 值与患者预后的关系,并采用 Log-Rank 检验比较组间差异。P<0.05 为差异有统计学意义。
结果
一、实验组和对照组 T1 rho 值的比较
实验组患者股骨前内侧、股骨前外侧、股骨后内侧、股骨后外侧、髌骨内侧、髌骨中部、髌骨外侧、胫骨外侧和胫骨内侧平均 T1 rho 值均明显高于对照组,两组比较差异有统计学意义 (P<0.05) (表3)。
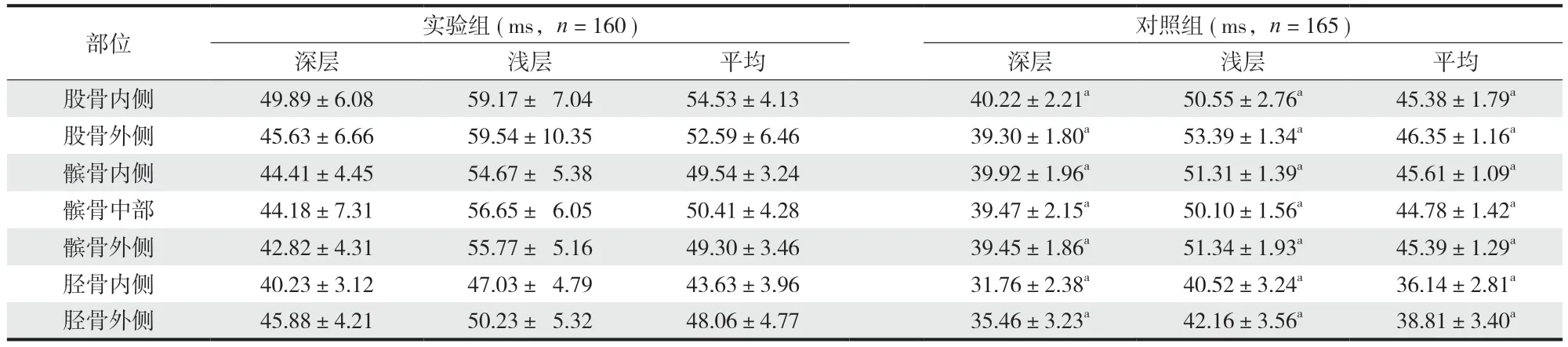
表3 两组患者各区域 T1 rho 值比较Tab.3 Comparison of T1 rho values in different areas between the two groups
二、不同 T1 rho 值的 KOA 患者临床资料比较
实验组 160 例按照 T1 rho 值的中位数 (45.50 ms)分为 T1 rho 值 >45.50 ms 组 (75 例) 和 T1 rho 值 ≤45.50 ms 组 (85 例),两组患者性别、年龄、BMI、病变位置、WOMAC 疼痛、僵硬、功能障碍评分比较差异无统计学意义 (P>0.05);T1 rho 值 >45.50 ms组蛋白多糖含量明显低于 T1 rho 值 ≤ 45.50 ms 组,而 ICRS 分级 ≥ 2 级、WORMS 分级 >1 级明显高于 T1 rho 值 ≤ 45.50 ms 组,差异有统计学意义 (P<0.05) (表4)。
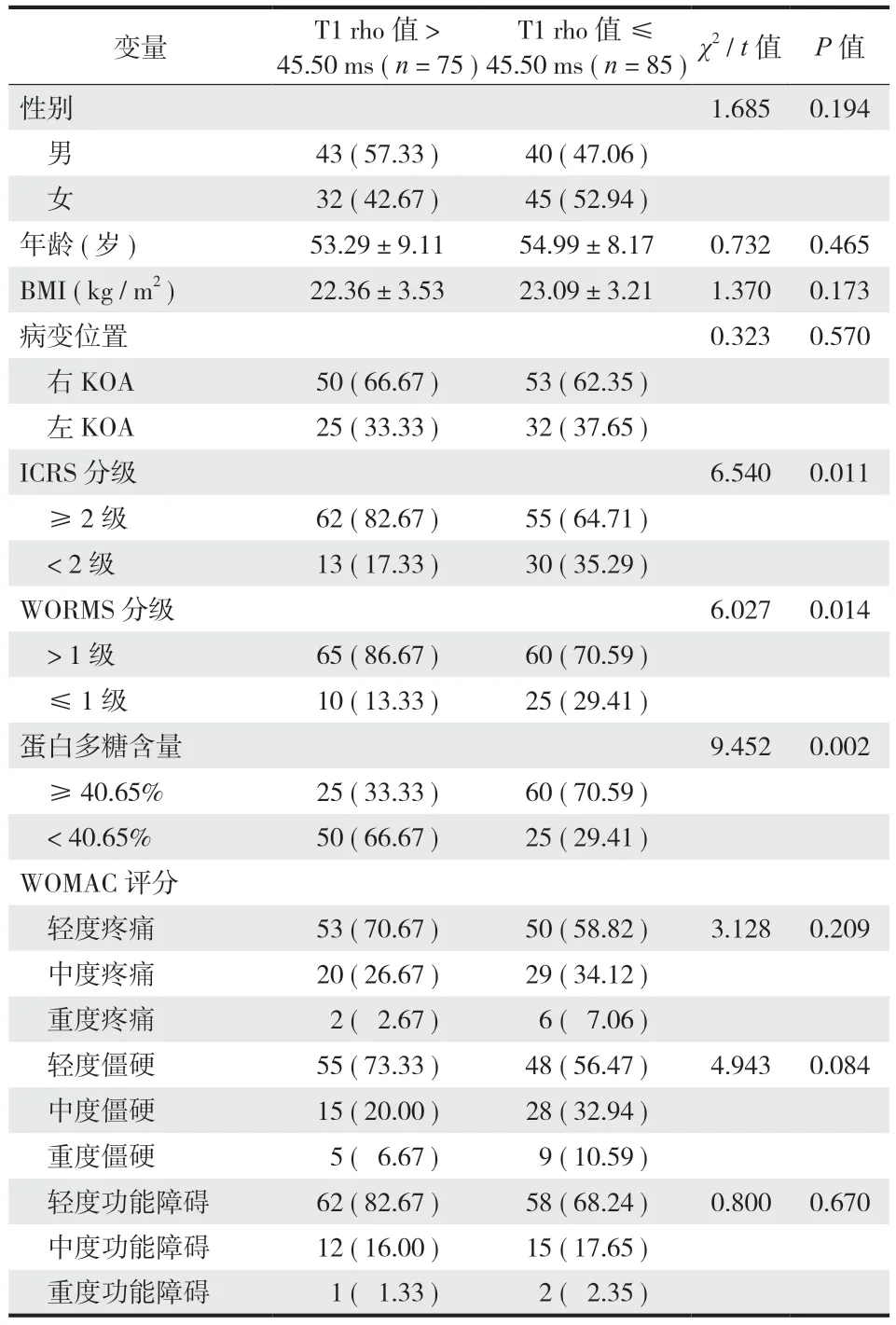
表4 两组患者指标的单因素分析 [n (%)]Tab.4 Univariate analysis of patient indicators between the two groups [n (%)]
三、多因素 Logistic 回归分析影响患者关节软骨 T1 rho 值增加的因素
将蛋白多糖含量、ICRS 分级、WORMS 分级作为自变量,T1 值是否高于中位数 (T1 rho 值 ≤45.50 ms=0,T1 rho 值 >45.50 ms=1) 为因变量纳入多因素 Logistic 回归分析中,结果表明,蛋白多糖含量低、ICRS 分级 ≥ 2 级、WORMS 分级 >1 级是影响 KOA 患者 T1 rho 值升高的独立危险因素 (P<0.05) (图3)。
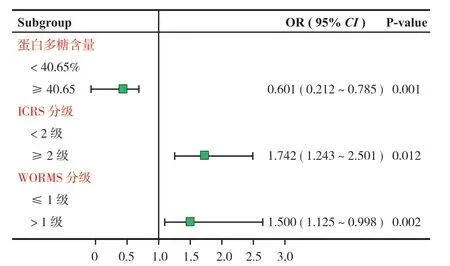
图3 影响 T1 rho 值升高危险因素的多因素分析森林图Fig.3 Forest map of multifactor analysis of risk factors affecting T1 rho value elevation
四、关节软骨 T1 rho 值与患者软骨缺损及骨髓病变的关系
将 ICRS 级别和 WORMS 级别作为自变量,160 例患者 T1 rho 值作为因变量,绘制成箱式图,结果显示,随着 ICRS 级别和 WORMS 级别的升高加重,T1 rho 值也在逐渐增加 (P均 <0.001) (图4)。
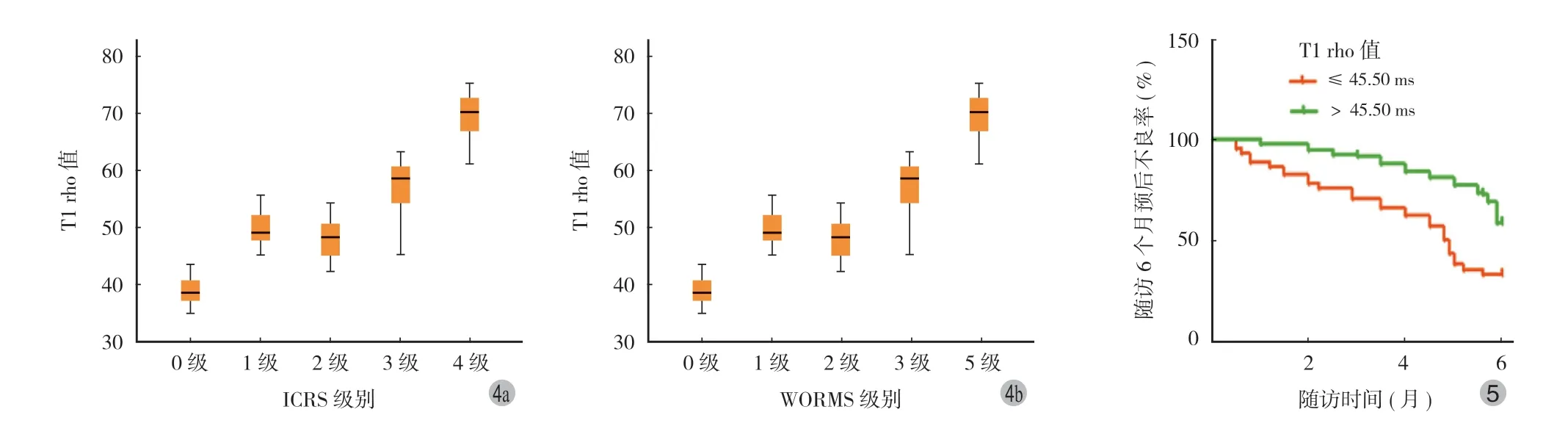
图4 T1 rho 值与软骨缺损及骨髓病变间的箱式图图5 T1 rho 值对患者预后的预后评估价值Fig.4 Box diagram of the relationship between T1 rho values and cartilage defects and myelopathyFig.5 Prognostic value of T1 rho on prognosis
五、生存曲线分析 T1 rho 值对患者预后的影响
建立生存曲线分析 T1 rho 值对患者的预后评估价值,随访 6 个月发现,T1 rho 值 >45.50 ms 的患者预后不良率为 66.67% (50/ 75),明显高于 T1 rho 值 ≤45.50 ms 患者 41.18% (35/ 85),差异有统计学意义(Log-Rankχ2=10.396,P=0.001) (图5)。
讨论
KOA 是一种中老年人多发的慢性骨关节病,已成为除骨质疏松外最常见的骨代谢疾病。过度肥胖、机体衰老、外界创伤、劳损过度都可能造成 KOA 的发生[11]。KOA 发展到晚期,临床治疗常采用关节镜下自体骨软骨移植及人工全膝关节置换术[12],但手术费昂贵,患者承受痛苦大,因此 KOA早期发现和诊断非常重要。KOA 的标志是关节软骨退化改变,关节软骨是一种能降低关节间摩擦力的结构,主要由少量细胞、水、胶原纤维和蛋白质多糖组成[13]。关节软骨退变早期主要体现为蛋白多糖含量降低、水含量增加、Ⅱ 型胶原纤维缺失及排列方式紊乱,使关节软骨肿胀变性;晚期关节软骨中的大部分结构消失,致使关节活动受限,严重时可能丧失行动能力[14]。这些生化指标的改变无法通过常规的 MRI 图像检测,是一种软骨成像技术,主要评价处于射频脉冲磁场中组织的自旋弛豫值。其在诊断蛋白多糖含量时具有较高的特异性和敏感性[15],提示 T1 rho 成像技术可以用于早期骨关节炎的诊断和监测疾病进展过程。T2 mapping 是软骨横向弛豫时间 T2 值的空间分布图,T2 值主要受软骨水含量和周围胶原排列的影响,可以作为软骨退变的无创检测方法,但由于软骨组织蛋白多糖的消耗早于水含量和胶原纤维的改变,故 T1 rho 较T2 mapping 能更早的反应膝骨关节炎的生化改变,且相较于延迟对比增强计数和钠 MRI 成像技术,其不需要静脉注射造影剂,属于非侵入性操作,具有更广泛的应用价值。
本研究通过对正常人群和 KOA 患者群进行T1 rho 值分析比较,发现实验组患者 T1 rho 值明显高于正常人群,提示 T1 rho 成像技术可以客观评价软骨的病损程度。再对实验组 160 例进行单因素分析时发现,年龄与 T1 rho 值增加无明显相关性,这与陈玲等[16]的研究不符,可能是因为本研究纳入的样本量有限,还需扩大样本量继续研究。Nissinen等[17]研究表明,T1 rho 值受蛋白多糖侧链羟基和氨基影响,蛋白含量丢失,T1 rho 值增加,这与本研究的结果一致,可能的解释为:蛋白多糖能吸引组织液中的阳离子和自由水进入软骨基质,增加软骨基质的弹性和抗压能力,当软骨中蛋白多糖含量大量丢失,使细胞外基质系统紊乱,导致白介素-6、肿瘤坏死因子和白血病抑制因子大量生成,加快了蛋白多糖的降解速率,导致软骨表面出现裂痕、溃疡,加速 KOA 严重程度,使 T1 rho 值增加。Soellner等[18]研究表明,随着关节软骨缺损等级的增高,T1 rho 值也在逐渐升高,方舒等[19]研究表明,T1 rho 值增高可能伴随骨髓病变的发生,以上 2 个研究结果均与本研究相符,提示 T1 rho 值增加与软骨损伤和骨髓病变存在一定的相关性。本研究的生存曲线显示,T1 rho 值 >45.50 ms 组预后不良率明显高于 T1 rho 值 ≤ 45.50 ms 组,提示 T1 rho 值与 KOA患者预后存在相关性。
本研究的不足:(1) 病例数较少;(2) 回顾性研究,可能导致实验结果出现偏倚;(3) 本研究采用的 ICRS 评分属于一种半定量指标,在评分过程中会存在一定的主观误差。
目前 T1 rho 值的测量仍然是以分区内的整体均值作为测量结果,无法反映更微观分区内的具体变化,后续研究将致力于更多数据的收集,做到细致分区并匹配更加先进的生物力学检测。
综上所述,T1 rho 值随着软骨缺损程度和骨髓病变程度的升高而加重,T1 rho 值可作为早期诊断与监测 KOA 病情发展的良好指标。

