鲍低氧胁迫响应机制的研究进展
张克烽,王艺磊,张子平
(1.泉州市水产技术站,福建 泉州 362000;2.集美大学水产学院,农业农村部东海海水健康养殖重点实验室,福建 厦门 361021;3.福建农林大学海洋学院,海洋研究院,福建省海洋生物技术重点实验室,福建 福州 350001)
鲍,隶属软体动物门(Mollusca)腹足纲(Gastropoda)前鳃亚纲(Prosobranchia)原始腹足目(Archaeogastropoda)鲍科(Haliotidae)鲍属(Haliotis)。其味道鲜美,营养丰富,还具有较高的经济价值和药用价值。2021 年,全国鲍养殖产量为217 831 t[1],其养殖业已成为我国海洋经济发展中重要的组成部分。鲍养殖业的发展,在为百姓提供优质蛋白和大量就业机会的同时,也促进了藻类养殖业的发展,而藻类养殖业除了可为鲍提供优质的饵料外,还可减碳、降低沿海水质富营养化的风险,减少赤潮的发生[2]。可见,鲍养殖业是一种经济效益、社会效益和生态效益均较高的养殖产业。工厂集约化养殖和海区延绳式多层笼吊养是目前我国鲍养殖的主要方式。然而,近年来,随着养殖密度的增大和常年投饵养殖造成的残饵及粪便等有机物的累积,加上陆地上大量的营养盐及人类活动产生的工业、农业、生活等污水的排入,赤潮频发,使得近岸养殖水域中的耗氧物质增多,水体缺氧现象时常出现,从而造成养殖鲍大规模死亡的现象时有发生,有时死亡率甚至高达60%,给鲍养殖业带来了严重的经济损失,制约着鲍养殖业的健康可持续发展[3-8]。
众所周知,大多数生物需要分子氧(O2)来支持其基本的代谢。氧在细胞中的主要作用是在线粒体中作为产生三磷酸腺苷(adenosine triphosphate,ATP)的氧化磷酸化过程的最终电子受体,在此过程中,每个葡萄糖分子可被完全氧化产生32 个ATP[9]。此外,细胞内总O2的10%~15%被许多需氧代谢反应,如单/双加氧酶、氧化酶和过氧化物酶所催化的反应所消耗[10]。所以,当氧含量无法满足细胞的氧化磷酸化等需氧反应时,细胞就处于低氧胁迫状态。在低氧胁迫下,由于葡萄糖分子未能被完全氧化,每个葡萄糖分子通过糖酵解等途径仅产生2 个ATP 和有机酸,所以低氧胁迫会使有机体的产能效率降低且会对需氧生物广泛的生物化学、生理学、发育和行为等过程,包括呼吸、生长、代谢、繁殖和运动等产生有害的影响[10]。故此,溶解氧(DO)是养殖水体中保证养殖生物生命活动正常进行的一个关键因子。在一个大气压、温度为25 °C 时,水中的饱和溶解氧为7.5 mg/L[10]。温度升高时,水中的DO 会减少。一般而言,水质较差的养殖水体中的DO 往往较低,而低DO 又会引起养殖动物的代谢异常,进而影响其生长和抗病力等,严重时甚至会导致养殖动物的死亡。造成低DO 的原因是多方面的,如高温、赤潮、天气突变及高密度养殖等均会引起低DO[4-7]。早在20 世纪60 年代就有人发现,DO 低于2 mg/L 时银鲑(Oncorhynchus kisutch)会大量死亡,于是提出将DO 低于2 mg/L 的现象称为低氧(hypoxia)[11]。但由于不同生物的生活习性不同,对DO 的需求也不同,因此以某一DO 来统一定义所有生物的低氧是不合适的。临界含氧量(COL)系指低于此含氧量时,某种动物的摄氧量取决于其环境的含氧量而不再能维持稳定[12];把低于COL 的DO 定义为该种动物的低氧的描述可能更为合理。由于鲍对生活条件的要求较为苛刻,要求的水质较清新,因此其对低氧较敏感[13-15],如南非鲍(H.midae)在溶解氧为6.4 mg/L(远高于2 mg/L)时就出现了低氧胁迫的现象[13]。低氧胁迫是导致鲍夏季大量死亡的主要原因之一[6,16-17]。
本文从低氧胁迫对鲍的生长、存活、生理生化指标(包括心率、代谢、酶的活性、pH 等)、免疫机能、胁迫响应基因及其表达调控等方面的影响综述了鲍低氧胁迫响应机制的研究进展,并据此提出了相应的预防调控措施,以期为进一步研究鲍的低氧胁迫响应机制、开展鲍耐低氧新品种的选育、预防鲍因夏季低氧胁迫而诱发的大规模死亡现象的发生等提供参考。
1 低氧胁迫对鲍生理生化指标的影响
1.1 低氧胁迫对鲍生长、存活的影响
作为需氧生物,鲍受低氧胁迫的影响显著。低氧胁迫不仅会使鲍的生长和代谢减缓,还会使其抗病力和存活率降低,严重时甚至还会引起鲍的大量死亡。现将部分报道过的低氧胁迫下鲍的反应的研究结果总结于表1。

表1 低氧胁迫下鲍的反应Tab.1 The response of abalone under hypoxia stress
另外,有报道指出,在同样的温度下,皱纹盘鲍(H.discus hannai)的96 h 半数致死溶解氧(96 hour-median lethal concentration of dissolved oxygen,96 h-LC50)为4.82 mg/L,而绿盘鲍[H.discus hannai(♀) ×H.fulgens(♂)]的96 h-LC50为3.18 mg/L,可见绿盘鲍在同样的低氧胁迫下的存活率比皱纹盘鲍的高,表现出了杂种优势[19-20]。皱纹盘鲍的幼鲍(壳长2.2 cm)和1 龄鲍(壳长5.9 cm)出现明显胁迫反应时的DO 分别为2.5 和2.0 mg/L;出现死亡率激增时的DO 分别为2.0 和1.5 mg/L;开始出现大量死亡的时间分别为实验开始后的第12~16 和第6 小时[21]。南非鲍幼鲍(壳长4.1 cm)对低氧胁迫的耐受能力比成鲍(壳长6.5 cm)强[22]。上述研究表明,不同种类的鲍对低氧胁迫的耐受能力不同,即使是同种类但规格不同的鲍,其对低氧胁迫的耐受能力也不同。就出现明显的胁迫反应和死亡率激增时的DO 而言,幼鲍对低氧胁迫的反应较成鲍敏感,但就开始出现大量死亡的时间而言,幼鲍对低氧胁迫的耐受能力比成鲍强。鲍对低氧胁迫的耐受能力除了与DO 的高低、鲍的品种和规格有关外,还与胁迫持续时间的长短、投喂的食物种类和鲍的饥饿程度、盐度、温度和养殖密度的高低等有关。在同样的低氧胁迫下,胁迫持续的时间越长,其死亡率越高[23-24]。食物的种类和鲍的饥饿程度会显著影响鲍的耐低氧胁迫能力[25]。盐度越低,鲍的LC50越高,其耐低氧胁迫的能力越差[26]。温度越高,低氧胁迫对鲍的致死效应越强,鲍对低氧胁迫的耐受能力越弱[20]。我们在养殖海区的调查中发现,养殖密度越高,海区DO 的下降速率越快,鲍的死亡就越快越多。这与魏姗姗等[21]报道的高密度组的DO 的下降速率更快、鲍的死亡更快基本一致。
1.2 低氧胁迫对鲍心率的影响
心率的变化是衡量机体应对外环境变化的一项重要生理指标。在低氧胁迫下,随DO 的降低,鲍的心率呈先升高后降低的变化趋势,利用线性回归对其心率拐点前后的两条趋势直线进行拟合,求出交点,即为阿伦尼乌斯拐点溶氧量(Arrhenius break-point of dissolved oxygen,ABDO),其可作为衡量鲍对低氧胁迫耐受能力的一个重要指标[19]。鲍的ABDO 越低,表明其耐受低氧胁迫的能力越强。反之,其耐受低氧胁迫的能力则越弱[19]。鲍的ABDO 的高低与温度、品种等因素有关。鲍的ABDO 随温度的升高而升高[27]。不同种类的鲍的ABDO 不同。如不同的温度(20、25 和28 °C)下,皱纹盘鲍的ABDO 均比绿盘鲍高,表明绿盘鲍通过调节心率的变化以应对低氧胁迫的能力比皱纹盘鲍的强[19]。此外,也有研究表明,杂交鲍[2 个三元杂交鲍日本大鲍(H.gigantea)雌鲍与皱纹盘鲍H.discus hannai♀ × 绿鲍H.fulgens♂杂交雄鲍的三元杂交鲍,皱纹盘鲍H.discus hannai♀ × 绿鲍H.fulgens♂杂交雌鲍与日本大鲍(H.gigantea)雄鲍的三元杂交鲍]在耐低氧胁迫、耐高温胁迫、生长表现等方面均显示出了杂种优势[28]。
1.3 低氧胁迫对鲍代谢的影响
当低氧胁迫时,鲍除了可通过调节心率的变化外,还可通过提高氧气的输送能力、改变代谢的强度和途径等措施来适应低氧胁迫的环境。
低氧胁迫对鲍呼吸和排泄的影响 呼吸和排泄是动物基本的新陈代谢过程。多数动物经过长期的进化已形成可通过改变体内的生理生化反应来适应低氧胁迫的机制。加快呼吸来获得更多的氧气是其中的一条途径。当低氧胁迫程度较轻时,多数动物会通过加快呼吸来摄取足够的氧气以满足自身的需求,但当低氧胁迫程度较为严重,机体不能通过加快呼吸来满足自身的需求时,就会启动其他的调控机制,如降低代谢的强度(代谢抑制)或改变代谢的途径等来适应低氧胁迫。若低氧胁迫超过动物的耐受能力就会导致动物的死亡。由于呼吸代谢主要通过消耗O2,产生CO2和能量,所以耗氧率是呼吸代谢的重要指标,通过测定耗氧率可了解动物的呼吸代谢情况。在低氧胁迫的初期,动物的耗氧率会升高,此阶段主要依靠有氧呼吸,即主要通过加快呼吸等途径来满足机体对氧气和能量的需求,但随着低氧胁迫的持续,其耗氧率就会大幅降低,此时机体主要通过降低其代谢率或进行无氧代谢等途径来适应外部环境的变化。即在低氧胁迫下,动物的耗氧率呈先升高后降低的变化趋势。动物先通过增加氧气供给来维持能量代谢,随后通过降低能量代谢来减少氧气的消耗[10,29]。
影响鲍耗氧率的因素有品种、温度、体重(个体大小)、DO 等。有研究表明,在同样的低氧胁迫下,不同种类的鲍的耗氧率不同,但它们的耗氧率在一定的温度范围内均随温度的升高而升高[19-20,30]。如在急性的低氧胁迫下,皱纹盘鲍的耗氧率显著低于绿盘鲍的耗氧率;皱纹盘鲍和绿盘鲍在28 °C 的急性低氧胁迫下的耗氧率均比它们在25 °C 下的高[19-20]。绿黑鲍[H.rubra(♀) ×H.laevigata(♂)]在低氧胁迫下的最大耗氧率的稳定性比其亲本的强,表明其对低氧胁迫的适应能力比其亲本的强[30]。也有研究表明,同种类、不同规格的鲍在同样的低氧胁迫下的耗氧率也不同,耗氧率随个体的长大或体重的增加而降低。如壳长4.1 cm 的南非鲍在低氧胁迫下的耗氧率显著高于壳长为6.5 cm 的南非鲍的耗氧率[22]。而在耗氧率与DO 关系的研究方面,有报道指出,绿唇鲍幼鲍(壳长4.4 cm)的耗氧率随DO 的降低而降低[14],这与DO 高时鲍的耗氧率较高的报道[20,23]基本一致,其原因可能与绿唇鲍在低氧胁迫下通过降低其耗氧率来延长其存活的时间有关[14]。但在极端的低氧胁迫下,耗氧率的降低会引起鳃的病理学变化,如引起绿唇鲍幼鲍鳃的坏死和黏液细胞结构的变化[31],而这些病理学的改变可能会导致氧气在鳃中的扩散受阻,从而引起鲍的死亡[14]。也有报道指出,南非鲍的耗氧率受发育阶段的影响显著,而不受DO 的影响[22]。如在长时间(1 个月)的低氧胁迫下,南非鲍幼鲍(壳长4.1 cm)的耗氧率比成鲍(壳长6.5 cm)的高,但南非鲍的幼鲍和成鲍在长时间的低氧胁迫下依然能调节它们的耗氧率,其原因可能是低氧胁迫的程度不够苛刻或是虽低氧胁迫会对机体造成损伤,但损伤的程度却不够严重,未达到阻碍气体交换的程度[22];而在短期(7 d)的低氧胁迫下,大个体的南非鲍(体重80 g)在胁迫后的第1 天表现出典型的逃逸反应,第2~4 天则进入低代谢期,此后其耗氧率逐渐恢复到正常水平,而幼鲍在此实验中则没有观察到此现象[32]。
氨、尿素、组氨等是鲍的主要排泄物,其中氨占很大部分。在单位时间内氨氮的排放量即为排氨率。作为研究贝类的生理活动和能量代谢的重要参数,排氨率不仅可体现鲍自身的代谢等生理状况,还可体现外界环境对鲍新陈代谢的影响。如在正常的DO 的情况下,南非鲍的幼鲍(壳长4.1 cm)与成鲍(壳长6.5 cm)的排氨率相似,但在低氧胁迫的情况下,幼鲍和成鲍的排氨率则呈现不同的反应,幼鲍在低氧胁迫下的排氨率升高[22],其原因可能是在低氧胁迫下,幼鲍的糖的产能效率降低,使得其蛋白质被用于能量代谢,并最终被分解成CO2和NH4+,从而导致幼鲍的排氨率升高,而其产生的能量则被用以补偿机体的体能,以克服低氧胁迫不利因素的影响。此推测可从低氧胁迫下幼鲍的呼吸底物的氧氮比(O/N)值的明显降低得到印证:在正常的情况下,南非鲍幼鲍的O/N 值为179.22,成鲍为114.8,而在低氧胁迫的情况下,南非鲍幼鲍的O/N 值则为18.75,成鲍的则为138.17[22]。另外,低氧胁迫对鲍的氨基酸代谢的影响较大,而对碳水化合物和脂质代谢的影响程度相对较小的报道[33]也印证了这一点。同时可见,鲍的个体越大(体重或壳长越大),其排氨率越低。由此推测,由于幼鲍在低氧胁迫下的代谢率、耗氧率和排氨率均较高,因此其对低氧胁迫也较敏感。这也为南非鲍的幼鲍和成鲍适应低氧胁迫的机制可能有所不同提供了佐证。种类、规格均相同的鲍在不同的DO 下的排氨率也不同。如皱纹盘鲍幼鲍的排氨率在DO 为2.5 mg/L 的低氧胁迫下的第1、2、3、4 个月时均出现显著降低,而在DO 为4 和8 mg/L 的情况下,则未出现显著变化。可见,鲍的排氨率高度依赖于DO 的高低。同时推断可能是由于皱纹盘鲍幼鲍的代谢率在低氧胁迫下显著降低,从而使其排泄物的产量减少[23]。总之,排氨率除了与DO 的高低有关外,还与品种、发育阶段等有关。
低氧胁迫对鲍能量代谢的影响 能量是生命活动的重要动力,而离子泵、大分子生物合成、蛋白质降解及糖异生等过程则是生命活动中消耗ATP 的主要过程。在正常的情况下,机体通过以O2为最终电子受体的有氧代谢来提供生命活动所需的全部能量,但当遭到严重的低氧胁迫或长时间的低氧胁迫,其有氧代谢会受到抑制,导致其能量供应不足时,机体会采取改变代谢的强度或途径等措施来使自身适应外部的环境,如由有氧代谢转向依靠以有机酸为最终电子受体的无氧代谢来为其提供能量,在此过程中,有机酸被还原生成甲酸(methanoic acid)、乙酸(acetic acid)、乳酸(lactate)、琥珀酸(succinic acid)、章鱼碱(octopine)等,并释放能量以合成ATP (图1)。
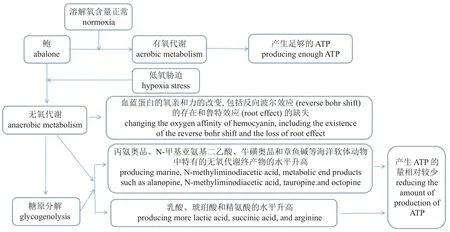
图1 鲍常氧与低氧条件下的能量代谢示意图Fig.1 Diagram of energy metabolism of abalone under normoxia and hypoxia conditions
有报道指出,无脊椎动物在低氧胁迫期间的能量主要由磷酸原分解和无氧代谢途径负责提供[34]。通常使用的初级磷酸原有磷酸精氨酸(phosphate arginine,PA)[35]和磷酸肌酸(phosphate creatine,PC)[33]等。但这种通过磷酸原分解来获得能量的补充所持续的时间是短暂的。随DO 的进一步降低,线粒体呼吸随之变缓,ATP 的产量也随之减少,无氧代谢途径被激活以对抗能量和氧化还原(NADH: NAD+)的失衡。在长时间的低氧胁迫期间,大部分的ATP 是由糖酵解途径中的磷酸甘油酸激酶(phosphoglycerate kinase,PGK)和丙酮酸激酶(pyruvate kinase,PK)所催化的反应产生的,但这必须在细胞质烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)保持在一定的水平才可能发生,因为在糖酵解途径中需要NAD+作为载体将脱氢产生的H+俘获,才可使磷酸甘油酸激酶和丙酮酸激酶能够催化二磷酸腺苷(adenosine diphosphate,ADP)的磷酸化,合成ATP。在低氧胁迫下,终产物为乳酸的葡萄糖-乳酸途径(glucose-lactate pathway),终产物为丙氨奥品(alanopine)、N-羟甲基-L-丙氨酸(strombine)、牛磺奥品(tauropine)或章鱼碱的葡萄糖-冠瘿碱途径(glucose-opine pathway),和终产物分别为琥珀酸和丙酸盐(propionate),丙氨酸(alanine)、琥珀酸和丙酸盐的葡萄糖/天冬氨酸-琥珀酸途径(glucose/aspartate-succinate pathway)这3 个互补的糖酵解途径参与了低氧胁迫下鲍的NAD+的恢复[33]。如在葡萄糖-冠瘿碱途径中,主要以丙酮酸(pyruvic acid)+[精氨酸(arginine)、甘氨酸(glycine)、丙氨酸、牛磺酸(taurine)等其中的一种]+NADH+H+为底物,在相应脱氢酶(dehydrogenase,DH)的催化下,分别生成(章鱼碱、N-羟甲基-L-丙氨酸、丙氨奥品、牛磺奥品)+NAD++H2O。在无氧代谢的过程中,会有大量的丙酮酸产生并被转化为乳酸,而辅酶(coenzyme)则被释放,以允许糖酵解的继续进行[9,33]。类似的,有报道指出,功能性和环境性的低氧胁迫均会导致南非鲍的产能不足和代谢失衡,由此造成的能量的不足则由储备的磷酸精氨酸来补偿[36]。即磷酸精氨酸+Mg2+-ADP+H+在精氨酸激酶(arginine kinase,AK)的催化下生成精氨酸+Mg2+-ATP,从而对不足的能量进行补偿。这种最初反应产生的能量随后被无氧糖酵解产生的能量所补充;在此过程中,葡萄糖先被转化为丙酮酸盐,然后再被转化为作为进一步产生ATP 的底物的乳酸盐或冠瘿碱,同时产生NAD+,以补充逐渐减少的NAD+。低氧胁迫后,南非鲍的丙氨奥品、N-甲基亚氨基二乙酸、牛磺奥品和章鱼碱等海洋软体动物中特有的无氧代谢的终产物的水平随着南非鲍的乳酸、琥珀酸和精氨酸等含量的升高而升高[33]。
腺苷酸能量荷(adenylate energy charge,AEC)是ATP 浓度和1/2 ADP 浓度之和与总腺苷酸浓度的比值,即AEC=(ATP+0.5×[ADP])/(ATP+ADP+AMP),系生物在应激状态下代谢状况的指标[37]。当生物的AEC 值为0.8~0.9 时,表示其处于正常的代谢状态或表示该生物的代谢处于“非胁迫”状态;当生物的AEC 值低于0.5 时,表示其处于生理崩溃或细胞死亡的状态[38]。精氨酸激酶催化磷酸精氨酸与二磷酸腺苷(ADP)形成三磷酸腺苷(ATP)之间的可逆交换,其活性的改变会使生物的AEC 值发生变化。氧化磷酸化的解耦器—五氯苯酚(pentachlorophenol,PCP)和细胞色素C 氧化酶抑制剂—叠氮化钠(sodium azide,NaN3),系化学低氧诱导剂可令被处理的生物产生低氧胁迫。Shofer 等[39]评估了在低氧胁迫下和PCP、NaN3暴露下红鲍(H.rufescens)中的精氨酸激酶的活性,发现ATP 形成的正向反应方向的伪一阶速率常数(pseudo-first order rate constants,Kfor)的增加与ATP 浓度的降低呈负相关。Kfor和磷酸精氨酸的浓度收敛于一个共同的值,这似乎表明低氧胁迫和PCP、NaN3暴露这3 种胁迫在抑制红鲍线粒体ATP 的合成方面具有同样的效果。此外,Shofer 等[40]比较了在低氧胁迫下和PCP、NaN3暴露下通过高效液相色谱(high performance liquid chromatography,HPLC)测定的AEC 值和使用精氨酸激酶平衡反应和体内31P-NMR (nuclear magnetic resonance,NMR)测定的游离二磷酸腺苷的浓度,发现在短期的低氧胁迫下和恢复期间,红鲍的AEC 值与对照组的基本相同,说明短期的低氧胁迫对红鲍ATP 供应的影响不大。相反的,游离ADP 的理论浓度约为通过高效液相色谱法测定值的三分之一,为应激暴露反应时的近2 倍。说明红鲍在短期的低氧胁迫下可通过精氨酸激酶增加ATP 的形成。精氨酸激酶的活性在低氧胁迫期间升高,且在恢复水流后的第1 小时达到峰值,表明在低氧胁迫期间和恢复的初始阶段,鲍对通过磷酸精氨酸水解产生ATP 的需求量增加[41]。可见,在低氧胁迫的初期和恢复的初始阶段,主要是通过水解ATP 来提供能量。这也印证了磷酸精氨酸可作为鲍的即时能量释放的初级磷酸原,但通过这种方式获得初始能量补充所持续的时间是短暂的。
有报道指出,在低氧胁迫开始后的前6 h 内,片层鲍(H.lamellosa)的闭壳肌和足肌的能量主要由精氨酸磷酸盐和糖原与天冬氨酸的共同分解来提供,牛磺奥品和D-乳酸则分别是闭壳肌和足肌中的无氧能量代谢的最主要终产物。这种模式与这两类肌肉的酶谱以及相应酶—牛磺奥品脱氢酶(tauropine dehydrogenase,TDH)和D-乳酸脱氢酶(D-lactate dehydrogenase,D-LDH)的平衡常数是一致的。鲍在常氧的海水中恢复,可逆转低氧胁迫期间出现的大部分的代谢变化,但如同在其他软体动物中观察到的,高能磷酸盐(快)和糖酵解最终产物(慢)完成逆转所需的时间不同[42]。另外,虽然通过牛磺奥品脱氢酶所催化的反应来增强糖酵解和维持氧化还原平衡是闭壳肌运动的主要产能代谢途径,但其并非足肌的主要产能代谢途径[42]。也有报道指出,在功能性的低氧胁迫下,南非鲍的代谢仍能产生足够的能量以维持一定的能量平衡,这可能与其组织间的相互作用使其能够调整能量的需求有关[43]。也有研究发现,低氧胁迫会导致南非鲍以牺牲其生长为代价,而将可利用的能量转移至那些对机体生存至关重要的代谢途径中使用[36]。但同时研究也发现,生长速率相对较快的个体可通过提高胰岛素的产率,利用相应的产能通路和储备的能量来促进蛋白质的合成[36]。由此可见,低氧胁迫会对组织的能量供给产生影响,无氧能量代谢存在组织特异性的原因,可能与不同组织对能量的需求不同有关。此外,研究也发现,改良的人工鲍饲料会激活幼鲍的线粒体功能,使其分解脯氨酸产生能量,而在成鲍中,脯氨酸则主要通过β-氧化途径以提高其产能的量。一般而言,在常氧的情况下,鲍代谢产生的能量可用于蛋白质的合成和个体的生长,而在低氧胁迫的情况下这个过程会被抑制,但一些个体在相同的低氧胁迫的条件下却可更迅速地利用储备的氨基酸来合成蛋白质,其机制仍然是有争议和值得研究的问题[36]。
糖类不仅是鲍细胞的重要组成成分,同时也是鲍体内重要的能源物质,为机体的活动提供能量。糖原的含量往往被用于表示机体的营养状态,其可以反映出鲍在胁迫时的生理状态。在低氧胁迫下,糖原会被分解成葡萄糖,进入糖的分解代谢途径,将能量转化成ATP 进而为机体供能。有报道指出,低氧胁迫后皱纹盘鲍和绿盘鲍肝胰腺中的糖原的含量变化显著,其中糖原的含量在复氧处理进行至第10 小时时最低,在复氧处理进行至第20 小时时最高,说明糖原仍然是低氧胁迫后恢复期间主要的能量供应来源[44]。在低氧胁迫下,鲍的能量代谢由以糖类为底物的代谢向以蛋白质或氨基酸为底物的代谢转化,表明低氧胁迫促使鲍改变了能量代谢的途径[44]。但也有报道指出,在低氧胁迫和过氧胁迫(溶解氧为120%的饱和度处于过饱和状态)下,南非鲍血淋巴中葡萄糖的浓度、肌肉蛋白和鳃蛋白的含量均没有发生显著的变化[22]。这两个报道差异的原因可能是由不同养殖品种的鲍的耐低氧胁迫能力不同造成的,也有可能与实验方法的不同有关,具体还需要进一步的研究来加以厘清。
此外,一般认为,供氧不足会导致鞭毛活动或精子活动所需的能量供应不足,造成精子的活力降低,进而对精子与卵子的相互作用产生负面的影响。但目前有关低氧胁迫对鲍受精成功与否的影响的研究很少,且现有的在红鲍中的研究却发现低氧胁迫对鲍受精成功与否的影响不明显。这可能与鲍的物种特异性有关,也可能与海水pH 对鲍受精成功与否的影响比低氧胁迫对其受精成功与否的影响大有关[45]。鲍的正常繁殖对自然种群的维持和苗种生产均具有重要意义,低氧胁迫对繁殖有重要影响且在其他物种已有许多报道[10,29],因此亟需在鲍中开展更多的研究。
低氧胁迫对鲍氧运输的影响 血蓝蛋白(hemocyanin,Hc)是鲍血淋巴中可溶性蛋白的重要组成部分,除了具有和血红蛋白类似的运输氧气的功能外,还具有免疫、渗透压调节等其他生理功能。有报道指出,低氧胁迫下的无氧代谢除了会增加乳酸等的产生外,也会提高鲍血蓝蛋白的氧亲和力[18],从而在为鲍提供能量的同时也提高其运输氧的能力。Caldero´n-Lie´vanos 等[46]观察到,绿鲍的血蓝蛋白的浓度在低氧胁迫下显著升高,而在高温胁迫和高温低氧联合胁迫下则显著地降低。恢复期过后,低氧胁迫下鲍的血蓝蛋白的浓度依然进一步升高,而联合胁迫下鲍的血蓝蛋白的浓度则依然进一步降低。在高温胁迫下,绿鲍血蓝蛋白浓度的降低可能与其快速而显著的代谢活动的增加和随之而来的对产能分子需求的增加有关。有趣的是,同样的代谢活动的增加在高温胁迫下因需要更多的氧气会触发更高的呼吸频率,并降低最丰富的呼吸色素(the most abundant respiratory pigment)的浓度以满足机体对快速供能的需求。这种补偿机制似乎与软体动物通过增加血蓝蛋白的合成,以增强其在低氧胁迫下的摄氧能力的补偿机制是矛盾的。Caldero´n-Lie´vanos等[46]由此推测,在高温胁迫下,血蓝蛋白的最佳用途可能是提供能量。而在高温低氧联合胁迫下,血蓝蛋白的浓度也下降,与其在高温胁迫下发生的情况相似,这表明把血蓝蛋白作为能量来源来使用是鲍在高温胁迫和高温低氧联合胁迫下的主要补偿机制。Tylor 等[47-48]报道黑足鲍(H.iris)通过调节功能不同的左右鳃的血淋巴流量(改变O2分压),如增强左鳃的滤水作用,吸收更多的氧气来对低氧胁迫做出快速响应。这一过程,加上鲍的开放循环系统的工作方式,导致鲍中的血蓝蛋白的浓度增加可能是血淋巴数量增加的结果,而不一定是血蓝蛋白合成增加的结果,在应激条件下这样的情况更加明显。Behrens 等[49]研究了二价阳离子和无氧代谢终产物浓度以及这些物质和pH 对新西兰黑足鲍的血蓝蛋白氧结合(Hc-O2)的交互作用。结果表明,反复干扰和短期暴露于空气中3 h 并未导致血淋巴中乳酸的积累,而血淋巴中的Ca2+、Mg2+、pH 和O2的结合特性也没有变化。也有研究指出,在同样的低氧胁迫和复氧处理的条件下,血蓝蛋白浓度的变化趋势在不同种类的鲍中是不同的[44]。如在同样的低氧胁迫或复氧处理的条件下,皱纹盘鲍血淋巴中的血蓝蛋白的浓度未见显著变化,而绿盘鲍血淋巴中的血蓝蛋白的浓度则下降了22.05%。绿盘鲍血淋巴中的血蓝蛋白的浓度在复氧处理10 和20 h 后仍保持着较低的水平[44]。这与皱纹盘鲍的耗氧率随溶解氧的降低而缓慢降低,绿盘鲍的耗氧率随溶解氧的降低而迅速降低相对应[20]。由此推测,绿盘鲍是通过降低代谢耗氧率、减少能耗的策略来维持生存的,而不是通过增加血蓝蛋白的浓度及增加氧耗和能耗的策略来维持生存的[44]。此外,有研究指出,血蓝蛋白的浓度受发育阶段的影响,无论在低氧胁迫、过氧胁迫还是在常氧的条件下,南非鲍成鲍中的血蓝蛋白的浓度均显著高于幼鲍,且血蓝蛋白的浓度是高度变化的[22]。可见,在低氧胁迫下,血蓝蛋白的浓度在同种类、不同规格的鲍中也是不同的,其变化趋势异常复杂,其对低氧胁迫的响应机制还需更多的研究加以厘清。
低氧胁迫对鲍代谢速率的影响 在低氧胁迫下,鲍除了会通过改变能量的供应方式和提高氧气的运输能力外,可能还会采取一些如代谢抑制等途径来抑制ATP 的消耗,以延长其存活的时间。鲁特效应(Root effect)指当血液中二氧化碳的分压升高时,氧结合蛋白如血红蛋白或血蓝蛋白对氧的亲和力下降,而且氧结合蛋白的氧容量也下降的现象。需氧可延展性(aerobic expansibility)指动物在运动时的最大耗氧率与其静息时的耗氧率的比值,又称代谢当量(metabolic equivalent,MET),其高低反映机体供氧能力和运动机能的强弱。一些鲍的活体运输采用干露(鲍离水后用湿布覆盖)的方法进行。低氧胁迫是干露的鲍所面临的主要胁迫之一。
Baldwin 等[50]发现,热带鲍耳鲍(H.asinina)的血氧输送系统与温带鲍的相似,如在血淋巴的数量、血蓝蛋白的浓度和大多数血蓝蛋白与氧结合的特性等方面均相似,然而鲁特效应的缺失似乎仅与耳鲍的血蓝蛋白有关,以协助耳鲍的血蓝蛋白在功能性或环境性的低氧胁迫期间血淋巴pH 下降时对氧的摄取。另外,耳鲍在干露期间的氧摄取量比其在充气海水中静息时的摄取量减少20 倍以上,但其足肌和闭壳肌中却无明显的无氧糖酵解或磷酸根水解产生ATP 的现象发生。这种代谢的减慢可能有助于其应对大多数温带鲍常常遇到的低DO 下难以应对的胁迫。研究还发现,虽然耳鲍在水中的爬行速度并不特别快,但在低于其最大爬行速度20%的情况下,其需氧可延展性为5.5,比报道的几种温带鲍的需氧可延展性高出2.7 倍以上[50]。一般认为,耳鲍长时间快速运动的特殊能力是由其具有更高的有氧代谢率的能力决定的,而不是由通过增强肌肉的无氧代谢的能力来决定的。然而,出乎意料的是,在与有氧代谢产生ATP 相关的血氧输送系统或肌肉明显的代谢调节中,耳鲍的需氧可延展性并未出现明显的异常。Baldwin 等[50]由此推测,血蓝蛋白鲁特效应的缺失以及有氧代谢和无氧代谢的降低可能是帮助耳鲍在环境性的低氧胁迫下延长其运动和生存时间的特殊机制。该机制的遗传机理值得进行进一步的研究,以期为鲍耐低氧胁迫机制的研究和鲍耐低氧新品种的培育提供新思路。
低氧胁迫对鲍的影响的代谢组学分析Alfaro 等[51]采用基于非靶向GC-MS (gas chromatography-mass spectrometer,GC-MS)的代谢组学方法来检测黑足鲍在2 d 的干露运输和随即放回养殖池水(再浸泡) 2 d 后的代谢产物的变化,发现运输后鲍的血淋巴和肌肉中的许多代谢物发生了与低氧胁迫有关的变化,如有些氨基酸因被用于产能代谢以应对鲍在运输过程中代谢和应激反应所需要的较高的能量需求而导致其浓度降低;而有些氨基酸则由于氧化应激和细胞凋亡引起的主动渗透调节和(或)蛋白的降解而造成其浓度的升高。另外,由干露导致的低氧胁迫引起机体的代谢从有氧代谢到无氧代谢的转变是造成柠檬酸循环中间产物和无氧代谢最终产物积累的重要原因。有趣的是,再浸泡的鲍的代谢物谱中的一些特征与运输前鲍的特征相似,表明再浸泡会使鲍在水中逐步得到恢复。而再浸泡后,一些应激生物标志物(如乳酸、琥珀酸)的减少则是鲍恢复的证据。这项研究揭示了鲍运输应激的代谢反应,并强调了再浸泡在活体鲍运输供应链中的重要性。
Shen 等[44]从低氧胁迫和复氧处理条件下的皱纹盘鲍和绿盘鲍的足肌中鉴定出384 个差异的代谢中间物或终产物,其包括有机酸及其衍生物(19.79%),有机氧化合物(13.02%),脂类和类脂分子(10.68%),核苷、核苷酸及其类似物(9.64%)等。这些差异代谢物在皱纹盘鲍和绿盘鲍中均可分为4 簇,但是它们在各簇的代谢物的数量是不同的。这些代谢物的京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes,KEGG)富集结果表明,每簇都富集在碳水化合物和氨基酸代谢相关的通路上。可见,碳水化合物代谢和氨基酸代谢在鲍响应低氧胁迫和复氧处理的过程中发挥着重要的作用。加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)也显示了相似的结果。结果表明,与鲍的种类、酚氧化酶的活性、糖原的含量、丙酮酸激酶的活性、己糖激酶(hexokinase,HK)的活性等表型相关的代谢物都显著地富集在氨基酸代谢、氨基酰-tRNA 生物合成、烟酸和烟酰胺代谢等通路。另外,虽然Shen 等[44]获得的差异代谢物的数量比Venter 等[33]在南非鲍中检测到的少。但二者均检测到牛磺酸、柠檬酸、琥珀酸、乳酸、谷氨酸、谷氨酰胺、L-肉碱、乙酰肉碱等重要的差异代谢产物。
在低氧胁迫下,糖酵解和相关碳水化合物的代谢途径在生物需要进行无氧代谢时发挥着重要的作用,它们会使养殖动物的糖原异生、磷酸化碳水化合物和糖基代谢产物增多[33,52]。Shen 等[44]发现在低氧胁迫下,鲍细胞中的柠檬酸的含量升高、苹果酸的含量降低,推测其原因可能是由线粒体呼吸被抑制、柠檬酸循环被中断等所造成的。这与Alfaro 等[51]报道的由干露导致的低氧胁迫引起机体的代谢从有氧代谢到无氧代谢的转变是造成柠檬酸循环中间产物和无氧代谢最终产物积累的重要原因基本吻合。当碳代谢提供的能量不足以满足鲍维持生理活动的需求时,蛋白质和氨基酸的分解代谢作用开始显现。根据发挥连接柠檬酸循环和氨基酸代谢的桥梁作用的谷氨酸的含量在低氧胁迫和复氧处理的条件下显著增加,结合苹果酸和琥珀酸的含量降低,推测在低氧胁迫和复氧处理的条件下,鲍的氨基酸生物合成与碳水化合物生物合成之间的可逆反应存在着偏倚[44]。此外,研究还发现,L-谷氨酸、2-羟基丁酸和2-甲基-3-羟基丁酸有可能作为一种生物标志物以区分鲍所经历的溶解氧的变化[44]。相比之下,谷氨酸的胺化产物谷氨酰胺减少,说明谷氨酸的胺化减弱或谷氨酰胺被用于嘌呤代谢等其他生物学过程[44]。Shen 等[44]认为在水中溶解氧波动的胁迫下,鲍的营养物质在不同代谢途径的利用方式会发生改变,从而使鲍对低氧胁迫表现出物种特异性的代谢适应。这可能与物种的遗传特性和其对环境因素的适应能力不同有关。
研究表明,不同种类的鲍的相同组织对低氧胁迫的代谢反应不同[44]。如在皱纹盘鲍足部肌肉中,分别有11 和16 个显著差异表达的代谢物存在于低氧胁迫组与对照组、复氧处理组与对照组之间,这些差异表达的代谢物的量有近一半是增加的,另一半则是减少的。而在绿盘鲍足部肌肉中分别有28 和28 个显著差异的代谢物。值得注意的是,绿盘鲍足部肌肉中的差异的代谢物在低氧胁迫与复氧处理条件下的数量均比皱纹盘鲍的多。皱纹盘鲍低氧组与常氧组、绿盘鲍低氧组与常氧组中共有的差异代谢物有3 个,分别为乙酰肉碱、硫酸吲哚酚、L-苹果酸;而皱纹盘鲍复氧组与常氧组、绿盘鲍复氧组与常氧组中共有的差异代谢物有5 个,分别为硫酸吲哚酚、L-谷氨酸、L-苹果酸、牛磺酸、葫芦巴碱。硫酸吲哚酚和L-苹果酸是它们共有的差异代谢物。在低氧胁迫下,绿盘鲍肌肉中的代谢谱分析结果提示其在信号转导、感觉系统、膜转运、排泄系统和氨基酸代谢等方面具有比皱纹盘鲍更高的调节能力。而在复氧处理的条件下,绿盘鲍肌肉中的代谢谱分析结果提示其在信号转导、核苷酸代谢、神经系统、排泄系统和氨基酸代谢方面也表现出具有比皱纹盘鲍更高的调节能力。所有的差异代谢都与丙氨酸、天冬氨酸和谷氨酸的代谢、柠檬酸循环(TCA 循环)、嘌呤的代谢和丙酮酸的代谢相关。可见,在低氧胁迫和复氧处理的条件下,绿盘鲍在信号转导、氨基酸代谢、排泄等生物学过程中的调节能力均比皱纹盘鲍的强,表现出了杂种优势。同种类的鲍的不同组织对低氧胁迫的代谢反应也不同。如低氧胁迫后,南非鲍闭壳肌的代谢变化比其足部肌肉、左右鳃、血淋巴、上皮触手等组织中的代谢变化都大。这可能与它们的代谢活动(与左右鳃相比)和它们与环境的接近程度有关。即肌肉积累的代谢物(通过血淋巴)运送到鳃和上皮触手组织,在那里接触氧气使代谢物进一步地被分解或排泄到环境中[33]。另外,Venter 等[43]也指出南非鲍的不同组织对功能性的低氧胁迫表现出的代谢反应也不同,闭壳肌和鳃均发生了很大的代谢反应,其中尤以闭壳肌的代谢变化最为剧烈,这可能与闭壳肌是其主要的运动器官有关。Behrens 等[49]报道在环境性的低氧胁迫期间(24 h),虽然黑足鲍的足肌和闭壳肌以及主动脉、踏板窦和闭壳肌空隙的血淋巴中均积累了D-乳酸和牛磺酸。肌肉和血淋巴中的D-乳酸浓度相同,但相对于血淋巴,肌肉中的牛磺酸浓度更高。还有研究表明,高温低氧联合胁迫会诱发鲍发生性别特异性、时间特异性和组织特异性的代谢反应。如高温低氧联合胁迫后,天冬酰胺、苏氨酸的浓度在雄性杂色鲍(H.diversicolor)的肌肉中升高,而在雌性杂色鲍的肌肉中却降低;甘氨酸、蛋氨酸和乳酸的浓度升高,琥珀酸和葫芦巴碱的浓度降低仅在雄鲍中出现,而牛磺酸的浓度升高,赖氨酸和尿苷二磷酸葡糖的浓度降低,仅在雌鲍中出现;高温低氧联合胁迫96 h 后杂色鲍的雌鲍和雄鲍的肌肉和鳃组织中的代谢变化比胁迫24 h 后的代谢变化更显著;杂色鲍的鳃比肌肉更容易受高温低氧胁迫的影响;高温低氧联合胁迫不仅会影响鲍的肌肉和鳃组织的能量代谢和渗透平衡,而且还会影响其核苷酸的代谢和免疫能力[53]。
1.4 低氧胁迫对鲍细胞内pH 的影响
细胞膜上的通道蛋白、转运蛋白以及信号通路蛋白等成分会因pH 的剧烈变化而失去正常的功能,致使细胞的选择性透过功能丧失,细胞内外的钠钾离子失衡。此外,强碱或强酸也会中和碱性或酸性蛋白质的功能基团,使其发生降解,造成不可逆的破坏。另外,pH 也会影响血蓝蛋白与氧的亲和力。可见,pH 在细胞形态和功能的维护等方面均发挥着重要的作用。目前已有很多学者进行低氧胁迫对鲍细胞内pH 的影响的研究。如Tjeerdema 等[54]报道将暂养后的红鲍干露(低氧胁迫) 1 h,然后浸浴海水2.5 h 恢复后,发现干露前鲍足肌细胞内的pH 为7.5~7.6,而在干露1 h 后,细胞内的pH 迅速地降低,达到最大的酸化(pH为7.0~7.2),重新浸浴后,细胞内的pH 总体上都恢复至正常水平。Tjeerdema 等[55]研究了由干露导致的低氧胁迫与PCP 暴露这2 种胁迫在红鲍体内的相互作用。他们在鲍适应清洁的海水后,先将鲍置于PCP 半数致死浓度(1.2 mg/L) 6 h,再将它们浸浴在清洁的海水中2 h,然后再干露45 min,最后再浸浴于清洁的海水中15 h 以便检查鲍的恢复情况,发现在PCP 暴露下,鲍细胞内的pH 会降低,再干露后,细胞内的pH 则迅速地进一步降低,但再浸浴于清洁的海水15 h 后其就恢复到接近初始的水平。可见,由干露导致的低氧胁迫和半数致死浓度的PCP 暴露这2 个因素间的生化相互作用具协同效应。随后他们又将另外的3 只鲍暴露于120 μg/L 的PCP 中6 h,然后干露1 h,再浸浴于同样浓度的PCP 中 2.5 h,再检查其恢复情况,发现在较低的浓度下(半数致死浓度的十分之一),PCP 暴露未对鲍产生明显的胁迫效应。可见,由干露导致的低氧胁迫和低浓度的PCP 暴露这2 个因素间的生化相互作用不具有协同效应。
Caldero´n-Lie´vanos 等[56]的研究结果表明,绿鲍幼鲍在高温胁迫期间的可溶性蛋白的含量和pH 均降低,渗透压升高;恢复期过后,其可溶性蛋白的含量和pH 均恢复至基线水平。在低氧胁迫下,绿鲍幼鲍的渗透压显著升高,pH 显著降低,但是恢复期过后,其可溶性蛋白的含量和pH 均显著地增加。在高温低氧联合胁迫下,绿鲍幼鲍的渗透压显著地升高,pH 显著地降低,但是恢复期过后只有pH 恢复至基线水平。渗透压在上述所有的情况下,恢复期过后都没有恢复。在高温胁迫和低氧胁迫各自单独反复的作用下,绿鲍幼鲍的可溶性蛋白的含量、渗透压、葡萄糖的含量及pH 均未见显著变化。然而,在高温低氧联合胁迫的反复作用下,其可溶性蛋白的含量和葡萄糖的含量均增加,pH 显著降低。恢复期过后,所有的生化组成的含量均恢复到基线水平,但pH比对照组的高,由此推测细胞内的pH 随无氧呼吸代谢的持续而降低。这可能是由于在胁迫期间随着呼吸的增加,二氧化碳的产量也随之增加,最终引起碳酸(H2CO3)的增加,造成pH 降低。1904 年丹麦科学家Christian Bohr 发现血液pH 值的降低或二氧化碳分压(pCO2)的升高使血红蛋白对O2的亲和力降低,血红蛋白的氧饱和度降低,氧离曲线右移,反之,pH 值的升高或pCO2的降低,则使血红蛋白对O2的亲和力增加,血红蛋白氧饱和度增加,氧离曲线左移。pH 对血红蛋白氧亲和力的这种影响被称为波尔效应(Bohr shift)。但在低氧胁迫下,一些鲍血淋巴pH 的降低却增加了血蓝蛋白与氧的亲和力,即反向波尔效应(reverse Bohr shift)[50,57],这种氧亲和力的增加有助于鲍在低氧环境下提高其摄氧的效率,从而保证鲍具有一定量的氧供给以应对胁迫[56]。另外,也有报道指出,在长时间的无氧代谢过程中,乳酸合成率最终会超过其清除率,导致细胞内pH 值降低[58],这反过来又进一步限制了长时间的低氧胁迫下ATP 的产生。南非鲍通过产生丙氨酸和冠瘿碱以提高细胞的部分缓冲能力,防止由pH 过低造成的酸化休克的现象出现[33]。也有学者持不同的观点,如Shofer 等[59-60]报道在整个低氧胁迫期和恢复期红鲍细胞内的pH 均未见显著的变化。这些结果的不同可能与实验方法的不同有关,具体还需要进一步的研究来加以厘清。
1.5 低氧胁迫对鲍几种酶的活性的影响
低氧胁迫对抗氧化酶和髓过氧化物酶(myeloperoxidase,MPO)的活性的影响 虽然在线粒体正常呼吸的过程中会有少量的超氧阴离子(O2-·)、过氧化氢(H2O2)、单线态氧(1O2)、羟基自由基(·OH)等活性氧物质(reactive oxygen species,ROS)的产生,但当遇到低氧胁迫时,这些ROS 的产量会显著增多。为避免过多的活性氧物质对机体造成损伤,我们在杂色鲍的工作[61-62]证明与其他物种类似,鲍在长期的进化中形成了一套复杂的自我保护系统,其中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、依赖硒的谷胱甘肽过氧化物酶(selenium dependant glutathione peroxidase,SeGPx)等酶作为抗氧化系统中的关键酶,能够有效地清除鲍代谢活动中产生的过多的ROS,保护体内的生物大分子免受ROS 的氧化损伤。有报道指出,在低氧胁迫的初期,盘鲍鳃中的MnSOD、CAT、SeGPx、硫氧还蛋白过氧化物酶(thioredoxin peroxidase,TPx)基因的表达水平均升高[63]。DO 由7.5 mg/L降至4.5 mg/L 的前6 h 内,九孔鲍的CAT 的活性显著地升高,随后恢复至接近正常的水平;当DO 由4.5 mg/L 降至2.5 mg/L 时,九孔鲍的CAT活性显著升高,并在第12 小时达到最高值,随后逐渐下降并在第108 小时降至正常水平[15]。这些研究表明,在低氧胁迫下,鲍可通过提高自身的SOD、CAT 等的活性来清除因低氧胁迫而产生的过多的ROS,从而使机体得到有效的保护。但当低氧胁迫产生的ROS 超过鲍的抗氧化能力时,就会导致其血细胞中的DNA 损伤加重,最终引起机体的损伤甚至死亡。如皱纹盘鲍幼鲍在DO 为2.5 mg/L 的低氧胁迫进行的第1 个月内,其体内的丙二醛(malondialdehyde,MDA)的含量显著升高,表明在低氧胁迫的早期,鲍体内有ROS 产生,随后发生脂质过氧化,但1 个月后,MDA 就恢复到正常的水平。相反地,鲍体内的谷胱甘肽(glutathione,GSH)含量则在低氧胁迫进行至第1、2、3、4 个月时均显著降低;CAT 的活性虽然在低氧胁迫进行至第1 个月时显著升高,但是在低氧胁迫进行至第2、3、4 个月时,其活性显著地降低,表明在低氧胁迫持续的第1 个月内,皱纹盘鲍幼鲍努力地维持其内稳态,以应对低氧胁迫引发的氧化应激,然而,由于氧化应激的严重程度取决于低氧胁迫的程度和持续时间的长短,当低氧胁迫持续的时间超过1 个月时,皱纹盘鲍幼鲍最终未能恢复其氧化稳态。同样的,SOD 的活性在低氧胁迫进行至第3、第4 个月时也显著降低[23]。可见,长时间的低氧胁迫会使鲍的抗氧化免疫机能受到抑制,进而引起鲍的损伤。此外,也有报道指出,南非鲍的GPx 活性受低氧胁迫的影响显著,而SOD 和CAT 的活性则受发育阶段的影响显著。在相同的低氧胁迫下,南非鲍幼鲍(壳长4.1 cm)的SOD 的活性极显著高于成鲍(壳长6.5 cm)的SOD 的活性[22],这可能与前述的南非鲍幼鲍的耐低氧胁迫的能力比成鲍的强有关。
另外,作为氧化酶,MPO 能将H2O2与Cl-催化生成HOCl,可在一定程度上起到保护机体免受H2O2损伤的作用。如DO 由7.5 降至4.5 mg/L,九孔鲍的MPO 活性呈现先升高后降低的变化趋势。类似的,DO 由7.5 降至2.5 mg/L,MPO 的活性呈现先升高并在第24 小时达到最高值,随后降低的变化趋势[15]。可见,在低氧胁迫下,鲍也可通过提高MPO 的活性,将因低氧胁迫诱发呼吸爆发产生的H2O2与Cl-催化生成HOCl,来减轻H2O2对鲍的损伤作用,从而增加其对低氧胁迫的适应能力。
需要指出的是,机体抗氧化系统除了抗氧化酶外,还包括非酶抗氧化分子如热休克蛋白(heat shock protein,HSP)、谷胱甘肽、半胱胺(cysteamine)、硒结合蛋白(selenium binding protein,SBP)、铁蛋白(ferritin,Fer)、维生素E (Vitamin E,Ve)、维生素C (Vc)、一氧化氮(nitric oxide,NO)、β 胡萝卜素(β-carotene)、左旋肉碱(L-carnitine)、丙酮酸、牛磺酸等。遗憾的是,除了本文述及的谷胱甘肽[23]、牛磺酸[33,44,53],以及我们[64-67]报道过的杂色鲍和Vosloo 等[22]报道过的南非鲍的热休克蛋白外,鲍的其他非酶抗氧化分子在低氧胁迫下的反应尚未见报道,需进一步研究。
低氧胁迫对鲍溶菌酶(lysozyme,LZ)、酚氧化酶(phenoloxidase,PO)的活性的影响溶菌酶是鲍免疫系统中的重要成分,是一种能水解致病菌黏多糖的碱性酶。研究表明,在DO 为2.5 mg/L 的低氧胁迫下,皱纹盘鲍幼鲍的LZ 活性显著降低[23],这暗示着鲍抗病力的减弱或许是低氧胁迫诱导的抗应激能力降低的结果,由此推测,低氧胁迫会通过削弱鲍的先天免疫力,诱发鲍疾病的暴发。酚氧化酶在鲍的非特异性免疫中发挥着识别异物、阻止异物的入侵等作用。PO 活性的高低与鲍的免疫力的强弱有关。Cheng 等[68]报道在DO 为3.57 和2.05 mg/L 的低氧胁迫进行至第24 小时时,九孔鲍的PO 的活性分别显著地升高了38%和69%。也有研究表明,鲍的种类、低氧胁迫或复氧处理及其相互作用均会对PO 的活性产生显著影响。如在正常的DO 下,皱纹盘鲍血淋巴中的PO 的活性比绿盘鲍的高。皱纹盘鲍血淋巴中的PO 的活性在低氧胁迫期间没有显著的变化,在复氧处理的条件下则显著降低,下降了39.13%~79.87%,而绿盘鲍则呈现不同的结果,其血淋巴中的PO 的活性在低氧胁迫、复氧处理10 h、复氧处理15 h 后持续升高了53.18%~87.05%,但在复氧处理20 h 后就恢复到正常组的水平[44]。由此可见,不同种类的鲍的免疫力不同,在低氧胁迫下,绿盘鲍可通过提高自身的免疫力来增加其抵抗环境应激的能力,此时其杂种优势就显得更为突出。
低氧胁迫对鲍乳酸脱氢酶、己糖激酶和丙酮酸激酶活性的影响 氧气波动(低氧和复氧重复出现)胁迫会对鲍的生理状态和能量代谢产生影响。在机体的糖代谢过程中,乳酸脱氢酶、己糖激酶和丙酮酸激酶都参与了催化反应。虽然乳酸脱氢酶不是糖酵解过程中的限速酶,但是其在机体的所有组织的细胞质中均有存在,因此,其常被用于衡量机体的无氧代谢的能力。有报道指出,鲍足肌中的乳酸脱氢酶的活性在低氧胁迫和复氧处理的条件下均没有受到显著的影响,但其活性受鲍种类的影响显著,如皱纹盘鲍足肌中的乳酸脱氢酶的活性总体上比绿盘鲍的低[44];而己糖激酶和丙酮酸激酶则为糖酵解过程中的两个关键的限速酶;己糖激酶是第一限速酶,其功能是使己糖磷酸化,产生能量;丙酮酸激酶的功能则是催化磷酸烯醇式丙酮酸和ADP 生成ATP 和丙酮酸。所以,己糖激酶和丙酮酸激酶的活性常被用于衡量机体的有氧代谢能力。研究发现,皱纹盘鲍足肌中的己糖激酶的活性在复氧处理进行至第10 小时时最高,并随着恢复时间的持续而逐渐降低,而绿盘鲍足肌中的己糖激酶的活性则没有显著的变化。在常氧条件下,皱纹盘鲍中的己糖激酶的活性比绿盘鲍中的高;在低氧胁迫和复氧处理的条件下,皱纹盘鲍足肌中的丙酮酸激酶的活性呈先降低后升高的变化趋势,而绿盘鲍足肌中的丙酮酸激酶的活性则呈先升高后降低的变化趋势,说明在糖酵解的过程中,皱纹盘鲍足肌中的丙酮酸激酶的活性被低氧胁迫抑制,而绿盘鲍足肌中的丙酮酸激酶的活性则被诱导[44]。不同种类的鲍的己糖激酶、丙酮酸激酶在应对低氧胁迫时有不同反应的原因,或是与不同种类的鲍以不同的策略来应对低氧胁迫有关,即皱纹盘鲍倾向于顺应(submissive),而绿盘鲍则是更积极地自我保护(active self-protectors)[44],具体的遗传机制尚需进行更深入的研究。
低氧胁迫对鲍肉质的影响 如前所述,目前活鲍的运输一般都采用密闭的保温箱进行干露运输,若运输时间长,鲍也会因干露导致的低氧胁迫等产生一定的应激反应,从而使其体内的几种相关酶如丙酮酸激酶、乳酸脱氢酶等的活性受到影响,而由此产生的丙酮酸、乳酸等代谢物会引起鲍肉质的变化,有时甚至会引起鲍的死亡。对暴露于不同的干露时间和干露温度下的皱纹盘鲍血液中的丙酮酸盐和乳酸盐的含量进行检测,发现血液中的丙酮酸的含量随着由干露导致的低氧胁迫的持续呈逐渐降低的趋势,在湿度为74%~76% RH (相对湿度,relative humidity)、温度为15 °C 的条件下,其含量在低氧胁迫进行至第36 小时时达到最低值,而乳酸的含量则随着由干露导致的低氧胁迫的持续呈逐渐升高的趋势,并在低氧胁迫进行至第36 小时时达到最高值,再经过24 h 的恢复后,乳酸的含量有所降低。说明血液中丙酮酸盐的含量降低和乳酸盐的含量升高可作为判断鲍在活体运输中是否发生应激乃至肉质改变的依据[69]。
2 低氧胁迫对鲍细胞免疫机能的影响
低氧胁迫下,有氧呼吸受到抑制,线粒体转为依靠产生ATP 效率远远不如有氧呼吸且会造成乳酸积累的糖酵解途径来提供能量,但往往因能量的供应不足,致使鲍机体的免疫力降低,导致其易受病原的入侵,从而出现大规模的死亡。
血细胞一个重要功能就是给需氧组织输送氧气。当胁迫对机体造成伤害时,首先表现为对血细胞造成不利的影响,严重时甚至造成血细胞的死亡;而血细胞的吞噬作用、包囊作用、呼吸爆发产生的活性氧物质的杀伤作用等则是鲍的主要免疫途径。血细胞的状况可反映出胁迫对鲍的免疫系统的破坏程度,血细胞总数(total hemocytes count,THC)、血细胞死亡率、血细胞吞噬活力、呼吸爆发、血细胞活性氧水平和抗菌清除效率等还是反映贝类细胞免疫防御能力变化的主要指标。研究表明,在一定程度的低氧胁迫下,鲍的细胞免疫会受到严重的影响,表现为鲍的血细胞总数、血细胞死亡率、血细胞吞噬活力、呼吸爆发、血细胞活性氧水平和抗菌清除效率均发生显著的变化[15,19,68]。规格相近的鲍在同样的低氧胁迫的条件下,不同种类的鲍、不同的低氧胁迫时间,鲍的THC 和血细胞死亡率的差异分别呈显著和极显著。如在DO 为3.59 mg/L 的低氧胁迫下,皱纹盘鲍和绿盘鲍的THC 和血细胞死亡率的差异均显著,它们各自在不同的低氧胁迫时间的THC 和血细胞死亡率的差异也显著。它们的THC 的变化趋势均呈随低氧胁迫的持续,THC 先减少,然后缓慢地增加,并分别在低氧胁迫进行至第48 和24 小时达到最高值,然后再迅速减少的变化趋势。绿盘鲍的THC 在总体上比皱纹盘鲍的多,但是皱纹盘鲍的THC 在低氧胁迫下表现相对稳定。皱纹盘鲍和绿盘鲍的血细胞死亡率的差异极显著,它们各自在不同的低氧胁迫时间的血细胞死亡率的差异也极显著。随低氧胁迫的持续,皱纹盘鲍和绿盘鲍的血细胞死亡率均呈先缓慢升高,然后缓慢降低,但在第96 h 时又快速升高的变化趋势。其原因可能是在低氧胁迫的初期,血细胞出现小部分的死亡,随后有新的血细胞缓慢生成,但是随着胁迫的持续,低氧胁迫对血细胞的致死作用越来越大,所以在低氧胁迫进行至第96 小时,血细胞死亡率又迅速升高。绿盘鲍的血细胞死亡率总体上比皱纹盘鲍的高,但是二者的变化幅度相当[19]。在同样的低氧胁迫下,不同种类的鲍的血细胞吞噬活性和活性氧水平的差异不显著,但是它们各自在不同的低氧胁迫时间的血细胞的吞噬活性和活性氧水平的差异显著。如皱纹盘鲍和绿盘鲍的活性氧水平均呈先升高后降低的变化趋势,但是它们的变化强度不一样,ROS 最高值分别在低氧胁迫的第3 和第6 小时,绿盘鲍的ROS 值比皱纹盘鲍的高,皱纹盘鲍属于“弱响应”,而绿盘鲍属于“强响应”。它们的血细胞的吞噬活性在低氧胁迫期间的变化趋势不同,皱纹盘鲍的血细胞的吞噬活性随低氧胁迫的持续呈先缓慢降低,然后缓慢上升的趋势,而绿盘鲍总体上则呈迅速上升的趋势,但是两种鲍的差异不显著[19]。
有研究表明,同种类的鲍的THC、血细胞吞噬活性、呼吸爆发、抗菌清除率在不同的低氧胁迫下,大部分都呈下降的趋势,但DO 越低,其对鲍的THC、血细胞吞噬活性、呼吸爆发、抗菌清除率的影响越大[15,68]。如在DO 为 2.53 和4.51 mg/L 的低氧胁迫下,九孔鲍的THC 总体上随胁迫的持续而减少,并在低氧胁迫进行至第12 小时时出现明显的减少;血细胞吞噬活性和呼吸爆发在低氧胁迫进行至第24 小时时产生明显的下降;而抗菌清除率则在胁迫进行至第12~24 和第48~72 小时这两段时间内下降较明显。在DO 为2.53 mg/L 的低氧胁迫下的THC、血细胞吞噬活性、呼吸爆发、抗菌清除率的降低量均比在DO 为4.51 mg/L 的低氧胁迫下的降低量大[15]。皱纹盘鲍幼鲍长时间在DO 为2.5 mg/L 的低氧胁迫下,其THC 显著减少,抗细菌的能力显著降低,而在DO 为4 和8 mg/L 的情况下,其THC 均未见显著减少[23]。在低氧胁迫下,鲍的THC、血细胞吞噬活性、呼吸爆发、抗菌清除率的减少或下降可能是造成鲍免疫力降低的原因。
此外,有报道指出,皱纹盘鲍在温度为5 和10 °C 的条件下干露30 h 后,其THC 显著降低;在温度为20 °C 的条件下干露24 h 后,其THC 也显著降低。在温度为5 和10 °C 的条件下,其血细胞死亡率和ROS 均随着由干露导致的低氧胁迫的持续呈逐渐升高的趋势,并在胁迫进行至第30小时达到最高值。再经过24 h 的恢复期后,其血细胞的死亡率和ROS 均有所降低,但仍然比对照组的高[69]。因此,一般认为在鲍的运输过程中应提供充足的氧气,以增强其免疫和存活能力,从而降低运输损耗。然而,也有研究表明,鲍先经过冷水刺激,然后保存在一定的湿度环境下,其成活率可显著提高,而在这种情况下氧气的供给对鲍的存活率无显著影响。另外,随着干露时间的延长,鲍的体重损失率显著升高[69]。也有报道指出,杂色鲍在空气中干露6 h,再湿润保持12 h 后,其血细胞总数显著减少,吞噬活性显著降低,细胞DNA 的损伤水平显著升高[70]。
3 低氧胁迫对鲍基因表达的影响
低氧胁迫对鲍的生理生化、免疫机能等方面产生的影响与其对鲍相关基因的表达产生的影响密切相关。为了适应低氧胁迫环境,鲍会对一些与缺氧诱导、抗氧化、调控细胞凋亡、能量代谢、免疫等相关的基因的表达进行调控。
3.1 低氧胁迫对鲍缺氧诱导因子(hypoxia inducible factor,HIF)及其靶基因表达的影响
当细胞遇到低氧胁迫时,会启动自身一系列的分子调控机制,来应对低氧胁迫造成的危害。HIF 信号通路就是首先启动的一种参与低氧胁迫反应的免疫防御机制。在低氧胁迫下,HIF-1α 的羟基化被抑制,从而使HIF-1α 不被蛋白酶体降解,而得到积累,进而从细胞质中被转运到细胞核中,并与HIF-1β 结合成异二聚体。此异二聚体与p300/环腺苷酸反应元件结合蛋白(p300 and cyclic AMP response element-binding protein,p300/CBP)结合形成具有转录活性的复合体,复合体与目标基因的启动子或增强子序列的缺氧反应元件(hypoxia response element,HRE)结合,从而启动靶基因的转录[71](图2)。我们的研究[72-74]发现,在低氧胁迫及高温低氧联合胁迫下,与对照组的相比,杂色鲍的缺氧诱导因子-1α 基因(HIF-1α)的表达水平在多个时间点均显著升高,尤其是鳃组织中的HIF-1α的表达水平在胁迫进行至第4 小时时就出现了显著的升高,说明HIF 信号通路被迅速启动;同时还观察到HIF-1α的下游靶基因,如硒结合蛋白-1 (SBP1)基因、一氧化氮合酶(nitric oxide synthase,NOS)基因与肿瘤坏死因子-α (tumor necrosis factor α,TNF-α)基因的表达水平也随之在不同的时相中有不同程度的显著升高。表明HIF 信号通路及其靶基因在杂色鲍的低氧胁迫响应中发挥着极其重要的先导作用。
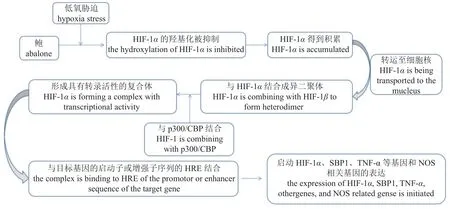
图2 低氧胁迫对鲍缺氧诱导因子及其靶基因的影响Fig.2 Effects of hypoxia stress on hypoxia-inducible factors and their target genes
缺氧诱导因子-1α (HIF-1α)是调节氧依赖性内稳态的关键转录因子。Kim 等[75]报道皱纹盘鲍多个组织中的HIF-1α在低氧胁迫下均被诱导表达,其中尤以鳃组织中的HIF-1α的反应最迅速,这可能与氧气主要是通过鳃进入机体,即鳃是鲍的重要呼吸器官有关。在常氧的情况下,皱纹盘鲍HIF-1α的组织依赖性转录调控模式分别与HSP90和金属硫蛋白基因(metallothionein,MT)的转录调控模式密切相关并相互交织以应对热胁迫和重金属暴露。在常氧的条件下,HIF-1α的表达在响应脂多糖(lipopolysaccharide,LPS)和哈维氏弧菌(Vibrio harveyi)的感染时均被显著上调,其在鲍血细胞中的表达水平最高。这可能与鲍主要依靠血细胞的吞噬、呼吸爆发产生的活性氧等来发挥免疫功能有关。然而,低氧胁迫和弧菌感染的联合处理对HIF-1α的诱导表达没有协同作用。总之,HIF-1α 对氧依赖和氧非依赖胁迫的组织特异性动态转录调控表明,HIF-1α 在低氧胁迫响应和先天免疫之间的相互关联的交互作用中发挥着重要作用,可为研究低氧胁迫和其他相关应激因子对养殖鲍的细胞和生理的反应提供有用的基础知识。
3.2 低氧胁迫对鲍抗氧化系统基因表达的影响
如前所述,由SOD、CAT、SeGPx、TPx、硫氧还蛋白-2 (thioredoxin-2,TRx-2)等组成的抗氧化系统在鲍抵御低氧胁迫时发挥着重要的作用。研究表明,当低氧胁迫时,虽然同是抗氧化酶基因,但是不同类型的抗氧化酶基因的表达存在差异。如在低氧胁迫下,盘鲍鳃组织中的MnSOD、CAT、TPx和SeGPx的表达水平均升高,而CuZnSOD和TRx-2 的表达水平却未见升高[63]。由此可见,鲍抗氧化系统中的不同基因对低氧胁迫存在不同的响应机制,即使是同种基因,但类型不同,其响应机制也不同。此外,研究还发现,低氧胁迫时,鲍的鳃处于氧化应激状态,这可能与鳃是鲍重要的呼吸器官有关,而在鲍的各种抗氧化酶中,SeGPx在氧化损伤的情况下被诱导表达的水平最高,因此,其可能是一种潜在的生物标志物[63]。
3.3 低氧胁迫对鲍热休克反应基因表达的影响
热休克蛋白是生物体在应对不利环境刺激时启动的一族由热休克基因表达而产生的结构保守的蛋白质,其被用于保护细胞抵御损伤并帮助细胞恢复正常的结构和机能。大量的研究发现,热休克转录因子1 (heat shock transcriptional factor1,HSF1)起着传递细胞胁迫信号的重要作用,其能够与热休克蛋白基因上游的热激应答元件(heat shock response element,HSE)识别和结合,调节热休克蛋白基因的表达,而热休克因子结合蛋白1 (heat shock factor binding protein1,HSBP1)负调控HSF1 的表达。本团队的研究[64-67]发现,杂色鲍的HSF1、HSBP1 和HSP90 的表达受低氧胁迫和高温低氧联合胁迫的影响显著。其中鳃和血淋巴中的HSF1 和HSP90 的表达水平在低氧胁迫和高温低氧联合胁迫下均出现显著升高,而HSBP1的表达水平则显著降低。同样的,杂色鲍的HSP22、HSP26、HSP40、HSP60、HSP70、HSP105 等基因的表达水平在上述相同的胁迫下也出现了不同程度的升高。且在对HSF1 进行干扰抑制时,上述基因的表达都被不同程度的抑制。进一步的,我们还发现杂色鲍的HSP70 和HSP90的上游均有多个HSE。说明鲍的HSP 作用及其表达调控机制与大多数动物类似,在应对低氧胁迫和高温胁迫时均表现出相似的应答反应。有研究指出,HSP70 的表达受发育阶段的影响显著。在过氧胁迫和常氧条件下,南非鲍成鲍中的HSP70与管家基因微管蛋白(α-Tubulin)的比例均显著高于幼鲍。南非鲍成鲍中HSP70 与α-Tubulin在过氧胁迫下的比例较其在低氧胁迫下高[22]。其功能与作用机制是否与南非鲍在不同的发育阶段对低氧的耐受能力不同有关,还需进行深入研究。
3.4 低氧胁迫对鲍调控细胞凋亡相关基因表达的影响
在低氧胁迫下,鲍的部分细胞会出现死亡,为避免细胞的直接坏死(necrosis)对邻近细胞造成更严重的损坏,鲍会启动细胞凋亡(apoptosis)调控机制中的有关基因的表达来保护自己。目前已报道的调控细胞凋亡的相关基因主要有抗细胞凋亡因子(defender against cell death 1,DAD1)基因和Caspase 募集功能域(Caspase recruitment domain,CARD)基因。DAD1 在参与免疫调控和细胞凋亡调控等方面均发挥着重要的作用,尤其是在抗低氧胁迫时,其作用更为突出。有研究发现杂色鲍的DAD1 在低氧胁迫进行至第4 和第96 小时的表达水平显著升高,其原因可能是受低氧胁迫后,鲍通过上调该基因的表达来调控由低氧胁迫引起的细胞凋亡,使鲍免受不必要的细胞凋亡损伤[76]。CARD 在参与细胞分化、免疫、细胞凋亡调控等方面均有着重要的作用。有研究发现,在低氧胁迫进行至第192 小时,杂色鲍的CARD的表达水平显著升高。其原因可能是受低氧胁迫后,为了防止细胞凋亡对杂色鲍造成更大的危害,杂色鲍通过显著升高CARD的表达来调控细胞的凋亡[77]。其与杂色鲍的DAD1 在应对低氧胁迫时的反应基本一致。由此推测,在低氧胁迫时,杂色鲍可能是通过调节这两种基因或更多种基因的表达来调控细胞的凋亡。
3.5 低氧胁迫对鲍能量代谢相关基因表达的影响
生物体需要能量来维持其必要的代谢过程,尤其是在低氧胁迫等不利的环境下,更需要能量来帮助其摆脱不利因素的影响。呼吸作用产生生物体所需的能量,而线粒体则是细胞呼吸作用产生能量的细胞器,是进行有氧代谢的场所。线粒体对氧气的可用性反应迅速,因为这直接影响其功能状态,进而影响ATP 的产量。因此,与其有关的基因的表达易受低氧胁迫的影响。
细胞色素C 氧化酶(cytochrome C oxidase,COX)是一种线粒体酶复合物,在呼吸作用的最后阶段催化电子从还原的细胞色素C 转移到O2,它在形成电化学梯度以ATP 的形式产生能量方面起着关键作用,并被认为是呼吸速率限制步骤[78]。功能性COX 由13 个亚基组成;最大的亚基1、2和3 构成催化核心,在线粒体中编码和合成;其余10 个亚基由核基因编码[79]。有报道指出,DO和温度会显著影响南非鲍COX1 的表达,而不会显著影响COX2 和COX3 的表达。在98%氧饱和度的胁迫下,COX1 和COX2 的表达水平均随温度的升高而升高。在温度为14 °C 时,82%氧饱和度胁迫下的COX1 的表达水平比其在98%氧饱和度胁迫下的表达水平降低了2.2 倍,而在温度为19 °C 时,82%氧饱和度胁迫下的COX1 的表达水平比其在98%氧饱和度胁迫下的表达降低了4.8倍[13],可见,在同样的低氧胁迫(82%氧饱和度)下,温度越高,COX1 的表达水平降低的越多。这可能与细胞内的低氧胁迫使一氧化二氮处于较低水平从而抑制了COX 的活性有关[80]。而实验处理未对COX3 的表达产生影响[13]。由此推测,在低氧胁迫的初期,南非鲍的幼鲍通过加快其呼吸作用来为机体提供更多的能量;随着胁迫程度的加重,南非鲍通过降低呼吸作用,减少能耗,即通过降低COX1 的表达水平来适应低氧胁迫环境。
除了COX1,紫色酸性磷酸酯酶(purple acid phosphatase,PAP)基因和精氨酸激酶基因的表达也会对低氧胁迫做出反应。PAP 在生物体内磷代谢、能量转化和信号转导等方面均发挥着重要的调控作用。我们[81]发现杂色鲍细胞中的PAP在低氧胁迫进行至第4 小时的表达水平显著地低于对照组,但当胁迫进行至第96 小时,其表达水平显著高于对照组,说明PAP 参与了低氧胁迫调控,但其具体的调控机制有待进一步研究。作为磷酸激酶家族的重要一员,AK 在调节能量代谢、应对不良环境胁迫和机体免疫等方面均发挥着重要的作用。我们的研究[82]发现杂色鲍的鳃和血细胞中的AK在低氧胁迫及高温低氧联合胁迫下的部分时段的表达水平显著高于对照组,由此推测杂色鲍的AK 不但参与能量代谢调节,而且参与了对低氧等不利胁迫的响应。
3.6 低氧胁迫对鲍免疫相关通路及基因表达的影响
低氧胁迫后,鲍的一些免疫相关的通路及基因也发生了显著的变化,以应对不良刺激对机体造成的损伤。作为先天免疫中最重要的信号通路,NF-κB (nuclear factor kappa B,NF-κB)信号通路在鲍抵御病原菌的入侵和外界胁迫中发挥着重要的作用。研究发现,杂色鲍NF-κB 信号通路中的20 多个基因,如髓样细胞分化蛋白88(myeloid differentiation primary response protein 88,MyD88)基因、Toll 样受体2 (toll-like receptor 2,TLR2)基因、TLR4、TLR6、肿瘤坏死因子受体相关因子2(TNF receptor-associated factor 2,TRAF2)基因、TRAF、NF-κB、NF-κB 抑制因子 (NF-kappa-B inhibitor,NκBI)基因、Akirin2、白介素-1 受体相关激酶4 (interleukin-1 receptor-associated kinase 4,IRAK4)基因等在低氧胁迫及高温低氧联合胁迫下的不同时相中的表达水平均有不同程度的显著变化,且这些变化的模式在鲍的血细胞和鳃组织中又有所不同[83-84]。可见,受低氧胁迫后,NF-κB信号通路中的这些相关的基因均参与了鲍对低氧胁迫的免疫防御调节。同时,以上这些基因的差异表达也表明,鲍的血细胞和鳃组织在抵御低氧胁迫等刺激时可能存在着既独立,又互相协同发挥免疫防御功能的不同免疫调节机制。
PI3K-AKT (磷脂酰肌醇3-激酶:phosphatidylinositol-4,5-bisphosphate 3-kinase,PI3K;丝氨酸/苏氨酸蛋白激酶:serine/threonine-protein kinase,AKT)信号通路为细胞内的经典信号通路之一,在鲍应对低氧胁迫时发挥着重要的作用。研究发现在高温胁迫、低氧胁迫和高温低氧联合胁迫下感染弧菌后,杂色鲍的鳃、血细胞和肝胰腺组织中的PI3K、AKT 和PI3K-AKT 信号通路中的其他成员基因的表达水平不仅没有升高,反而出现降低,表明PI3K-AKT 信号通路参与了高温胁迫、低氧胁迫和高温低氧联合胁迫引起的免疫抑制[85]。沈雅威[19]从皱纹盘鲍鳃组织中筛选到PI3K-AKT 信号通路中的多表皮生长因子样结构域蛋白基因(multiple epidermal growth factor-like domains proteins 10,MEG10)、血小板衍生生长因子亚单位A 基因(platelet derived growth factor subunit A,PDGFA)、表皮生长因子受体基因(epithelial growth factor receptor,EGFR)、热休克蛋白基因(HSP90-β)[86]、多表皮生长因子样结构域蛋白11 基因(MEG11)、Toll 样受体蛋白基因(TLR2)等6 个随DO 增/减而差异表达的基因,并结合这些基因的表达水平随低氧胁迫持续时间的变化而变化,沈雅威[19]推测可能是这6 个基因接到外界低氧胁迫的刺激信号后,将该刺激信号通过PI3K-AKT 信号通路传递给HIF 信号通路。但此观点与HIF 通路在低氧反应中起先导作用的观点[71-74]矛盾,需进一步探究。
作为GTP 结合蛋白,脑内富集的Ras 同系物(ras homolog enriched in brain,RHEB)是一个参与雷帕霉素(rapamycin)途径和其他环境胁迫途径,并调节细胞周期进程的重要调控因子。有研究发现,在低氧胁迫及高温低氧联合胁迫下,杂色鲍的鳃和血细胞中的RHEB的表达水平均显著升高,其中鳃组织中的RHEB的表达最早,表明RHEB在杂色鲍的胁迫响应中扮演着重要角色[87]。同种移植炎症因子1 (allograft inflammatory factor 1,AIF-1)是机体先天免疫防御系统中的一个重要因子,在抵御外部环境的刺激时发挥着重要的作用。研究发现,杂色鲍鳃中的AIF-1 在低氧胁迫下的表达水平呈现先显著降低,然后持续至第192 小时再显著升高的变化趋势[88]。由此推测,在低氧胁迫的初期,杂色鲍将鳃中的AIF-1 参与的一些快速调控途径关闭或降低来应对低氧胁迫,但到胁迫的后期,杂色鲍启动了鳃中的AIF-1 的表达来应对低氧胁迫引起的不良反应。而在整个低氧胁迫的过程中,血淋巴中的AIF-1 的表达水平与对照组的基本一致。说明低氧胁迫对血淋巴中的AIF-1 的表达影响不大。故此,认为AIF-1 在杂色鲍的鳃和血细胞中对低氧胁迫的响应机制有所不同;同时研究[88]还发现,杂色鲍的鳃和血淋巴中的AIF-1 对由高温胁迫引起的应激较由低氧胁迫引起的应激敏感。推测AIF-1参与高温胁迫和低氧胁迫的响应机制存在着差异。
金属硫蛋白基因是一种多功能效应因子,在广泛的细胞通路,特别是与发育和应激反应相关的通路中均发挥着重要的作用。有报道指出,在低氧胁迫的过程中,皱纹盘鲍MT的表达水平在早期迅速降低,然后逐渐恢复到常氧对照组的水平,被认为是“初始干扰后功能的恢复”。MT在鲍的鳃、血细胞、肌肉和肝胰腺的表达结果表明,肝胰腺可能是皱纹盘鲍MT 介导的对抗长时间低氧胁迫引起的有害后果的主要器官。此外,鲍的MT的低氧胁迫响应调控可能也涉及MTF-1 (metal regulatory transcription factor 1,MTF-1)和HIF-1α之间的协同作用,因为这两个转录因子的多个结合位点被预测存在于该物种的MT启动子[89]。然而,对MT在低氧胁迫时的组织依赖调控(即仅在肝胰腺中诱导)还知之甚少,有待进一步探索。鲍受低氧胁迫影响的有关基因部分总结于表2。
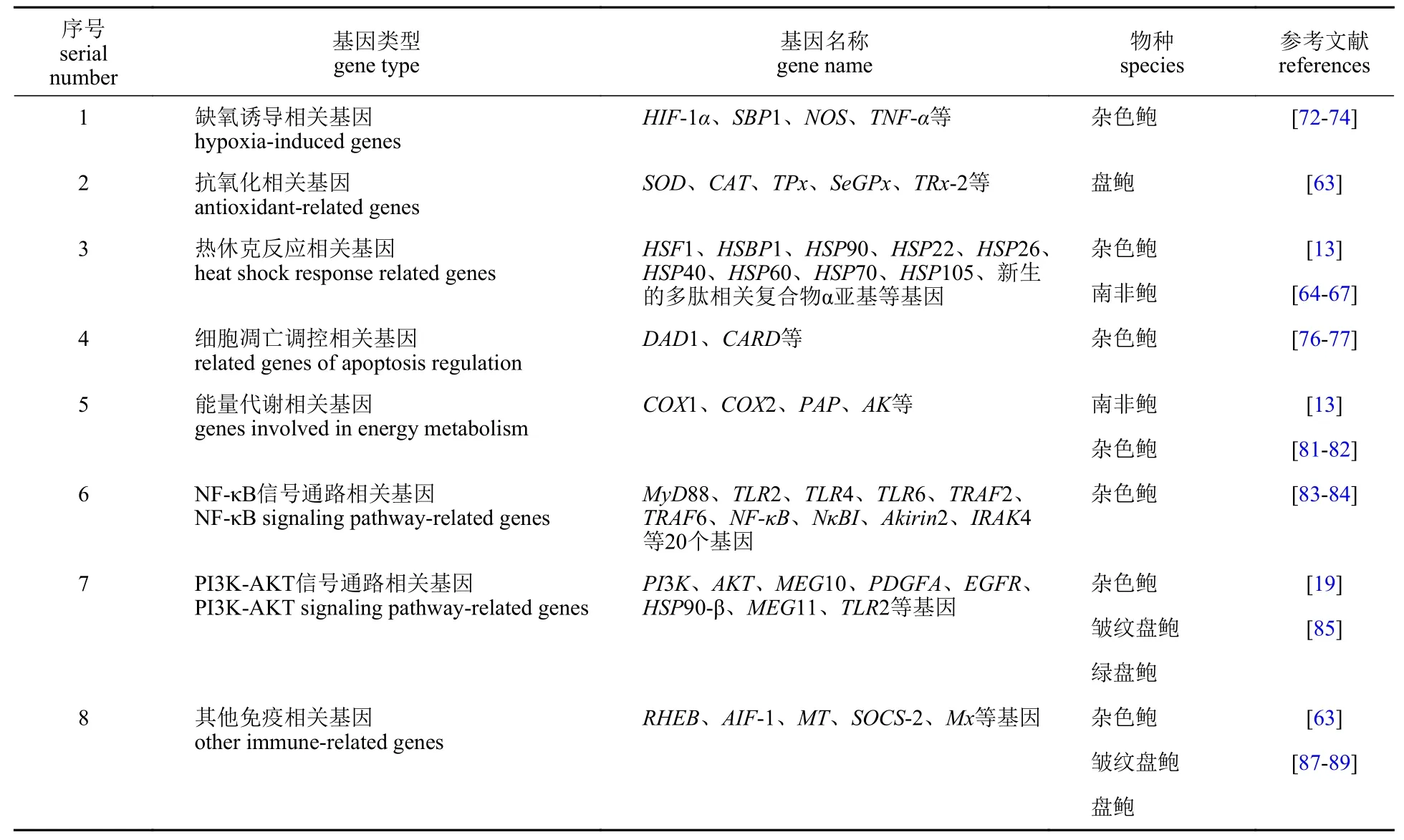
表2 鲍受低氧胁迫影响的有关基因Tab.2 Related genes affected by hypoxia stress in abalones
通过严格控制先天免疫的激活,可使内稳态在免疫防御反应期间得到保持。细胞因子信号抑制因子(suppressor of cytokine signaling,SOCS)正是通过负调控以控制先天免疫中细胞因子的过度激活效应。因此,SOCS 的转录可以作为与免疫激活有关的一个指标[90]。黏液病毒抗性(myxovirus resistance,Mx)是一种干扰素(interferon,IFN)诱导的抗病毒蛋白,其表达与先天免疫的激活有关[91]。研究发现,盘鲍鳃组织中的SOCS-2 和Mx在低盐胁迫和低氧胁迫下均被诱导上调表达。在低氧胁迫开始后的前8 h 内,SOCS-2 和Mx的表达均被显著上调,SOCS-2 的表达呈连续升高的趋势,并在第8 小时达到峰值,然而Mx的表达则呈先升高并在第4 小时达到最高值,随后降低的变化趋势。由此可见,鲍的免疫被激活。与此同时,研究也发现SOCS-2 和Mx的表达受高温胁迫(28 °C)的影响较小。根据应激及其强度的不同,不同的免疫相关基因可能在不同的时间段里被激活,为了抑制这些细胞因子的过度转录,SOCS-2可能会被持续诱导表达。相比之下,像Mx这样的单个细胞因子可能只在特定应激条件下的不同时相中被诱导表达。这可能是SOCS-2 和Mx在特定胁迫下转录谱不同的原因。因此,SOCS-2 和Mx对高温胁迫、低盐胁迫和低氧胁迫的响应调控,可能与先天免疫和促炎反应的诱导有关,是防御机制的一部分[63]。其具体的功能和机制需要进一步研究。
3.7 转录组水平分析鲍对低氧胁迫的响应
转录组是连接基因组遗传信息与生物功能的蛋白质组的桥梁,通过高通量测序,能够全面快速地获得某一物种特定组织或器官在某一状态下的几乎所有转录本序列信息,深入解析机体的生理反应机能。Kim 等[92]报道在应对低氧胁迫时,三倍体的皱纹盘鲍的转录本的数量比二倍体的多,可见三倍体的鲍对低氧胁迫的处理具有快速调节与适应的能力。同时研究发现,在低氧胁迫下,二倍体和三倍体的皱纹盘鲍幼鲍共同的差异表达的转录本(differentially expressed transcripts,DETs)中,有些基因的调控方向是相反的。研究发现,在低氧胁迫及高温低氧联合胁迫下,不同数量的转录本被富集到“免疫系统”亚类中[83]。免疫相关通路富集了toll 样受体信号通路、PI3K-AKT 信号通路和NF-κB 信号通路等。另外,杂色鲍的鳃和血细胞两个组织中的一些相同的基因在应对低氧胁迫时表现出不同的表达模式,表明鳃和血细胞应对低氧胁迫的机制有所不同。沈雅威等[19,24]报道在不同的DO 下,皱纹盘鲍的鳃组织出现954个差异表达的基因和265 个长链非编码RNA (long non-coding RNA,lncRNA)。通过比较发现,随着溶解氧差异的扩大,差异表达的基因的数量增加,在3 个比较组(正常溶解氧组、中度低氧组、低氧组)交叠的部分有18 个差异表达的基因,仅占总差异表达的基因的1.89%,说明不同程度的低氧胁迫可能有助于特定基因的表达。这些差异表达的基因和lncRNA 涉及能量代谢、DNA 合成代谢、细胞凋亡、离子转运、局部黏着、细胞外基质受体相互作用、唾液分泌、蛋白/维生素消化和吸收、病原免疫应激等生物学过程。由此可见,低氧胁迫下,鲍主要通过维持自身有氧代谢、控制能量消耗、提高自身免疫力等来适应环境。De 等[93]试图以红鲍外套膜转录组的多态性来揭示其群体基因流和局部适应模式,发现在1.17×106个单核苷酸多态性 (single nucleotide polymorphisms,SNPs)中(转录组的1.37%),有21 579 个可以对所有个体进行基因分型。这些SNPs 的主成分分析的结果表明,绝大多数SNPs 都没有显示与群体结构有关联,相比之下,经遗传分化指数(finite state transducers,FST)异常值分析,发现有691 个SNPs显示出明显高于预期的分化。通过BLAST 注释,鉴定到163 个基因,其中含有1 个以上的异常的SNPs 的基因有34 个。这些大量参与生物矿化、能量代谢、热耐受性、疾病耐受性、低氧耐受性的基因,是未来可能使鲍增加适应地理多样性的遗传变异的候选位点。
3.8 低氧胁迫对鲍DNA 损伤的影响
研究表明,低氧胁迫会抑制DNA 的修复,影响基因组DNA 的完整性[94]。观察基因组DNA的完整性的方法之一是彗星实验(comet assay),又称单细胞凝胶电泳实验(single cell gel electrophoresis,SCGE)[95-97]。其原理是将细胞及其核膜裂解后,核DNA 解旋,在电场作用下,DNA 由负极向正极迁移。在SCGE 电泳过程中,未受损的细胞的核DNA 因其分子量较大,在电场作用下的迁移距离较短,所以还停留在核基质的范围内,形成圆形的图像;而细胞中发生单链或双链断裂的DNA 在电场的作用下则会形成如彗星拖尾般的图像。彗星尾巴较短,说明DNA 存在单链断裂的现象,因为长链DNA 在琼脂糖凝胶中的移动距离相对较短[95-96],单链断裂的DNA 的修复相对容易,因为完整的DNA 链可以作为模板来指导受损DNA 链的纠正[97]。彗星尾巴较长,则提示着DNA存在双链断裂的现象。双链断裂对细胞来说特别危险,因为两条链都被切断,使损伤更难修复。这种损害会导致实际基因组DNA 的重排,这对动物及其后代的危害更大[98]。
有报道指出,南非鲍的幼鲍和成鲍的基因组DNA 的完整性对DO 变化的反应不同。在低氧胁迫下,南非鲍成鲍的DNA 损伤水平比幼鲍的高。幼鲍DNA 损伤水平在DO 的变化中没有表现出任何变化的原因,可能与其在低氧胁迫下的抗氧化酶如SOD 的活性极显著高于成鲍有关[22],也可能与幼鲍修复DNA 损伤的能力较强有关[99],或者是二者综合作用的结果。成鲍无法预防和/或修复DNA 损伤,这可能是由于随着年龄的增长,修复DNA 损伤的能力下降所造成的,类似的情况在其他物种的研究中已有报道[99-100]。低氧胁迫对鲍DNA 损伤的影响机制及其对鲍种群遗传结构的影响均有重要的生物学、生态学和遗传学意义,目前的研究较少,需要进一步研究。
4 鲍低氧胁迫的预防调控措施
4.1 创造良好的养殖环境,控制合理的养殖密度
依据海域功能规划,清退规划外养殖,合理布局,逐渐向外海深海推进,拓展养殖空间,缓解近海养殖压力,从而使因筏架过密而导致水体交换缓慢的问题得到有效的改善。为减少残饵对水中DO 的影响,一方面应投喂优质的饵料,乃至少投甚至不投饵料,这样既可减少残饵的产生,又可提高鲍的免疫力;另一方面应降低养殖密度,同时开展鲍参生态混养、鲍螺生态混养或“鱼菜共生”(即在鲍养殖海域空出部分海域用于养殖海带等藻类,这样既可增加溶解氧、净化水质,还可为鲍提供新鲜的饵料,降低养殖成本),条件适合的还可在海区底部投放以海洋动物粪便和藻类为食的大型多毛类经济物种如沙蚕等进行多层次综合养殖,以达到减少残饵、保持水流的畅通、增加水中的溶解氧、减少水中的有害因子等目的。最后就是应加强管理,如勤冲洗网笼,保持网笼水流畅通,特别是在高温小潮水时,除了应及时冲洗网笼外,还应减少甚至停止投饵,以此来减少其耗氧量,乃至减少其摄食、食物消化所需能量以应对胁迫。与此同时,若有配备增氧设备则应开启,若没有配备增氧设备的,也可通过开动船只使水体流动起来,从而达到增氧的作用;做好海漂垃圾的收集以预防鲍养殖海区低氧胁迫的发生。而鲍工厂化养殖则应采取加大微孔增氧的力度、加大换水量、增加换水和洗池的次数、及时分苗降低养殖密度等措施来减轻低氧胁迫对养殖鲍的危害程度,在换水、洗池、分苗等的过程中需要注意的是干露的时间不宜过长,以免鲍产生低氧胁迫反应。此外,也应加强日常DO 的监测,发现低氧胁迫时应及时处理。若出现大规模死亡现象,则应将死亡的鲍及时挑出并进行无害化处理,避免死亡的鲍在水中腐败,消耗水中的DO,从而为鲍创造一个良好的生长环境。
4.2 做好防范,避开赤潮
每年的4—10 月是赤潮的多发期。发生赤潮时,除了可采取将吊养的鲍移到潮流畅通的、无赤潮的海区养殖外,也可采取将网笼搬至陆地工厂化水泥池中进行暂养等措施,若是条件不足的或是吊养的鲍笼不可移动的,则应采取将鲍笼下沉等措施,以减少赤潮对鲍的影响。
4.3 养殖优良新品种,把好苗种质量关
传统的鲍养殖品种由于多年来未加选育的近亲繁殖,导致其抗逆性状退化,因此,应积极开展新品种的培育与推广。“大连1 号”杂交鲍、“东优1 号”杂色鲍、绿盘鲍及西盘鲍是目前鲍已通过国审的新品种。在2015—2017 年笔者参与开展的三种鲍(绿盘鲍、西盘鲍、皱纹盘鲍)海区渡夏养殖的比较实验中,绿盘鲍和西盘鲍表现出了生长快、抗病力强、抗高温等优良性状[101]。但目前鲍育种主要关注于其生长性状,亟需开展以抗逆性状为育种目标的新品种选育。
5 展望
鲍在每年的8—9 月极易出现低氧胁迫的现象,这可能与此阶段不仅是潮水最小的月份,也是水温最高的月份有关。在低氧胁迫下,鲍的生理生化会出现异常,导致其生长、发育变缓或停止,严重时甚至还会引起鲍的大量死亡,显然,低氧胁迫已成为阻碍鲍养殖业健康可持续发展的重要外部环境因子,并已引起科研人员的广泛关注。虽然科研人员已经从鲍的生长与存活、代谢和酶的活性等生理生化指标、免疫机能、胁迫响应基因及其表达调控等不同层次探讨了鲍低氧胁迫的响应机制,但由于水中的DO 不仅会对鲍产生影响,也会对水中的pH、氨氮、硫化氢、亚硝酸盐等化学因子的含量产生影响,而水中的这些化学因子含量的多寡也会对鲍产生重大的影响。另外,高温胁迫也会加深低氧胁迫对鲍的影响。在一定的温度范围内,随着温度的升高,鲍的生理活动增加,其需要更多的能量和氧气。另一方面,随着温度的升高,水中的DO 会降低。当鲍的DO 需求量多于水中DO 供应量时,鲍就会产生低氧胁迫反应,其代谢由有氧代谢转为无氧代谢。目前已有很多关于温度和低氧联合作用对鲍影响的报道[102-103],有学者认为低氧胁迫会限制鲍的耐热性能[104],更有人认为低氧胁迫和高温胁迫对鲍的代谢的影响可能存在重叠[34,41,53]。此外,也有学者开展酸化与低氧联合胁迫对红鲍的影响的研究,发现酸化与低氧胁迫对鲍的影响之间有很强的交互作用[105]。因此,下一步还应加强水质中的综合因子对鲍的影响的研究。另一方面,由于环境条件也会对鲍的抗应激能力产生影响,优良的环境有利于提高鲍的抗应激能力,减少养殖鲍死亡的发生,故此,也应进一步加强养殖环境的改善和优化的研究。此外,种质退化也是鲍夏季大量死亡发生的一个重要原因。为了鲍养殖业的绿色健康可持续发展,应加快新品种的选育,尤其是耐低氧新品种的选育。在选育方面除了采用传统的杂交育种等方法外,也应重视新育种技术的选择应用,特别是随着全基因组时代的到来,应积极采用全基因选择育种、基因组编辑等先进技术培育耐低氧的新品种,以促进鲍养殖业的健康可持续发展。
(作者声明本文无实际或潜在的利益冲突)

