单核细胞/淋巴细胞比值与维持性血液透析患者全因死亡的相关性研究
廖家贤,韦东艳,孙承会,韦银霞,阳雨颀,蒙如庆
(广西河池市中医医院肾病科,广西 河池 547000)
维持性血液透析(maintenance hemodialysis,MHD)是终末期肾脏病患者肾脏替代治疗主要方式之一。随着透析技术的不断发展与持续优化,MHD患者的存活时间逐渐延长。然而,即使在发达国家,MHD患者的死亡率仍居高不下,严重影响了患者生活质量。2019年美国肾脏病数据系统(USRDS)资料显示,2017年美国MHD死亡率为16.7%[1]。研究表明[2],30%~50%的MHD患者存在慢性炎症状态。持续的炎症状态可导致多种并发症,尤其是心血管疾病、营养不良和贫血,从而增加MHD患者死亡率[3]。近年来的研究发现血常规检测中不同血细胞成分的比值是新的炎症标志物。单核细胞/淋巴细胞比值(MLR)和血小板/淋巴细胞比值(PLR)已被证实可预测MHD患者全因死亡[4-7]。但目前关于MLR对MHD患者全因死亡预测价值方面的研究较少。因此,本研究拟探讨MLR与MHD患者全因死亡的相关性,以期为临床上早期预测MHD的全因死亡率,改善疾病预后提供一定的指导意见。
1 资料与方法
1.1 一般资料 选取2015年1月至2020年12月在河池市中医医院肾病风湿病科血液净化中心接受MHD治疗的患者。纳入标准:首次透析在本院进行,并在本院长期规律透析治疗;透析方案2~3次/周,3~4小时/次;临床资料完整。排除标准:年龄<18岁;在外院开始血液透析;在本院透析不满3个月或3个月内死亡;肾移植或腹膜透析转血液透析;近期有感染或心脑血管事件、手术、创伤等应激病史;合并恶性肿瘤、血液系统疾病者、自身免疫系统疾病者;近期使用糖皮质激素、免疫抑制剂。本研究通过河池市中医医院伦理委员会审批(审批号:河中医伦审[2020]10号),所有患者均签署知情同意书。
1.2 方法
1.2.1 资料收集 收集患者一般人口学资料和规律透析3个月内的临床及实验室指标作为基线资料。人口学资料包括性别、年龄、原发病、糖尿病史。临床及实验室指标包括体重指数(BMI)、血压、血细胞计数、血红蛋白、白蛋白、血肌酐(Scr)、尿素氮(BUN)、血尿酸、血钙、磷、甲状旁腺激素(iPTH)、总胆固醇、甘油三酯等。MLR即单核细胞/淋巴细胞比值是用血常规中的单核细胞计数除以淋巴细胞计数得到的。
1.2.2 研究终点及分组 采用回顾性队列研究方法,研究的终点事件为全因死亡,未发生终点事件的MHD患者随访至2021年7月31日,根据纳入标准及排除标准,最终有213例患者纳入本研究。根据中位MLR水平将所有患者分为低MLR组(<0.49)和高MLR组(≥0.49),两组患者基线资料见表1。

表1 两组患者基线资料比较
2 结果
2.1 两组患者基线资料比较 本研究共纳入213例MHD患者,年龄为(56.82±14.36)岁,其中男性141例,女性72例。原发病为慢性肾小球肾炎99例,糖尿病肾病61例,梗阻性肾病18例,高血压肾病16例,系统性血管炎9例,狼疮性肾炎2例,其他8例。其中有糖尿病病史者70例(32.86%),心血管疾病史99例(46.48%),主要是冠心病、高血压性心脏病、急性左心衰和慢性心力衰竭。根据中位MLR水平将所有患者分为低MLR组(MLR<0.49,106例)和高MLR组(MLR≥0.49,107例)。两组患者在性别、年龄、透析龄、糖尿病史、血压、血红蛋白、白蛋白、血肌酐、血钙、血磷等指标比较中差异无统计学意义(P>0.05)。与低MLR组患者比较,高MLR组患者的白细胞和C反应蛋白水平更高(P<0.001),低密度脂蛋白更低(P<0.05)。两组患者基线资料比较见表1。在随访过程中共51例患者死亡,死亡患者与非死亡患者相比,两组在性别、透析龄、糖尿病史、血压、血红蛋白、白蛋白、血肌酐、血钙、血磷等指标比较差异无统计学意义(P>0.05),年龄与CVD病史差异有统计学意义(P<0.05),死亡患者平均年龄大,有CVD病史比例高。
2.2 两组患者累积生存率比较 Kaplan-Meier生存曲线分析表明,高MLR组患者的生存率较低MLR组患者更低,log-rank检验χ2=4.390,P=0.036,见图1。
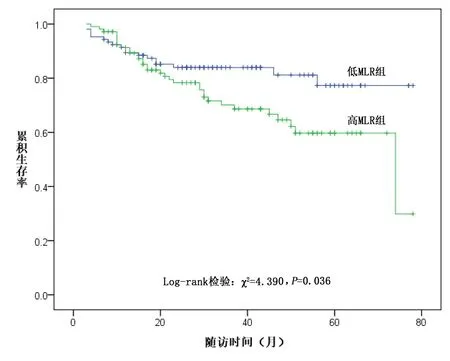
图1 两组患者Kaplan-Meier生存曲线
2.3 血MLR水平与全因死亡的关系 本研究的中位随访时间为30个月,四分位间距17~50个月。在随访过程中共51例患者死亡,全因死亡率为23.94%,其中低MLR组患者死亡率为16.98%(18/106),高MLR组患者死亡率为30.84%(33/107),高MLR组MHD患者的全因死亡率高于低MLR组(χ2=5.617,P=0.018)。可能影响患者全因死亡的单因素Cox回归分析,见表2。多因素Cox回归分析结果提示,经校正多种混杂因素后,高MLR仍是MHD患者全因死亡的危险因素;高MLR组MHD患者的全因死亡率是低MLR组的1.939倍(HR=1.939,P<0.05),见表3。

表2 全因死亡的单因素Cox比例风险回归分析
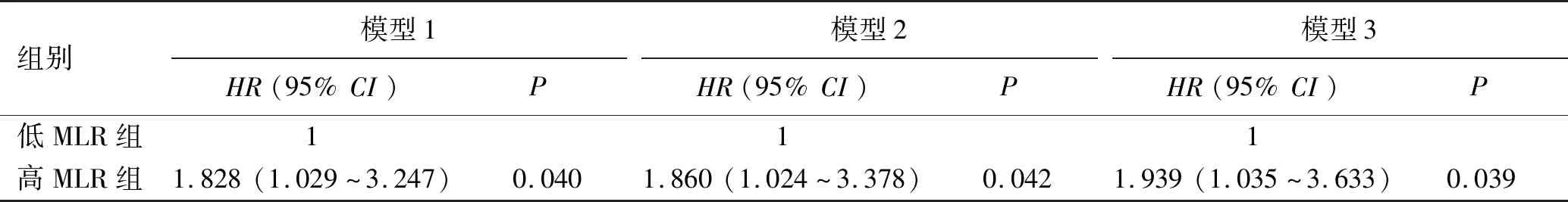
表3 血MLR水平与全因死亡的Cox比例风险回归分析
3 讨论
研究表明[2],30%~50%的MHD患者存在慢性炎症状态。持续性炎症状态不仅包括由外源性或内源机会性病原微生物感染引起的全身炎症反应综合征,更主要的是指微炎症状态。MHD患者慢性炎症反应的原因是多方面的,主要包括透析相关原因和慢性肾衰竭本身原因。透析相关原因与透析膜的生物相容性、透析液纯度及血管通路感染有关。随着肾功能下降,炎性细胞因子清除下降、氧化应激、胰岛素抵抗、晚期糖基化终末产物蓄积等均可促进炎症的发生发展[8]。持续的炎症状态可导致多种并发症,尤其是心血管疾病、营养不良和贫血,从而增加MHD患者死亡率[3]。尽管仅有不到5%的MHD患者直接死于炎症,但炎症可与多种危险因素交互作用,对MHD患者预后有重要影响。研究发现,炎症与心肌肥厚、心室功能障碍、动脉粥样硬化、蛋白质能量消耗、贫血及肾性骨病等死亡高危因素密切相关[9-11]。因此,开发炎症相关指标对于判断MHD患者预后、指导早期干预具有重要临床价值。近年来的研究发现血常规检测中不同血细胞成分的比值是新的炎症标志物,其中NLR、PLR、MLR在慢性肾脏病、心血管疾病等的转归中具有良好预测价值。NEUEN B L等[4]纳入170例MHD患者中位随访37个月发现,MLR是全因死亡及心血管死亡的危险因素。心血管疾病(CVD)是MHD患者死亡的最主要原因。李磊等[12]认为MLR与MHD患者左心室肥厚的发生、发展密切相关,LI H等[13]研究表明较高的MLR可以预测MHD患者脉压差、左心室质量指数和颈动脉内膜中层厚度的增加,并与心血管死亡独立相关。而YAPRAK M等[5]研究结果表明PLR而非MLR与MHD患者全因死亡独立相关。后续研究发现MLR也是MHD患者全因死亡及心血管死亡的独立危险因素,而且比NLR的预测价值更大[14]。本研究进一步证实MLR较高的MHD患者死亡率更高,高MLR水平是MHD患者死亡的独立危险因素。
单核细胞和淋巴细胞计数分别体现了先天免疫和获得性免疫的状态,将二者做比值可综合反映机体的免疫炎症状态。既往研究发现MLR对多种疾病预后具有预测价值。JI H H等[15]研究发现MLR可以预测冠状动脉疾病患者的病变严重程度。在腹膜透析患者中,高MLR水平患者心血管疾病死亡率较高[16]。此外,MLR还与肿瘤[17]、精神疾病[18]、骨关节疾病[19]及妊娠期高血压[20]有关。本研究发现MLR与MHD患者全因死亡相关,拓展了其作为疾病预后评估指标的应用范围。同时MLR是用血常规中的单核细胞计数除以淋巴细胞计数计算而出,临床中易于检测和获得,具有一定的临床实用性。
本研究存在以下局限性,本研究为单中心研究,样本量相对较小;本研究为回顾性研究,因此不能明确MLR与MHD患者全因死亡的因果关系;未能纳入所有可能混杂的因素进行校正;只包括基线数据而不是随访期间的所有数据,这可能会导致结果的偏差。
综上所述,本研究发现较高的MLR水平是MHD患者全因死亡的危险因素,有望成为评估MHD患者死亡风险的新指标。

