石菖蒲对铝致认知功能障碍大鼠学习记忆能力和凋亡基因的影响
贾芸菁,李晨羽,甘珏方,廉春容,李莎莎,刘亚林,刘金培,王旭,凌雁武
(右江民族医学院基础医学院,广西 百色 533000)
铝是一种常见的金属元素,铝的神经毒性特性已经得到很好的证实[1-2]。石菖蒲是一种临床上常用于治疗阿尔兹海默症中草药,具有抗痴呆、抗癫痫、抗炎、抗血栓、抗肿瘤、抗抑郁及提高神经元活性、减少神经元损伤和保护心肌细胞、呼吸系统等广泛的作用[3]。本研究旨通过用石菖蒲干预治疗铝致认知功能障碍的大鼠,检测石菖蒲对大鼠学习记忆能力和海马区神经细胞相关凋亡基因表达的影响。
1 材料与方法
1.1 实验动物 本次实验从湖南省长沙天勤生物技术有限公司[许可证号:SCXK(湘)2022-0011]购买60只Wistar大鼠,雌雄各半,SPF级,体重160~220 g,周龄6~8周。
1.2 仪器与设备 三氯化铝(广东光华化学厂有限公司);石菖蒲颗粒(华润三九医药股份有限公司);吡拉西坦(东北制药集团);Bcl-2抗体(杭州华安生物技术有限公司);Caspase-3抗体、Bax抗体(艾比玛特医药科技有限公司);Bcl-2、Bax引物(上海生工生物股份工程有限公司);Caspase-3引物(南宁捷尼斯生物科技有限公司);多功能微孔板检测仪(帝肯Spark多功能酶标仪);实时荧光定量PCR仪(罗氏Light Cycler 96);电泳仪(WIX-EP600);高温低速研磨仪(武汉塞维尔KZ-III-F)。
1.3 动物分组与药物剂量 大鼠饲养条件需要满足,分笼喂养,温度(25±1) ℃,湿度50%~60%,饲料充分,饮水自由的条件,对大鼠所有操作严格按照右江民族医学院实验动物伦理委员会的操作规程进行。适应性饲养1周后,根据随机数字表的方法,将60只大鼠随机分为对照组、模型组、石菖蒲低剂量组、石菖蒲高剂量组和阳性对照组5个组。造模方式参考相关文献[4-7],空白对照组每天灌胃生理盐水,用生理盐水配置为10 g/L的氯化铝溶液,按照100 mg/kg给其他4个组灌胃来创建铝致大鼠认知障碍模型。模型组灌胃氯化铝溶液后不做任何处理;石菖蒲组分别以5 g/kg、10 g/kg的剂量灌胃;阳性对照组采用吡拉西坦按照400 mg/kg的剂量灌胃。造模时间为3个月。
1.4 水迷宫检测大鼠的学习记忆能力 造模期结束后,开始水迷宫行为学实验。水迷宫水池中加入没过平台约3 cm高度的水,水中加入墨水。正式实验开始前1 d,将每只大鼠放入水迷宫中游泳1 min,以适应水中环境。定位航行实验开始后,将大鼠沿每个象限的水池边放入水池中,同时另一位实验协助者操作系统开始摄像,大鼠游上平台后,系统自动结束。如果没有上平台,1 min后自动结束。前5 d重复操作,大鼠游上平台的时间即为潜伏期(s)。第6天将平台撤掉,开始空间探索实验,每只大鼠分别沿4个象限下水,游泳1 min后自动结束,记录大鼠穿越原平台位置的次数。
1.5 Wstern Blot检测大鼠海马组织Bcl-2、Caspase-3、Bax蛋白表达 水迷宫实验结束后,使用3%戊巴比妥钠对大鼠进行腹腔注射麻醉,然后立即断头,随即进行冰上操作提取大鼠海马组织,提取后的组织可放入-80 ℃冰箱冷冻长期保存。提取大鼠海马组织后,加入裂解液,用高速低温研磨仪研磨海马组织,提取蛋白。随后进行BCA浓度测定,制备蛋白样品,跑胶,转膜,蛋白封闭,孵育Bcl-2、Caspase-3、Bax抗体,孵育二抗,显影等步骤。显影条带采用ImageJ软件进行灰度值的分析。
1.6 RT-qPCR检测大鼠海马组织Bcl-2、Caspase-3、BaxmRNA表达水平 提取大鼠新鲜海马组织后,使用总RNA提取试剂盒提取海马组织中的总RNA。随后,使用cDNA试剂盒合成cDNA,并以合成的cDNA为模板进行扩增反应。上样体系和引物序列见表1、表2。

表1 上样体系

表2 引物序列
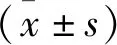
2 结果
2.1 水迷宫实验结果 与空白对照组相比,模型组大鼠的5 d平均潜伏期较长,第6天空间探索实验的站台穿越次数减少,差异有统计学意义(P<0.001)。与模型组相比,石菖蒲低剂量组、高剂量组以及阳性对照组的潜伏期明显缩短,第6天空间探索实验穿越站台次数明显增加。其中,石菖蒲高剂量组和阳性对照组与模型组之间的差异具有统计学意义(P<0.05)。见表3。
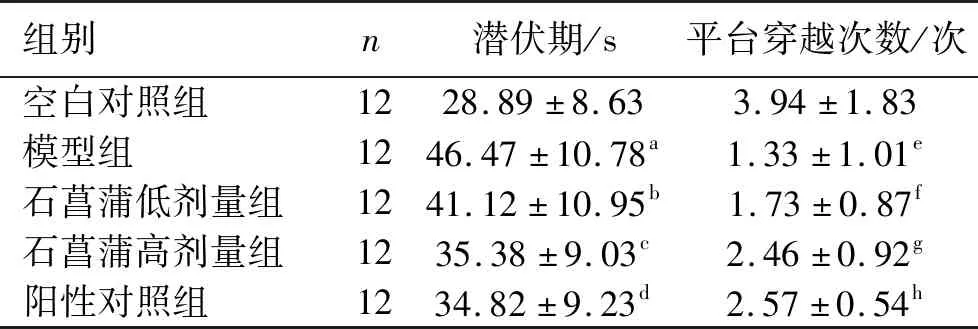
表3 Morris平均潜伏期和平台穿越次数
2.2 Western Blot实验结果 与空白对照组相比,模型组Bcl-2表达的明显下调,以及Bax和Caspase-3表达的显著上调,差异有统计学意义(P<0.001)。与模型组相比,石菖蒲低剂量组、高剂量组以及阳性对照组的Bcl-2表达明显上调,其中,石菖蒲高剂量组的差异有统计学意义(P<0.05)。与模型组相比,石菖蒲低剂量组、高剂量组以及阳性对照组Bax和Caspase-3的表达明显下调。其中,Bax的表达差异在3个组中均具有统计学意义(P<0.05或P<0.001),而Caspase-3的表达在石菖蒲高剂量组和阳性对照组之间的差异具有统计学意义(P<0.05)。见表4、图1。
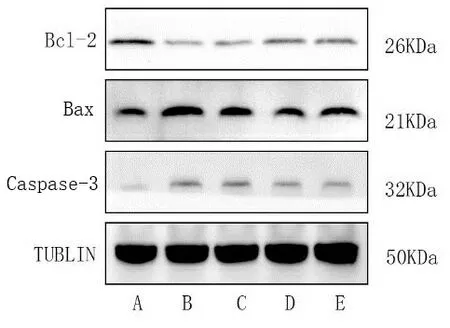
注:A.空白对照组;B.模型组;C.石菖蒲低剂量组;D.石菖蒲高剂量组;E.阳性对照组。
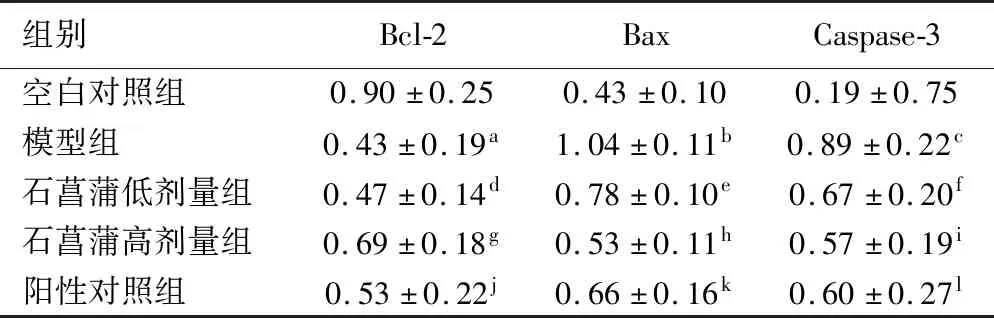
表4 各组大鼠海马组织Bcl-2、Bax、Caspase-3蛋白相对表达量的比较
2.3 RT-qPCR实验结果 RT-qPCR结果显示,每个样品孔扩增均达到平台期,且扩增效率基本一致,溶解曲线无杂峰,呈单一峰,未见非特异性扩增,特异性较好。见图2、图3。与空白对照组相比,模型组显示明显的Bcl-2表达下降,Bax、Caspase-3表达上升,这些差异具有统计学意义(P<0.001);与模型组相比,石菖蒲低剂量组、高剂量组以及阳性对照组的Bcl-2表达明显上升,其中,石菖蒲高剂量组的差异具有统计学意义(P<0.05);与模型组相比,石菖蒲低剂量组、高剂量组以及阳性对照组的Bax、Caspase-3的表达明显下降,其中,石菖蒲高剂量组的差异具有统计学意义(P<0.05),图4。

注:A.Bcl-2;B.Bax;C.Caspase-3;D.GAPDH。
注:A.Bcl-2;B.Bax;C.Caspase-3;D.GAPDH。
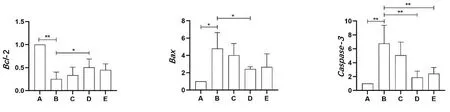
注:A.空白对照组;B.模型组;C.石菖蒲低剂量组;D.石菖蒲高剂量组;E.阳性对照组。*P<0.05,**P<0.001。
3 讨论
阿尔兹海默症(Alzheimer’s disease,AD)是一种常见的老年性神经系统退行性疾病,其特点是记忆力减退、智力下降、行为异常、情绪波动等,最终导致患者失去自理能力。认知功能障碍(mild cognitive dysfunction,MCD)作为阿尔兹海默症、帕金森病(Parkinson’s disease,PD)、亨廷顿舞蹈病(Huntington’s disease,HD)等神经退行性疾病的前驱期,了解干预认知功能障碍的药理学机制同样也刻不容缓。
铝作为一种累积的有毒金属,广泛用于日常生活[8]。环境铝暴露可能对人类和动物的神经、免疫、骨骼和泌尿系统造成毒性[9]。铝可引发与AD相关的病理过程,包括淀粉样蛋白β(Aβ)的寡聚化和积累、tau蛋白过度磷酸化的聚集、脂质过氧化、钙离子交换受损以及细胞凋亡。研究表明,神经细胞凋亡是神经退行性疾病中神经细胞死亡的关键机制之一[10]。有研究发现[11],铝会通过多种途径导致细胞凋亡,如线粒体通路、死亡受体通路、内质网通路等。B细胞淋巴瘤2家族蛋白(Bcl-2)在线粒体介导的细胞凋亡调控中扮演着关键的角色。哺乳动物细胞中至少存在20种Bcl-2相关蛋白,分为两个亚组:抗凋亡(Bcl-2、Bcl-XL)和促凋亡(Bax、Bak)蛋白。因此,拮抗家族成员之间的平衡在决定细胞存活或死亡中起着关键作用[12]。在细胞凋亡过程中,Caspase家族蛋白是典型的凋亡蛋白。在这个家族中,Caspase-3是凋亡级联反应中最为关键的效应蛋白酶,它负责执行凋亡的最后阶段[13]。
石菖蒲是中药中常用的一味药材,可以使大脑和神经系统恢复活力,被广泛用于治疗许多疾病,如癫痫、精神疾病、慢性腹泻、痢疾、发烧、腹部肿瘤、肾脏和肝脏疾病以及风湿病。石菖蒲的主要成分包括挥发油、黄酮类化合物、多糖等,这些成分具有抗氧化、抗炎、抑制Aβ的生成和聚集等多种药理作用。研究表明,石菖蒲中的多种活性成分可以通过多种途径发挥治疗AD的作用,如减轻神经元凋亡和炎症反应、抗氧化、促进乙酰胆碱的释放等[14-16]。
在本研究中,通过模型组的水迷宫行为学实验结果可以判断,铝染毒可以使大鼠学习记忆能力下降和引发认知功能障碍,本次实验铝致大鼠认知功能障碍的动物实验模型建立成功。通过Western Blot、RT-qPCR的实验结果,观察到铝导致大鼠海马区神经细胞凋亡增加,这与之前的研究结果一致[17]。通过分析用药组的实验结果,与模型组相比,石菖蒲低、高剂量组的大鼠水迷宫平均潜伏期缩短,穿越平台次数增加,学习记忆能力有所改善,并且海马区神经细胞凋亡程度有所降低。这表明,石菖蒲可以提高大鼠学习记忆能力,降低神经细胞的凋亡,对神经细胞起到保护作用。关于石菖蒲对神经细胞作用的具体机制,本文未做具体研究,根据之前的研究结果显示,石菖蒲通过上调双肾上腺皮质激素、巢蛋白、酪氨酸蛋白激酶和神经营养因子的表达来发挥作用[18]。此外,石菖蒲还通过诱导c-Jun氨基末端激酶的磷酸化,下调Bcl-2、Bcl-w的表达,抑制Caspase-1的激活,从而减少海马神经元的凋亡[19]。由于中药成分相对复杂,相对于西药有多靶点发挥作用的优势,石菖蒲在治疗阿尔兹海默症过程中存在多个靶点[20],其具体分子机制还需进一步研究。

