115例颅外孤立性纤维性肿瘤的临床病理学分析
姚晨晨, 杨旭西, 李霄, 陈刚, 范钦和, 贡其星
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一种具有NAB2::STAT6融合基因的纤维母细胞性肿瘤[1],可以发生于任何部位,其形态学谱系广泛,有多种不同的组织学亚型,包括经典型、脂肪瘤型、巨细胞型、黏液型、去分化型等。免疫表型虽有特征性抗体CD34和STAT6的阳性表达可辅助诊断,但有时抗体会有非特异性表达,或一些形态学特殊的病例出现反常的免疫表型,易造成误诊和漏诊。此外,SFT的生物学行为也一直是备受关注的问题,多数SFT病例预后良好,较少复发或转移,但个体的生物学行为难以预测,形态学经典的SFT不一定生物学行为良性;并且,颅内SFT较颅外SFT更容易出现转移,因此在最新版WHO中枢神经系统分册[2]和骨与软组织肿瘤分册[1]对于SFT的恶性诊断标准并不完全相同。因此,本文重点研究颅外SFT的临床表现、组织学形态、免疫表型、分子遗传学特征及预后评估等方面的内容并进行分析总结,以期对SFT的诊疗提供帮助。
1 资料与方法
1.1 病例资料 收集2010年1月至2020年12月南京医科大学第一附属医院病理学部诊断的颅外SFT 115例。所有病例均由高年资病理医师复诊,排除穿刺活检、肿块部分切除和信息不完整的病例。通过电子病历收集整理临床信息,包括患者年龄、联系方式、性别、发生部位、肿瘤大小、治疗方法等,并通过联系方式进行电话随访。本研究经本院医学伦理委员会通过(批号:2022-SR-338),患者及亲属均签署知情同意书。
1.2 方法 使用3.7%中性甲醛缓冲液对标本充分固定,固定后肉眼观察肿瘤的大体形态并充分取材,常规进行石蜡包埋、切片、HE染色,对所有纳入病例切片进行光镜观察。观察内容包括组织学亚型及特征(经典型、脂肪瘤型、巨细胞型、黏液型、去分化型)、核分裂计数(有丝分裂活跃区域连续观察10个高倍视野,视场面积为0.24 mm2)、坏死、细胞密度、肿瘤边界及免疫组化表达模式。选择近5年的病例,阅片后在相应蜡块上找出最具代表性的区域,使用组织芯片阵列仪,制作为组织芯片。继而对组织芯片进行免疫组化检测。采用Envision二步法染色,一抗为CD34、STAT6、BCL2、CD99、广谱细胞角蛋白(CK-pan)、CK-L、CK-7、P53、Ki-67、PAX2、PAX8、S-100,均为福州迈新生物技术开发有限公司产品。Envision试剂盒同为福州迈新生物技术开发有限公司产品,操作按照说明书进行。判读规则如下,定位于细胞膜/细胞质的抗体有:CD99、BCL2、CK-pan、Desmin、Vimentin、SMA;定位于细胞核的抗体有:STAT6、P53、PAX2、PAX8,其中P53呈弥漫核强阳性或完全阴性为突变型,呈强弱不等时为野生型。
选取组织芯片病例的相应蜡块切取3~5个5 μm厚的石蜡卷,使用QIAamp FFPE组织样本DNA纯化试剂盒提取基因组DNA,试剂盒购自凯杰企业管理(上海)有限公司。端粒酶逆转录酶(telomerase reverse transcriptase,TERT)基因检测采用扩增阻滞突变系统(ARMS-PCR)法,试剂盒购自源奇生物医药科技有限公司,试剂盒涵盖TERT启动子突变热点包括C228T和C250T。TP53基因突变采用Sanger测序法DNA测序法,靶基因包括TP53exon5-8,所用试剂盒购自厦门艾德生物医药科技股份有限公司。
对4个诊断困难的病例进行二代测序(NGS)检测。NAB2::STAT6基因融合检测选用甲醛固定-石蜡包埋组织样本连切10张4 μm厚白片,送检上海至本医疗科技有限公司进行DNAseq+RNAseq NGS大panel测序,选取针对实体瘤涵盖450+基因panel,测序平台为Illumina Hiseq4000。
2 结果
2.1 临床特征 2010年1月至2020年12月南京医科大学第一附属医院病理学部纳入颅外SFT的病例数为115例,男性45例,女性70例,年龄19~82岁,中位年龄54岁,发生部位最常见于肺/胸膜,占53.0%(61/115),其次为腹部、盆腔,占27.8%(32/115),其中8例发生于实质脏器,包括肾上腺2例,肾脏4例,前列腺1例,精囊腺1例。发生于头颈部(包括眼框6例,鼻咽部4例,面部2例,甲状腺1例)、躯干及四肢分别占11.3%(13/115)、4.3%(5/115)和3.5%(4/115)。
大部分患者临床表现为无症状,部分患者由于肿瘤压迫或侵犯周围脏器导致的局部疼痛、胸闷、腹胀、出血、眼球突出等各系统症状。
本队列所有病例均接受肿物切除术,3例接受术前血管栓塞术,2例接受术后放疗。
2.2 形态学特征 大体形态:肿瘤最大径为1~25 cm,中位数为6 cm。多数肿瘤境界清楚,部分可见完整的纤维包膜(图1A),切面灰白灰黄,质韧,呈编织状。部分肿瘤切面可见出血、黏液变性。恶性SFT 切面可呈鱼肉样,可见局灶坏死。
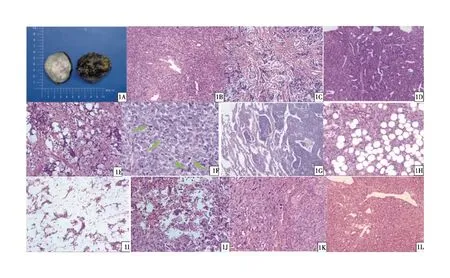
图1 孤立性纤维性肿瘤的大体及组织学形态特征 1A:经典型孤立性纤维性肿瘤大体形态为境界清楚,部分可见完整的纤维包膜,切面灰白灰黄,编制状,质韧;1B:经典型孤立性纤维性肿瘤,可见“鹿角形”血管,HE×100;1C:经典型孤立性纤维性肿瘤,稀疏区胶原背景丰富,瘢痕样胶原,HE×40;1D:经典型孤立性纤维性肿瘤,丰富区细胞密度大,血管外皮瘤样形态,HE×40;1E:间质黏液变性,呈微囊样,HE×40;1F:恶性孤立性纤维性肿瘤,肿瘤细胞异型性大,核分裂像易见,HE×400;1G:恶性孤立性纤维性肿瘤,肿瘤呈浸润性边界,侵犯周围肺组织,HE×100;1H:脂肪瘤型孤立性纤维性肿瘤,成熟脂肪细胞散在分布在经典形态中,HE×200;1I:黏液型孤立性纤维性肿瘤,黏液变性成分占比超过50%,肿瘤细胞较稀疏,HE×40;1J:巨细胞型孤立性纤维性肿瘤,多核瘤巨细胞分布于假性血管腔隙,HE×200;1K:去分化型孤立性纤维性肿瘤,左侧为去分化区域,表现为多形性肉瘤样细胞,右侧为经典型SFT形态,两者骤然过渡,HE×100;1L:去分化型孤立性纤维性肿瘤,去分化区域肿瘤细胞呈上皮样形态,仍可见“鹿角形”血管,HE×100
组织学形态:经典型SFT 99例(86.1%),其中包括恶性SFT 8例(7.0%);脂肪瘤型SFT 2例(1.7%);黏液型SFT 8例(7.0%);巨细胞型SFT 2例(1.7%);去分化型SFT 4例(3.5%)。
经典型SFT表现为肿瘤稀疏区和致密区交替出现,也可以其中一种形态为主。肿瘤细胞可为梭形、卵圆形或圆形细胞,细胞“无模式”排列,似“卵巢样间质”。间质背景由胶原构成,常出现特征性的“鹿角形”血管(图1B),血管壁薄壁扩张,但有时也表现为厚壁玻璃样变性的血管。稀疏区肿瘤细胞密度小,以梭形细胞为主,间质胶原丰富,有时可见瘢痕疙瘩样胶原(图1C)。致密区肿瘤细胞密度较大,以短梭形、卵圆形细胞为主,胶原较少,有时表现为“血管外皮瘤(hemangiopericytoma,HPC)样”(图1D)。SFT肿瘤细胞胞质稀少,呈淡嗜酸性,染色质细腻,核膜光滑,细胞异型性小,核分裂像少见,大部分<4/10 HPF。间质可见黏液变性,有时呈微囊样(图1E)。10例出现局部肿瘤性坏死,7例坏死成分超过肿瘤成分的10%。其中8例细胞密度和细胞异型性增大,以卵圆形或圆形细胞为主,核分裂像≥4/10 HPF(图1F),出现浸润性的生长方式(图1G),达到恶性SFT的诊断标准。2例为脂肪瘤型SFT,镜下表现为经典型SFT中出现成熟的脂肪成分(图1H)。8例为黏液型SFT,镜下表现为黏液变性成分达肿瘤的50%以上(图1I)。2例为巨细胞型SFT,镜下表现为出现多核瘤巨细胞,它们常附着于假血管腔(图1J)。4例为去分化SFT,镜下表现为除了具有经典SFT形态的区域外,去分化区域形态学呈高级别肉瘤样形态,可以表现为多形、梭形、上皮样细胞或未分化的小圆细胞。1例去分化区域表现为多形细胞,肿瘤细胞异型性较大,核大深染,核分裂像计数>4/10 HPF,细胞多形,间质疏松黏液样,去分化区域和经典型区域骤然过渡,界限清晰(图1K);1例去分化区域表现为上皮样细胞实性片状生长,肿瘤细胞核多形,异型性大,胞浆空泡样,间质可见“鹿角形”血管(图1L);2例去分化区域由实性片状生长的多形细胞构成,间质稀少,细胞异型性大,核分裂像计数均>4/10 HPF。
2.3 免疫组化特征 本研究队列STAT6阳性表达率为97.8%(87/89)(图2A),CD34阳性表达率为95.6%(109/114)(图2B),CD99阳性表达率为94.1%(64/68),BCL2阳性表达率为91.3%(63/69)。此外部分肿瘤还表达以下抗体:SMA(7.3%,7/96)、Desmin(1.5%,1/68)(图2C)、CK-pan(2.5%,2/79),PAX8(5.4%,3/56),PAX2(3.6%,2/56)(图2D)。

图2 孤立性纤维性肿瘤的免疫组化及分子遗传学特征 2A:STAT6表达强阳性,EnVision法 ×400;2B:CD34表达强阳性,EnVision法 ×100;2C:Desmin局灶表达膜或浆阳性,EnVision法×200;2D:PAX-2局灶表达核阳性,EnVision法 ×200;2E:P53突变型表达,EnVision法×100;2F:TERT启动子突变
2.4 分子遗传学特征 TP53突变率为7.8%(4/51),4例TP53突变位点均为exon5,1例为P.C141G,1例为P.D184N,1例为P.D184G,1例P.Q136H。1例为经典型SFT,P53蛋白为突变型表达,2例为去分化SFT,去分化区域P53均为突变型表达,分别为弥漫强阳性(图2E)和完全缺失,其余1例为恶性SFT,P53野生型表达。另有2例,虽然TP53 exon5-8未检测到突变,但免疫表达上显示为P53突变型表达,提示可能有本实验方法未检出的TP53驱动突变,其中,1例为经典型SFT,1例为去分化SFT。
TERT启动子突变率为21.4%(12/56)(图2F),1例同时具有TP53和TERT启动子突变。
NGS结果:1例为NAB2exon4::STAT6exon2融合,2例为NAB2exon6::STAT6exon16融合,其中1例伴有TERT启动子突变;1例为NAB2exon5::STAT6exon16融合伴有TP53突变,突变位点为exon5 p.C141G。
2.5 预后 95例(82.6%)得到随访,术后随访时间为0~136个月,中位随访时间为45个月,随访过程中,10例(10.5%)出现复发,5例(5.3%)出现转移,其中3例为多发转移,3例同时出现转移和复发,6例(6.3%)死亡,其中4例(4.2%)因SFT死亡。5年无进展生存率为87.4%,总生存率为93.7%,10年无进展生存率为83.2%,总生存率为93.7%。
3 讨论
1931年Klemperer和Rabin首次描述了5例胸膜SFT的形态特征[3]。1951年,这类肿瘤被Stout和Hamidi重新命名为“SFT”[4],1942年Stout和Murray首次使用HPC描述了9个病例[5]。2009年Min和Dejka回顾SFT和HPC组织病理学特征、临床特征、诊断和治疗几个方面,认为SFT和HPC是同一类肿瘤[6]。2013年,Robinson等[7]研究中发现NAB2::STAT6基因融合是这两类肿瘤的共同的致病性分子驱动因素。因此,在2013版WHO骨与软组织肿瘤分册中,废弃了HPC的诊断名称,将其作为SFT的同义名[8]。
组织学形态上,本研究大部分为经典型SFT(86.1%),另外还包括了其他罕见的形态学亚型。2例脂肪瘤型SFT分别位于四肢和头颈部,脂肪成分均为成熟脂肪细胞。脂肪瘤型SFT中也曾报道少数病例可见散在的真性的多空泡状脂母细胞或非典型脂肪瘤(atypical lipomatous tumor,ALT)样区域[9],但脂肪母细胞和ALT样区域更频繁地出现在恶性SFT中[10]。Bai[11]曾报道1例含有脂肪肉瘤成分、原发于胸膜的恶性SFT。当SFT中出现脂肪母和ALT样细胞时,或去分化脂肪肉瘤有时呈现SFT样形态,脂肪瘤型SFT容易与去分化脂肪肉瘤造成混淆,但即使在恶性脂肪瘤型SFT的ALT样区域,仍然可以识别出在普通SFT中看到的显著扩张的分支血管,这在ALT中是罕见的。在疑难病例中,需要进行MDM2和CDK4免疫染色或分子检测[10],以排除脂肪肉瘤的诊断。此时SFT诊断特异性抗体STAT6有时并不能起到很好的鉴别作用,因为STAT6基因邻近MDM2基因,容易发生共扩增,导致去分化脂肪肉瘤出现STAT6表达[12],是一个需要注意的诊断陷阱。本研究中黏液型SFT均可见经典的SFT形态,出现与经典形态的过渡是我们诊断黏液型SFT重要的诊断依据和线索;当出现间质广泛黏液变性时,黏液型SFT还需与低度恶性纤维黏液样肉瘤、黏液样脂肪肉瘤、黏液样梭形细胞脂肪瘤、黏液性神经纤维瘤等富含黏液的梭形细胞肿瘤进行鉴别[13]。本研究中去分化型SFT去分化成分表现为高级别肉瘤成分,表现为多形细胞和上皮样细胞,除此之外,还可以表现为梭形细胞和未分化小圆形细胞,各种肿瘤成分可以单独或组合出现[14],去分化成分中有时会出现异源性成分,如横纹肌肉瘤[15]、骨肉瘤[16]、腺癌[17]和鳞形细胞癌等[18],去分化SFT成分和经典型SFT成分往往过渡突然。
免疫组化方面,在本队列中,除了常见的SFT免疫组化表型CD34、STAT6、CD99、BCL2的阳性表达以外,还在少数病例中出现SMA,Desmin,CK-pan,PAX2,PAX8的反常表达。Mosquera等[19]曾报道部分SFT病例在去分化和经典区域均局灶表达EMA,在去分化区域偶可见CK的阳性表达。Bakhshwin[20]报道的2个发生于前列腺的、类似肉瘤样癌的去分化SFT病例中,肿瘤细胞可见EMA、P63、P40、CK-H、PR、GATA-3局灶表达,其中1例局灶表达NKX.3.1。当去分化成分为胚胎型横纹肌肉瘤时,免疫组化局灶表达Desmin、Myogenin[14]。在我们的病例中,1例Desmin阳性、1例CK-pan阳性、1例PAX8阳性及1例PAX2阳性均考虑为去分化SFT的异常免疫表型,但还有7例SMA阳性、1例CK-pan阳性、2例PAX8阳性及1例PAX2阳性均发生于经典型SFT。考虑到SMA是肌纤维母细胞的标记物,且经常出现非特异性表达,而CK-pan亦可罕见于肌纤维母细胞中表达,我们重点参阅文献探究PAX2和PAX8的阳性意义。PAX2和PAX8是肾上皮源性肿瘤、卵巢肿瘤或生殖细胞肿瘤的标志物,但近期文献报道软组织肿瘤中也可出现PAX2或PAX8的表达,如双表型鼻腔鼻窦肉瘤、横纹肌肉瘤、纤维肉瘤[21]、滑膜肉瘤[22]、血管平滑肌脂肪瘤等[23]。此外,在SFT中,也有研究发现,部分SFT可表达PAX2或PAX8,是诊断陷阱之一,但其表达与肿瘤部位、肿瘤大小、年龄及恶性生物学行为没有显著相关性[24]。因此,肿瘤的异常免疫表达有时可以证实其其他分化方向的特征,并造成一定的诊断困难,但其临床意义仍需得到进一步的研究。
2013年,两个分子遗传学方面的独立研究同时发现了SFT具有特征性的可重复的12p染色体臂内易位,导致了NAB2::STAT6基因融合[7,25],且此融合基因是SFT肿瘤发生的驱动性突变。目前,依据NAB2和STAT6基因融合时发生的断点位置和拼接位点的不同,将其分为不同的融合变异体,据文献报道已有超过40个,其中,NAB2ex4::STAT6ex2/3和NAB2ex6::STAT6ex16/17融合变异体出现的频率最高。研究发现最常见的融合变异体与形态学和一些临床病理参数相关。NAB2ex4::STAT6ex2/3的SFT表现出细胞稀疏、梭形细胞为主及伴有丰富胶原间质的经典形态,且有丝分裂较不活跃,另外,此类SFT更常见于胸腔(胸膜、肺),患者年龄偏大;相反,NAB2ex6::STAT6ex16/17的SFT表现为更多的圆形和卵圆形肿瘤细胞,与HPC的形态相关,有丝分裂活性较高,常发生于腹膜后深在软组织和腹、盆腔内[26-27]。在我们的队列中,4例经NGS检测的SFT均具有致病性的NAB2::STAT6融合基因,其中2例NAB2exon6::STAT6exon16融合,1例为NAB2exon4::STAT6exon2融合,均为较常见的“NAB2-STAT6”融合变异体,其相应肿瘤的形态学也确实符合文献所述。另1例为NAB2exon5::STAT6exon16融合,较为罕见,且此例的形态学也不典型,表现为上皮样细胞的片状生长,是否与特殊的融合变异体相关,还需要更多病例的积累去证实。
此外,分子病理学研究发现部分SFT有TP53和TERT启动子突变。Machado等[28]的研究认为TP53突变或(和)TERT启动子突变与肿瘤侵袭性行为有较强的相关性。本研究中具有TP53突变的病例无进展生存率为50%(2/4),其中2例组织学亚型为去分化型,1例为恶性SFT。Park等[29]研究中TP53突变与核异型性增加、有丝分裂活跃、Ki-67增殖指数增高显著相关,与我们的观察结论是一致的。另外,研究中还出现了未检出TP53突变但免疫组化仍为突变表型的病例,这可能是由于当前研究检测方法具有局限性。然而因为TP53突变与免疫组化P53的突变型表达(过表达或全阴性)相关[29],因此我们认为当免疫组化P53染色出现突变型表达时,可以替代TP53分子检测结果提示SFT预后较差。另外,TERT启动子突变也与SFT恶性的临床特征显著相关,包括年龄更大、肿瘤体积更大,有丝分裂活性更高(或无关)、坏死、分级更高[28,30]。本研究中,伴TERT启动子突变的病例无进展生存率为25%(3/12),3例均具有恶性的组织学特征:核分裂象增多和细胞密度增大,与上述结论相一致。
生物学行为上,文献报道的SFT的局部复发或远处转移10%~30%[31]且有10%~40%的复发是在术后5年后发生[32]。因此推荐对SFT病例进行长期随访。并且,由于少数具有良性组织学形态的病例也会发生转移,单纯根据组织形态学较难精准地预测其生物学行为,因此,以往多数SFT被归为中间性肿瘤,ICD编码是1,除了少数形态学符合恶性SFT诊断标准的,ICD编码为3。但近年来,经过大量的病例随访和生存预后分析的研究,提出了多种预测复发、转移风险的分层模型。最著名的属Demicco等提出了包括年龄(55岁以下或55岁及以上)、肿瘤大小(<5 cm至≥15 cm,增量为5 cm)、有丝分裂计数(0、1至3或≥4/10HPF)、有无肿瘤性坏死(<10%或≥10%)[1]的风险分层模型,将SFT分为低、中、高风险。此外,法国肉瘤组织也发表了一项风险计算方法,使用患者年龄、肿瘤部位、有丝分裂细胞计数和放疗史来预测局部复发和转移复发[33]。他们的发现也证实了初次切除后10~20年延迟复发的情况并不少见,再次强调了对于SFT需要长期随访。与此同时,最新版WHO骨与软组织肿瘤分册[1]中SFT的ICD编码也分别有0、1、3,肯定了SFT中有生物学行为良性病例的存在。在我们的队列中,SFT的复发或远处转移率仅为12.6%,大部分SFT生物学行为良性。12例患者发生复发或远处转移,其中4例具有恶性的组织学形态,其余病例在形态学上为良性,但仍发生较差的预后,因此仅依赖组织学所区分的良恶性肿瘤预测SFT的预后显然是不足的,而使用风险分层模型,如WHO推荐使用的mDemicco风险分层模型预测SFT的预后是目前为止更好的方法。

